PRODUZIONE DI PROTEINE DA GENI CLONATI IN PROCARIOTI.
-
Upload
salvatrice-cattaneo -
Category
Documents
-
view
221 -
download
4
Transcript of PRODUZIONE DI PROTEINE DA GENI CLONATI IN PROCARIOTI.

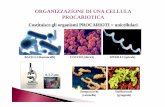
PRODUZIONE DI PROTEINE DA GENI CLONATI IN PROCARIOTI

fermentatore

Vettori a cassetta
PRODUZIONE DI PROTEINE DA GENI CLONATI IN PROCARIOTI


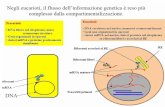
Espressione di geni esogeni in procarioti
PRODUZIONE DI PROTEINE A PARTIRE DA GENI CLONATI
Riconosciuto dalla subunità sigma RNA pol E. coli

Sequenze promotore in procarioti e eucariotiriconosciute da RNA polimerasi specifiche


Monitoraggio della proteina esogena con possibili effetti dannosi sul procariote

Ceppo speciale di E. coli lisogeno per T7 (fago T7 integrato e alterato: gene per RNA pol T7 a valle del promotore lac, indotto dall’IPTG )
promotore tac: ibrido tra trp e lac

SVANTAGGI PER LA PRODUZIONE DI PROTEINE ETEROLOGHE IN BATTERI
- Non vengono rimossi eventuali introni
- Possibile formazione di strutture secondarie della porzione iniziale trascritto (fig)
- Possibile presenza di segnali di terminazione per il batterio (fig)
- Propensione per alcuni codoni (fig)
- Mancanza di modificazioni post-traduzionali (glicosilazioni, fosforilazioni, etc.)
- Limite della lunghezza amminoacidica
- Mancato ripiegamento della struttura terziaria e sovraespressione determinano i corpi di inclusione

Formazione di strutture secondarie all’inizio del trascritto quali possibili conseguenze per inserimento sequenza esogena


Vettori a cassetta per la fusione di geni in E. coli
Vantaggi di una proteina di fusione in frame:- presenza seq. nucleotidica di E. coli per legame ribosoma- peptide batterico iniziale stabilizzante- peptide batterico iniziale da utilizzare come segnale localizzazione cellulare (esportata nel mezzo di coltura o tra membrana esterna ed interna
Fusione con parte iniziale di gene batterico
Aumento resa e solubilità proteina eterologa

Fusione con la proteina di E. coli Glutatione-S-transferasi (GST) e purificazione con cromatografia per affinità al substrato (glutatione)
Vettore:componente N-terminale della GST,componente C-terminale proteinada purificare.Promotore Lac inducibile
Glutatione: tripeptide (cisteina, glicina, ac. glutammico)
libero

Rimozione della proteina di fusione
es: con bromuro di cianogeno (se alla giunzione c’è metionina), con trombina (taglia adiacente a residui di arginina). Non deve essere tagliata all’interno la proteina di interesse!

Proteina priva di struttura terziaria precipita e forma corpi di inclusione.Aggregati recuperati in forti condizioni denaturanti che non permettonocorretto ripiegamento in vitro della proteina che quindi sarà inattiva!

Screening cloni batterici trasformati con vettori di espressione

Screening cloni batterici trasformati con vettori di espressione

Produzione di proteina
- studi biochimici e funzionali, cristallografici
- produzione anticorpi specifici

SVANTAGGI PER LA PRODUZIONE DI PROTEINE ETEROLOGHE IN BATTERI
- Non vengono rimossi eventuali introni
- Possibile formazione di strutture secondarie della porzione iniziale del trascritto
- Possibile presenza di segnali di terminazione per il batterio
- Propensione per alcuni codoni
Mancanza di modificazioni post-traduzionali (ponti disolfuro, glicosilazioni, fosforilazioni, acetilazione, carbossilazione, etc.)
- Limite della lunghezza amminoacidica
- Mancato ripiegamento della struttura terziaria e sovraespressione determinano i corpi di inclusione

PRODUZIONE INDUSTRIALE DI PROTEINE DA COLTURE DI CELLULE EUCARIOTICHE (LIEVITI E FUNGHI)
COMPOSTO MICRORGANISMO
AntibioticiPenicilline Penicillium spp. Cefalosporine Cephalosporium sppCloramfenicolo, streptomicina Streptomyces spp.
EnzimiProteasi, amilasi Bacillus ssp. (batterio), Aspergillus
spp.
Alcool S. cerevisiaeAceto S. cerevisiae ac. AceticoAcetone Clostridium ssp.
BIOTECNOLOGIE: USO DEI PROCESSI BIOLOGICI NELL’INDUSTRIA E NELLA TECNOLOGIA

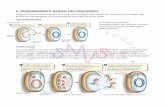
VETTORI DI CLONAGGIO PER GLI EUCARIOTI
Lieviti e funghi filamentosi: produzione di proteine eterologhe anche a scopi biotecnologici con sintesi di prodotti medicinali o alimentari
Saccharomyces cerevisiae
Fungo unicellulare
Ruolo fondamentale per produzione di birra e pane
Vantaggi: conoscenza genetica e biochimica, facilità di coltura, alta resa
Possibile utilizzo per clonaggio del plasmide naturale 2 µm
Svantaggi: iperglicosilazione, difficoltà di secrezione delle proteine prodotte nel terreno di coltura, propensione per un codone

Galattosio epimerasi
PROMOTORI UTILIZZATI IN VETTORI DI ESPRESSIONE PER EUCARIOTI MICROBICI

Esempio di glicosilazione dell’asparagina.L’iperglicosilazione di alcuni funghi può provocare reazione antigenica se la proteinaè iniettata

Saccharomyces cerevisiae
2 µm:plasmide naturale 6,3 kb,tra 70-200 copierisiede nel nucleo,si replica autonomamente,segrega sia in meiosiche in mitosi
REP1 e REP2 (per replicazione)FLP (proteina che riconosce siti specifici nel DNA del lievito: integrazione per ricombinazione )OriD = funzione ignota

Vettori basati sul plasmide 2 µm: plasmidi episomici di lievito = YEp
Procedura- clonaggio in seq. di pBR322-selezione dei ricombinanti in E. coli (resistenze antibiotici)- inserimento in lievito e selezione (LEU2)
Saccharomyces cerevisiae

Vettori basati sul plasmide 2 µm: plasmidi episomici di lievito = YEp
Saccharomyces cerevisiae

Vettori basati sul plasmide 2 µm: plasmidi episomici di lievito = YEp
Solo una copia di LEU2funziona
Solo occasionalmente si integraRicombinazione omologa tra geni LEU 2
Saccharomyces cerevisiae

Plasmide integrativo di lievito: YIp = plasmidi batterici (pBR322) con resistenza antibiotici per selezione in batteri + URA3 (gene di lievito per la selezione)
Saccharomyces cerevisiae
Non contiene i geni di 2 µm (REP e ori) e non si può replicare se non si integra nel DNA dei cromosomi di lievito, stesso meccanismo di YEp

Saccharomyces cerevisiae
Criteri di scelta: efficienza di trasformazione, numero di copie, stabilità
YIp: ideale per stabilità in coltura a lungo termine

Saccharomyces cerevisiae
Caratteristiche del clonaggio in YEp:- Frequenza di trasformazione molto alta: da 10000 a 100000 cellule trasformate per microgrammo di DNA plasmidico- Alto numero di copie: tra 20 e 50 per cellula- Svantaggi: nel processo di gemmazione spesso copie YEp non segregano nella cellula figlia
QUINDI ALTA PRODUZIONE PROTEINA DEL GENE CLONATO MA INSTABILITA’ DELLA TRASFORMAZIONE
Caratteristiche del clonaggio in YIp:-Frequenza di trasformazione bassa: 1000 cellule trasformate per microgrammo di DNA plasmidico per bassa efficienza di integrazione cromosomica- E’ presente in una sola copia per cellula
QUINDI BASSA PRODUZIONE PROTEINA DEL GENE CLONATO MA GRANDE STABILITA’ DELLA TRASFORMAZIONE PER LUNGHI PERIODI
DI COLTURA