Potenziale d'azione, principio dell'adattamento, sinapsi eccitatorie e inibitorie, cAMP, inositoli...
-
Upload
api-3704348 -
Category
Documents
-
view
4.135 -
download
0
Transcript of Potenziale d'azione, principio dell'adattamento, sinapsi eccitatorie e inibitorie, cAMP, inositoli...

La propagazione del potenziale d’azione è il fenomeno elettrico attivo e che si auto rigenera e che viene propagato lungo gli assoni nervosi. Ci sono 2 tipi di strategie per aumentare la velocità di propagazione, una che si basa sull’aumento del diametro della fibra ed è utilizzato dagli invertebrati l’altro è utilizzato dai vertebrati e consiste nel costruire un manicotto attorno alla fibra nervosa che si chiama guaina mielinica. Le cellule responsabili della costruzione di questa guaina mielinica non sono i neuroni stessi ma sono 2 tipi di cellule gliali (cellule di supporto alle cellule nervose). A livello periferico la guaina mielinica è ad opera delle cellule di swann che ogni 1-2 mm si avvolgono e formano l’internodo, una cellula per manicotto. (Per ogni metro di assone circa 1000 cellule di swann). A livello del SNC non c’è spazio a disposizione per le cellule di swann, quindi a questo livello le guaine mieliniche vengono formate dagli oligodendrociti ognuno dei quali mediamente forma un manicotto per 3 fibre nervose, tutto ciò per risparmiare spazio. Al disotto del micron di diametro per le fibre nervose non esistono guaine mieliniche perché se si considerano le resistenze di membrana, capacità, diametro ecc. (vedi lezione 4) si ottengono questi 2 tracciati (fig. 1);
Figura 1
è un grafico in cui, in funzione del diametro della fibra in micron, abbiamo la velocità della propagazione del potenziale d’azione espressa in m/s, per le fibre mieliniche e per quelle amieliniche. Per quanto riguarda la fibra amielinica la velocità di propagazione è proporzionale alla radice quadrata del raggio della fibra (circa). La relazione che unisce la velocità di propagazione nelle fibre mieliniche è direttamente proporzionale con il diametro delle fibre stesse. Dal grafico si nota che al di sotto di un micron di diametro la velocità di propagazione delle fibre amieliniche è superiore a quella delle fibre mieliniche. Ecco
perchè nel corpo umano non si trovano fibre mieliniche al di sotto di un micron di diametro, sarebbe controproducente e più costoso in termini di costo energetico per ottenere comunque una velocità di propagazione più ridotta rispetto alle fibre mieliniche.
La fig.2 parte 1 mostra cosa succede per quanto riguarda il potenziale di azione nei vari distretti del neurone.
Figura 2
A sinistra sta l’input sinaptico che da origine ad una depolarizzazione di membrana che si propaga in maniera passiva dai dendriti al corpo cellulare. Questa depolarizzazione in questo punto non sono in grado di dare luogo ad un potenziale di azione perché nel corpo non risiede alcun canale ionico. Questi si trovano invece nel cono d’emergenza (o zona di innesco). Se la depolarizzazione che ha avuto luogo nella sinapsi riesce a propagarsi passivamente fino alla zona di innesco ed è abbastanza elevata per far superare la soglia parte la risposta attiva che è il potenziale d’azione.
Il Grafico in fig.2 parte 2 spiega cosa succede per quanto riguarda i potenziali lungo il neurone. Abbiamo un valore di potenziale “soglia” oltre il quale abbiamo l’innesco del potenziale di azione che ha un valore attorno ai -35mV -40mV lungo tutto il corpo cellulare non perchè qui ci siano i canali del Na voltaggio dipendenti ma perchè se il potenziale arriva a questo valore in questo punto arriva oltre soglia data la costante di spazio. Arrivato alla zona di innesco il potenziale soglia diminuisce perchè la densità di canali Ka voltaggio dipendenti è molto elevata, quindi la probabilità di aprirli aumenta molto di più in funzione del potenziale. Quando il potenziale incrocia il valore di soglia si cominciano ad aprire i canali del Na voltaggio dipendenti e parte il potenziale d’azione. Il potenziale di azione, come ampiezza, è sempre uguale a se stesso quello che può variare è la frequenza dei potenziali di azione. Il numero di potenziali di azione che possono essere generati nell’unità di tempo in
Lezione 5 - 17 Marzo 2005
1

funzione del valore del potenziale post- sinaptico è mostrato nella fig.3
Figura 3(FREQUENZA DI SCARICA DEL POTENZIALE DI AZIONE)
Sostanzialmente dipende dall’intensità della depolarizzazione che arriva al cono di emergenza. in questo grafico si ha in ascissa il valore in mV del potenziale post-sinaptico integrato che è la depolarizzazione che nasce nei dendriti e arriva al cono di emergenza e in ordinata la frequenza dei potenziali di azione. Fintanto che si ha un potenziale post-sinaptico che è inferiore al valore di soglia non si ha l’instaurarsi di nessun potenziale d’azione, quindi frequenza zero. La linea comincia a partire da un certo valore che corrisponde al valore soglia. Nel momento in cui si comincia ad evocare potenziali di azione, dato che il valore del potenziale di membrana è piuttosto elevato perché si deve passare la soglia, la frequenza iniziale dei potenziali di azione non è bassa. La traccia non parte da zero ma in corrispondenza del potenziale soglia. Da questo punto in poi la frequenza dei potenziali di azione è direttamente proporzionale all’ampiezza della depolarizzazione. Maggiore è la depolarizzazione maggiore è la frequenza di potenziali di azione che partono. Questa proporzionalità diretta non va all’infinito ma arriva a plateau quando giunge al valore di frequenza di potenziali di azione massimo. Esiste un valore massimo perché esiste una refrattarietà assoluta che vale massimo 1ms non si possono quindi avere 2 potenziali d’azione in meno di 1ms. (11’00’’). Al massimo si possono avere 1000 potenziali di azione in 1s, ragion per cui la frequenza massima ottenibile è di circa 1kHz. Ecco perché questa curva ad un certo punto descrive un plateau, quindi la proporzionalità diretta non viene più rispettata. Visto che la frequenza di potenziali d’azione quando parleremo di sistemi sensoriali è un modo molto importante per i sistemi stessi di
comunicare è opportuno avere la massima gamma possibile di frequenze disponibili. Non è possibile avere una frequenza più alta di un certo valore (1kHz), quello che si può provare a fare è cercare di abbassare la frequenza iniziale di scarica in modo tale da poter guadagnare un po’ di frequenze dove sul grafico non compaiono (perché come si è detto arrivato l’impulso più alto del valore di soglia si ha subito una frequenza alta); quello che alcuni tipi di neuroni fanno per la loro funzione nell’ambito dei sistemi sensoriali è quello di cercare di abbassare la traccia facendola partire più in basso, in modo tale che uno stimolo appena appena al di la della soglia si abbia una frequenza di scarica di potenziali di azione molto bassa, molto più bassa che in altri tipi cellulari che invece non controllano questo parametro. Come si fa ad abbassare la frequenza di scarica? Si utilzza un tipo di canali potassio chiamati KA (già visto parlando del potenziale d’azione). Questi canali per il potassio sono voltaggio dipendenti, quindi anch’essi si aprono quando il potenziale di membrana diventa più positivo del valore di riposo. La loro cinetica di attivazione e di inattivazione è identica ai canali del sodio voltaggio dipendenti, quindi la corrente di potassio portata da questi canali di fatto ricalca molto fedelmente quella che è la corrente di sodio che è portata dai canali di sodio voltaggio dipendenti durante il potenziale d’azione. Come fanno ad abbassare il potenziale d’azione? Non appena il potenziale di membrana arriva appena appena a soglia si aprono i canali del sodio voltaggio dipendenti e quindi parte il potenziale d’azione, ma si aprono anche i canali KA. Se lo stimolo da noi fornito è troppo basso questa corrente di potassio uscente (il potassio esce sempre dalle cellule) si oppone alla corrente di sodio che entra e quindi impedisce alla cellula di sparare un potenziale d’azione. L’effetto dei canali KA, quindi, è quello di evitare che vengano sparati dei potenziali di azione quando lo stimolo è molto debole (intorno alla soglia), questo si traduce nel fatto che alcuni potenziali di azione verranno sparati altri no, complessivamente si riduce la frequenza di scarica di potenziale di azione proprio per questi valori che sono vicini alla soglia, perché poi andando più in la, la corrente di sodio sarà molto più grande di quella del potassio e quindi avremo comunque l’insorgere di un potenziale d’azione. Questo giochettino funziona solo per valori di depolarizzazione intorno al valore soglia proprio perchè tra l’inizio di una piccola corrente sodio che entra e comincia il ciclo di Hodchkin che tende a depolarizzare ulteriormente la membrana e l’attivazione contemporanea della corrente potassio che esce che invece tende a bloccare la depolarizzazione. Se vince la corrente potassio non abbiamo l’innesco del potenziale d’azione se invece vince la corrente sodio
Lezione 5 - 17 Marzo 2005
2

l’abbiamo. In alcuni casi vincerà la corrente potass io e in la t r i que l la sod io , complessivamente la frequenza dei potenziali di azione in quella regione viene diminuita.
Figura 4(PRINCIPIO DELL’ADATTAMENTO)
L’adattamento è un altro processo molto importante nei sistemi sensoriali. La figura 5 spiega come un neurone si “adatta”. L’adattamento vuol dire diminuire la frequenza di scarica nonostante ci sia uno stimolo di intensità costante che viene mantenuto. il primo grafico abbiamo il valore del potenziale di membrana in funzione del tempo. All’inizio viene stimolata la cellula (viene depolarizzato il potenziale di membrana) e le linee verticali indicano i potenziali di azione. All’inizio sono più frequenti, poi man mano che lo stimolo perdura diventano via via sempre meno frequenti. Il secondo grafico riporta la frequenza dei potenziali di azione in funzione del tempo. Dopo un picco iniziale la frequeza diminuisce e fintanto che rimane attivo lo stimolo e si assesta poi ad un valore molto più basso. In seguito all’insorgere di uno stimolo si ha una frequenza di scarica di potenziale d’azione e poi se lo stimolo perdura immutato la frequenza di potenziale d’azione diminuisce. Perchè abbiamo questo fenomeno? Nei
neuroni non ci sono solo canali Na e K ma anche canali per il Ca2+ voltaggio dipendenti che fanno entrare il calcio nella cellula quando il potenziale di membrana diventa più
positivo di un certo valore, più o meno elevato a seconda del tipo di canale Ca. Quando si aprono i canali calcio e il calcio entra al l’ interno del la cel lula, dal la sua concentrazione all’interno della cellula che è tenuto costantemente bassissima (circa 10-7-10-8M, nell’ordine delle nmol/L) la concentrazione degli ioni Ca aumenta sensibilmente. All’aumento di concentrazione segue l’apertura di un tipo particolare di canali per il K, che sono i canali K calcio attivati. Questi canali potassio, quindi, r imangono apert i f intanto che la concentrazione di Ca all’interno della cellula rimane elevata oltre un certo valore. Se lo stimolo persiste, come nei grafici di fig 5, il potenziale di membrana rimane depolarizzato, se rimane depolarizzato e a maggior ragione ad ogni potenziale d’azione, il Ca continua ad entrare in cellula perché i canali del calcio voltaggio dipendenti sono aperti. Più calcio entra in cellula e si accumula, maggiore è l’attivazione di questi canali K calcio attivati. Qeusti canali lasciano uscire il potassio quindi si oppongono al le depolar izzazioni di membrana. In questo caso si oppongono
Lezione 5 - 17 Marzo 2005
3

all’insorgere di un nuovo potenziale d’azione. Ecco allora spiegato come mai la frequenza di potenziale d’azione rallenta nel tempo se lo stimolo viene mantenuto, Maggiore è la durata dello stimolo, maggiore è la frequenza di potenziali d’azione, maggiore è l’ingresso di calcio in cellula, maggiore è l’attivazione dei canali K calcio attivati, maggiore è la corrente di ioni potassio che si oppone ad una nuova depolarizzazione e un nuovo innesco di potenziale d’azione, e quindi nel tempo è sempre più difficile dare origine ad un nuovo potenziale d’azione. Questo è il meccanismo dell’ADATTAMENTO. In alcuni sistemi come quello in fig 5 l’adattamento non è totale, quindi, rimane una certa frequenza di scarica basale molto più bassa che non all’inizio, altri sistemi sensoriali si adattano del tutto, quindi la seconda curva della figura invece che mantenersi ad un valore costante torna a zero, a seconda del sistema sensoriale che stiamo trattando. In alcuni sistemi se lo stimolo dura immutato per un certo lasso di tempo il recettore non scarica più.
Come le cellule nervose comunicano tra di loro? Il sistema nervoso non è un sincizio come può essere il muscolo striato scheletrico o quello cardiaco. Il sistema nervoso è costituito da cellule singole isolate che devono trasmettersi un’informazione. L’informazione è la depolarizzazione del potenziale d’azione e questa informazione deve poter transitare da una cellula all’altra. Essendo però delle cellule isolate bisogna trovare il modo di far passare questa informazione da una cellula all’altra. Ecco perché esistono queste strutture che si chiamano sinapsi che sono i punti di collegamento tra un neurone e quello successivo. Esistono due tipi di sinapsi: di tipo elettrico e di tipo chimico.
Nella tabella 1 abbiamo il riassunto delle differenze tra questi due tipi di sinapsi, che riguardano alcuni parametri. Ad esempio la distanza tra la membrana presinaptica e quella posts inaptica. La membrana presinaptica è quella della cellula da cui proviene l’impulso nervoso. La membrana postsinaptica è quella della cellula alla quale deve arrivare l’impulso nervoso. Si nota che c’è almeno un ordine di grandezza di differenza tra le due. Nelle sinapsi elettriche le due membrane sono accostate circa alla
Sinapsi Elettrica
Sinapsi Chimica
3,5nm Distanza tra membrana pre e
post sinaptica
20-40nm
Si Continuità citoplasmatica
No
Gap Junction Componenti ultrastrutturali
Vescicole presinaptiche e
recettori postsinaptici
Corrente ionica
Metodo di Trasmissione
Mediatore Chimico
Virtualmente assente
Ritardo di Trasmissione
1-5ms
Bidirezionale Direzione di Trasmissione
Monodirezionale
Tabella 1
stessa distanza che rappresenta lo spessore della membrana cellulare (3,5nm). Mentre mediamente la distanza tra 2 cellule è di circa 20 nm nel sistema nervoso centrale che viene mantenuta nelle sinapsi chimiche. Quindi la distanza tra la membrana presinaptica e postsinaptica è molto più piccola nelle sinapsi elettriche che non nelle sinapsi chimiche. Una differenza fondamentale è continuità citoplasmatica; le due cellule che sono unite mediante sinapsi elettrica sono in continuità anche per quanto riguarda il citoplasma. Ciò vuol dire che tra queste due cellule non avviene solo un passaggio di informazione elettrico ma può avvenire anche un passaggio di informazione metabolica. Piccoli metaboliti fino a circa 1kDa di peso possono transitare attraverso le strutture che formano la sinapsi elettrica, ad esempio il Ca può passare attraverso queste strutture, quindi, di fatto, le cellule che sono unite da sinapsi elettriche sono anche unite per certi versi anche dal punto di vista metabolico. Ciò che accade metabolicamente in una cellula può propagarsi anche alle altre. Ciò che invece non è possibile che accada nella sinapsi chimica perché le due cellule sono, dal punto di vista del citoplasma, staccate, ognuna è confinata all’interno della propria membrana. Quali sono i componenti ultrastrutturali che ci aiutano a capire, guardando una parte di tessuto nervoso, se qui c’è o non un tipo di sinapsi? Nella figura 6 parte 1 viene descritta una struttura tipica della sinapsi elettrica: la gap junction.
Lezione 5 - 17 Marzo 2005
4

Figura 6
Queste sono delle unioni tra cellule e il “gap” sta ad indicare che di fatto non c’è una fusione tra le membrane delle due cellule ma rimane questo spazio di circa 3,5nm. Le gap junction sono formate da tante unità chiamate connessoni; ciascuna di loro da dodici proteine che sono chiamate connessine (responsabili di diverse malattie di natura genetica se non funzionanti a causa di mutazione genetiche a carico dei geni codificanti questa proteina). Queste connessine formano dei canali (indicati in fig 6) che attraversano completamente le membrane delle due cellule, ciascuna cellula provvede ad un emicanale, cioè la metà di
questo canale. Le connessine si appaiono sei per parte. Attraverso questo canale passano gli ioni (Na, K, Cl, Ca, e c c . . . ) e p i c c o l i metaboliti fino ad 1kDa di peso. Mentre, per quello che riguarda la sinapsi chimica, non esistono connessine ma a b b i a m o d e l l e vescicole a livello della cellula presinaptica e abbiamo delle proteine di membrana chiamati recettori a livello della m e m b r a n a postsinaptica, quindi di natura completamente diversa. Dif ferenza sostanziale è il metodo d i t r a s m i s s i o n e dell’informazione. Per quanto riguarda la s inapsi elettr ica i l metodo di trasmissione dell’ informazione è dato dalla corrente ionica; è una corrente di ioni che passa da una cellula all’altra
attraverso i canali costituiti dalle connessine. Per quanto riguarda la sinapsi chimica il mediatore dell’informazione tra una cellula e quella successiva non è più niente di elettrico ma è un mediatore chimico. Quindi in qualche modo il segnale elettrico deve essere trasformato in un segnale chimico, questo segnale chimico deve essere rilasciato e arriva alla cellula postsinaptica e poi questo segnale chimico viene ri-trasformato in un segnale elettrico. Questo non avviene nelle sinapsi elettriche perchè è una corrente di ioni che passa da una cellula all’altra. Questa differenza di modalità di trasmissione dell’impulso del segnale elettrico implica che esista quello che si chiama “ritardo di trasmissione”. Per quello che riguarda le sinapsi elettriche questo ritardo non esiste, la corrente è abbastanza istantanea per cui si dice che è virtualmente assente. Nel momento in cui il potenziale di membrana della cellula presinaptica varia, varia anche quello della cellula postsinaptica. Questo invece non è vero per quello che riguarda le sinapsi chimiche, perché questo processo di trasformazione dell’impulso elettrico in m e d i a t o r e c h i m i c o e p o i contro-trasformazione in impulso elettrico, introduce un ritardo sinaptico che mediamente varia tra 1 e 5 ms (può essere anche meno: 0,4ms in alcune sinapsi p a r t i c o l a r m e n t e v e l o c i ) . U n ’ a l t r a fondamentale caratteristica è la direzione della trasmissione dell’informazione. Per
Lezione 5 - 17 Marzo 2005
5

quanto riguarda le sinapsi elettriche quasi tutte consentono il passaggio di corrente da una cellula all’altra e vice versa. E’ quindi improprio assegnare ad una cellula una valenza presinaptica e ad un’altra una postsinaptica perché lo stesso impulso elettrico può essere generato da una o dall’altra cellula, con delle eccezioni, specialmente negli invertebrati. Ciò non esiste per due cellule che sono unite mediante sinapsi chimica per come è strutturato il meccanismo di trasmissione. E’ solo la cellula presinaptica ad avere il materiale proteico per trasformare l’impulso elettrico in chimico e portarlo sulla cellula postsinaptica (fig 7). Quindi un segnale elettrico non può trasferirsi dalla cellula postsinaptica alla cellula presinaptica. Questo rende la modalità di trasmissione nella sinapsi chimica monodirezionale.
Nel particolare la sinapsi elettrica (fig 6, parte I). le due cellule sono unite da una sinapsi elettrica con gap junction. Mediante degli strumenti andiamo a depolarizzare la cellula presinaptica (A) e andiamo a misurare la variazione del potenziale di membrana sia nella cellula presinaptica che in quella pos t s inapt ica (B ,C) . Ved iamo che istantaneamente, non appena andiamo a stimolare la cellula, quindi a depolarizzare la membrana della cellula presinaptica (B), anche la membrana del la cel lu la postsinaptica si depolarizza istantaneamente. (C). La variazione della depolarizzazione non è uguale perché, nonostante gli ioni passino attraverso i canali delle gap junction, questi stessi canali offrono una certa resistenza quindi dalla legge di Ohm sappiamo che in questo punto perdiamo un po’ di corrente, quindi la variazione del potenziale di membrana che si ha nella cellula postsinaptica sarà un po’ inferiore rispetto a quella della cellula presinaptica. Abbiamo comunque una riproduzione abbastanza fedele di ciò che è successo nella membrana presinaptica per il grafico della cellula postsinaptica nonostante la perdita di corrente. Quindi è la corrente della cellula presinaptica che comanda direttamente la variazione di potenziale della cellula postsinaptica. Da questo punto di vista non è importante che la depolarizzazione raggiunga la soglia o meno, nel senso che qualsiasi variazione del potenziale di membrana che noi possiamo fornire alla cel lu la pres inapt ica la r i t roveremo (leggermente modificata in ampiezza) nella cellula postsinaptica, sia che siano delle depolarizzazioni sia che siano delle iperpolarizzazioni. Questo non è assolutamente vero per quanto riguarda la sinapsi chimica dove vengono trasferiti solo segnali depolarizzanti e non iperpolarizzanti. Un’altra proprietà di queste sinapsi, dovuta a questa proprietà di trasferire direttamente il segnale dalla pre alla postsinaptica, è che la cellula
presinaptica deve essere molto più grande di quella postsinaptica perché altrimenti, se fosse vero il contrario, in una cellula presinaptica piccola, con meno canali ionici che lasciano entrare della corrente, non riuscirebbe (sempre per la legge di Ohm) a comandare una depolarizzazione su una cellula molto più grande che ha una resistenza di membrana molto più bassa. La legge di Ohm dice che ΔV=R ΔI. Se ΔI è piccolo e la Resistenza è bassa il ΔV che otteniamo è piccolo. Quindi una cellula presinaptica piccola che fornisce una piccola ΔI non può depolarizzare in maniera efficiente una grande cellula postsinaptica che ha una piccola resistenza di membrana. Quindi le sinapsi elettriche sono sempre strutturate in modo tale che l’elemento presinaptico sia per lo meno delle stesse dimensioni di quello postsinaptico perché altrimenti non può funzionare la trasmissione, il segnale si arresta perché nella cellula postsinaptica non può dare origine ad un potenziale d’azione. Abbiamo quindi una netta distinzione di dimensioni altrimenti la sinapsi non funziona, funzionerebbe eventualmente al contrario, visto che la trasmissione è bidirezionale. Dove troviamo le sinapsi elettriche? Per il fatto che non esiste un ritardo di trasmissione le sinapsi elettriche le troviamo in quei tessuti che necessitano necessariamente di funzionare tutti all’unisono, come ad esempio il miocardio, quindi tutte le cellule muscolari cardiache sono unite da sinapsi elettriche. Nel momento il cui viene depolarizzata una tutte quante si contraggono simultaneamente. Le troviamo anche in piccoli circuiti particolari nell’encefalo di rinforzo, dove un gruppo di neuroni molto piccoli deve scaricare in maniera sincrona in modo tale da attivare una cellula ben più grande. Sono tendenzialmente più uti l izzate negli invertebrati.Nel particolare la sinapsi chimica. Dove troviamo le sinapsi chimiche? Possono essere localizzate in posti diversi nell’ambito di un neurone (figura 6 parte seconda). Possiamo avere delle sinapsi assosomatiche, quindi dei bottoni presinaptici che terminano a livello del soma (pirenoforo) della cellula nervosa. Possiamo avere delle sinapsi assodendritiche, dei terminali presinaptici che terminano sui dendriti della cellula nervosa postsinaptica. Possiamo avere delle sinapsi asso-assoniche, dove il terminale presinaptico termina a ridosso di un bottone presinaptico di un’altra cellula nervosa. Nel dettaglio (figura 7): a livello del terminale sinaptico sono presenti i mitocondri che non sono presenti l’ungo tutto l’assone. Quindi troviamo i mitocondri sono a livello del pirenoforo, nel cono di emergenza e a livello del terminale presinaptico. Si ritrovano solo a questo livello perchè questo è il luogo dove le vescicole vengono impacchettate e quindi c’è bisogno di energia per questo processo di impacchettamento del neurotrasmettitore (mediatore chimico)
Lezione 5 - 17 Marzo 2005
6

Figura 7
all’interno delle vescicole. Quindi i terminali presinaptici possono essere soggetti a fatica perché hanno un’alta richiesta metabolica ed è per questo che li sono richiesti i mitocondri, come tutte le cellule nervose, avendo solo un metabolismo di tipo glicolitico ossidativo possono essere soggette a fatica se vengono private dei mitocondri. A volte il terminale dendritico può terminare su una struttura della cellula postsinaptica chiamata spina. A ridosso del terminale presinaptico, sulla cellula postsinaptica, ci sono delle strutture particolari che sono pronte a ricevere il mediatore
chimico e poi a trasdurre questa informazione. Che tipi di sinapsi chimiche possiamo trovare? Esistono due tipi di sinapsi chimiche: sinapsi di tipo eccitatorio e sinapsi di tipo inibitorio, i cui effetti vengono esplicati sulla cellula postsinaptica. Le sinapsi di tipo eccitatorio ecciteranno la cellula postsinaptica, le sinapsi di tipo inibitorio inibiranno la cellula postsinaptica. Dal punto di vista morfologico è possibile distinguere questi due tipi di sinapsi dalla distribuzione e dall’estensione di quella che si chiama zona attiva e che sono le regioni dove effettivamente avviene lo scambio di mediatore chimico. Si distinguono sinapsi di tipo Gray 1(eccitatorie) che hanno una zona attiva continua una singola e molto ampia; il secondo tipo è Gray 2 (inibitorie) hanno delle zone attive piccole e continue. Per quello che riguarda il tipo di neurotrasmettitore che viene utilizzato vale il principio di Dale (entro certi termini). Il principio di Dale dice: ogni neurone ha effetti eccitatori o inibitori in tutte le sinapsi che forma. Questo principio di Dale, che è stato espresso alla fine del 1800, non tiene conto dei moderni avanzamenti della scienza, quindi questo principio è valido in linea di massima
ma non in questo enunciato che ha perso di validità. E’ parzialmente vera, la si mostra solo per ragioni storiche. Vedremo quando parleremo dei neurotrasmettitori perché questo enunciato non è più valido. Nelle sinapsi di tipo Gray 1 e Gray 2 lo spazio intersinaptico è comunque piccolo (circa 20-30nm) che è una proprietà di tutte le cellule con questo tipo di sinapsi. Esistono però delle sinapsi in circuiti particolari (le sinapsi postgangliari del sistema nervoso vegetativo e i circuiti serotoninergici a livello dell’encefalo) dove lo spazio intersinaptico è molto più grande (da 100nm al μm). Questo perchè la funzione di queste sinapsi è diversa rispetto a
Lezione 5 - 17 Marzo 2005
7

quelle normali, nel senso che un ampio spazio intersinaptico vuol dire un ritardo di trasmissione molto più elevato, perchè il mediatore chimico che viene rilasciato deve diffondere nello spazio intersinaptico. Maggiore è lo spazio intersinaptico maggiore è il tempo che impiega per diffondere. Questo tipo di sinapsi con un ampio spazio intersinaptico si ritrovano a livello del sistema nervoso vegetativo che controlla aspetti vegetativi della fisiologia umana non aspetti relazionali, quindi può permettersi di avere dei tempi di risposta un po’ più lenti che non la contrazione muscolare che deve essere comandata istantaneamente. Si ritrovano in alcuni circuiti serotoninergici dell’encefalo che hanno a che fare con risposte di tipo viscerale, quindi non necessitano di una velocità di conduzione elevata. Per quanto riguarda le vescicole che sono contenute nel terminale pres inaptico e che contengono i l neurotrasmettitore, abbiamo delle dimensioni variabili a seconda di qual’è il mediatore chimico. Per i mediatori chimici principali, che sono il Glutammato e il GABA (uno eccitatorio e uno inibitorio), abbiamo delle vescicole piccole intorno ai 10-50nm. Per altri tipi di neuro trasmettitori (neuropeptidi o ammine) più grandi rispetto ai primi due le vescicole sono un po’ più grandi circa 70-300nm. Questa è un’altra distinzione morfologica che insieme al Gray 1 e Gray 2 può far capire di che tipo di sinapsi si tratta, di tipo eccitatorio o di tipo inibitorio. Come funziona il meccanismo di rilascio del neuro trasmettitore? Il rilascio del neurotrasmettitore da parte del terminale presinaptico è l’evento che trasforma un fenomeno elettrico in un fenomeno chimico.
Figura 8
Ovvero, il trasmettitore viene sintetizzato a livello del pirenoforo, viene trasportato lungo l’assone e poi viene impacchettato nelle vescicole a livello del terminale presinaptico. Le vescicole esistono in due luoghi diversi: a ridosso della membrana plasmatica pronte a rilasciare il proprio contenuto e sono classificate in quello che si definisce “pool di ri lascio” (figura 8), immediatamente disponibile. Attaccati invece ai microtubuli che sono all’interno dell’assone, ci sono vescicole piene di neurotrasmettitore ed è
quello che viene chiamato “pool di riserva” (figura 8), pronte a prendere il posto di quelle del pool di rilascio. Questo fa si che ci sia sempre un approvvig ionamento di neurotrasmettitore che se venisse a mancare anche l’attività sinaptica verrebbe a mancare. Nella figura 8 viene rappresentata la fine dell’assone, cioè il terminale sinaptico. Arriva il potenziale d’azione la depolarizzazione del potenziale di membrana che si instaura apre dei canali Ca voltaggio dipendenti (nei neuroni quelli delle classi P Q N e R). Una volta che il canale Ca voltaggio dipendente si apre il Ca2+ entra in cellula, per il fortissimo gradiente elettrochimico che possiede, a ques to l i ve l lo qu ind i aumenta la concentrazione intracellulare di Ca2+. Questo aumento di concentrazione è l’evento che accoppia l’evento elettrico a quello metabolico/biochimico perché causa la fusione delle vescicole con la membrana plasmatica e di conseguenza il rilascio del neurotrasmettitore. Come avviene questo processo è spiegato nella figura 8. Il calcio non va ad agire direttamente sulle vescicole ma va ad agire su una classe di proteine, che sono molto importanti per questo processo di esocitosi del neurotrasmettitore, chiamate “sinapsine”. In particolare la prima proteina che risponde all’aumento di concentrazione intracellulare di Ca2+ ed innesca tutto il processo che porta alla fusione della vescicola è la sinaptoplasmina, questa poi innesca tutto un processo che coinvolge altre proteine di ancoraggio della vescicola. Nonostante questo processo sia complesso si compie nell’arco di 0,1-0,2ms. Entro 0,2ms da quando è avvenuta la depolarizzazione del potenziale del terminale presinaptico abbiamo il rilascio del neurotrasmettitore. L’effetto del calcio è duplice perchè da una parte stacca le vescicole che sono tenute attaccate attraverso queste proteine chiamate sinapsine e le fa fondere alla membrana. Dall’altra parte fa si che le vescicole del pool di riserva si stacchino e migrino verso il pool di rilascio per prendere il posto delle vescicole esocitate. Questo è il fenomeno dovuto al calcio che accoppia il fenomeno elettrico con il rilascio di neurotrasmettitore. Nella figura 9 si vede una vescicola del pool di rilascio che non è a contatto con la membrana; è mantenuta ad una certa distanza da un insieme di proteine, poiché, essendo entrambe le membrane di natura lipidica, non appena venissero a contatto si fonderebbero tra di loro. In seguito all’ingresso di Ca queste proteine vengono modificate e la vescicola si complessa con le “proiezioni dense” e che di fatto sono grossi complessi proteici che presiede al fenomeno di attacco. Una volta attaccata la vescicola a questo complesso proteico la vescicola prenderà contatto con la membrana, si fonde con la membrana plasmatica e si forma il poro
Lezione 5 - 17 Marzo 2005
8

Figura 9
di fusione. Attraverso questo poro di fusione il contenuto della vescicola comincia a fuoriuscire dello spazio intersinaptico poi la vescicola completa la sua fusione con la membrana plasmatica e il residuo di neurotrasmettitore (se presente) ancora contenuto nella vescicola si riversa del tutto all’esterno. Ogni volta che arriva un potenziale d’azione, tot vescicole vengono rilasciate e ognuna di loro si fonde con la membrana plasmatica aumentandone la superficie. C’è un meccanismo di riciclo delle membrane in modo tale che la membrana che viene aggiunta perché le vescicole si fondono viene prontamente recuperata sia per non eccedere in dimensioni della membrana sia per avere materiale per costruire altre vescicole. Se non ci fosse questo sistema per recuperare questa membrana in eccedenza alla fine il terminale presinaptico diventerebbe troppo grande, più della sua dimensione normale che rimane invece tale. Quindi in concomitanza della fusione delle vescicole, in un’altra regione del neurone lontana dalla sinapsi e più precisamente ai lati di questa, abbiamo l’insorgenza di “gobbe” che sono
ricoperte di una proteina chiamata clatrina che recupera membrana in modo tale che alla fine il bilancio sia neutro, cioè che non venga ne aggiunta ne tolta membrana cellulare. Dal punto di vista dei tempi rivediamo lo stesso processo in figura 10.
Figura 10
Esiste, per tutta questa serie di processi che deve avvenire prima che il neurotrasmettitore venga rilasciato, il “ritardo sinaptico”. In figura 10 si ha un potenziale d’azione che arriva a livello del terminale presinaptico; si aprono i canali del Ca voltaggio dipendenti, il calcio entra all’interno del terminale presinaptico, le vesc ico le s i fondono l iberando i l neurotrasmettitore, questo arriva a livello della membrana postsinaptica e abbiamo poi una variazione del potenziale della membrana postsinaptica. Come si vede dalla figura 10 non c’è corrispondenza tra la linea tratteggiata che segna l’insorgere del potenziale d’azione nella membrana presinaptica e la variazione del potenziale di membrana della membrana postsinaptica. Questo è il “ritardo” o “latenza sinaptica” che è un parametro molto importante quando si affronterà il discorso dei riflessi spinali per
Lezione 5 - 17 Marzo 2005
9

capire com’è fatto un riflesso spinale. Questo ritardo è dovuto al meccanismo sinaptico di rilascio del neurotrasmettitore ed è pressoché costante in tutte le sinapsi. Dipende anche d a l l o s p a z i o i n t e r s i n a p t i c o p e r ò sostanzialmente per tutte quante le sinapsi, a parte quelle descritte prima peculiari del sistema nervoso vegetativo, lo spazio è più o meno delle stesse dimensioni. La latenza è una caratteristica e valutare questo ritardo ci dice ad esempio quante sono le sinapsi coinvolte in un certo circuito. Quindi è anche uno strumento che viene utilizzato delle volte in diagnostica per capire se un circuito è costituito dai componenti giusti o se c’è qualche sinapsi di troppo o in meno semplicemente andando a contare quant’è la somma di queste latenze.
A livello della membrana postsinaptica esistono delle proteine di membrana che sono i recettori per i mediatori chimici. Cosa sono i recettor i per i mediator i chimici?Nella tabella 2 vengono illustrate le due classi di recettori che esistono a livello delle membrane postsinaptiche. Abbiamo dei recettori appartenenti alla prima classe che si chiamano recettori “ionotropici” e svolgono due funzioni la prima è quella di legare il neuro mediatore la seconda è che essi stessi funzionano come un canale ionico. Appartengono dunque a quella categoria di canali ionici classificati come “ligand gated”, cioè che si aprono quando legano una particolare sostanza. Nei recettori ionotropici la stessa proteina è il recettore per il neurotrasmettitore e il canale ionico che viene aperto con il legame con il mediatore chimico.
Ionotropici • legano il neuromediatore
• sono loro stessi canali ionici
• acetilcolina (nicotinico)
• 5-HT3 per serotonina
• GABA• Glicina• Glutammato
Metabotropici • legano il neurotrasmettitore ma necessitano di un ponte di trasmissione
• 7 domini transmembrana che attivano le G proteins (meccanismo a secondo messaggero)
• Acetilcolina (muscarinico)
• α e β adrenergico
• Dopamina• Serotonina• Gluttammato• Neuropeptidi
Tabella 2
La seconda categoria di recettori si chiamano metabotropici. Questi recettori non sono essi stessi canali ionici ma sono delle proteine integrali di membrana che legano il neurotrasmettitore ma che poi hanno bisogno di un sistema di trasmissione del segnale che trasmetta il segnale dovuto al legname con il neurotrasmettitore ad un canale ionico che poi si apre. Appartengono ad una classe di proteine di membrana la quale ha come caratteristica quella di avere sette domini transmembrana. Questo aspetto è peculiare di quei sistemi in grado di attivare le G proteine le quali attiveranno altre funzioni. Questo meccanismo si chiama “meccanismo a secondo messaggero”. Da questo deriva che, i recettori ionotropici, essendo loro stessi sia il recettore che il canale , vengano utilizzate nelle sinapsi veloci, quelle cioè dove è indispensabile avere il minimo ritardo sinaptico. I m m e d i a t a m e n t e d o p o c h e i l neurotrasmettitore si lega al canale questo si apre. I recettori metabotropici vengono utilizzati prevalentemente nelle sinapsi lente. Sono recettori presenti dove gli spazi intersinaptici sono più grandi del solito e dove non è necessaria una alta velocità di trasmissione e dove bisogna anche attivare un processo metabolico in seguito all’arrivo del segnale elettrico. Esempi di questi recettori sono i recettori per l’acetilcolina. Questa, infatti, possiede entrambi i tipi di recettore. Quello ionotropico è il recettore nicotinico (placche neuromuscolari; altri esempi di recettori ionotropici è il 5-HT3 che è il recettore di terzo tipo per la serotonina, recettori per il glutammato (ubiquitario nel SNC), i recettori per il GABA, per la Glicina. Gli ultimi due aprono i canali per il Cloro. Normalmente i recettori ionotropici permettono il passaggio di ioni positivi (Na+ e K+). Per quanto riguarda esempi di recettori metabotropici: recettore per l’acetilcolina (muscarinico, nel sistema nervoso vegetativo), l’α e β adrenergico (recettori che legano la noradrenalina e l’adrenalina), recettori per la dopamina, alcuni recettori per la serotonina e recettori per il glutammato e per i neuro peptidi (relativi a circuiti vegetativi). Nel dettaglio i sistemi a secondo messaggero: è un sistema di trasmissione dell’informazione trasversale nei tessuti e nelle cellule poichè utilizzato per questo scopo ma utilizzato anche altrove (ormoni che attivano G proteine). Lo schema 1 rappresenta in generale cosa succede nei sistemi a secondo messaggero. Il tutto inizia con un segnale esterno che arriva a livello della membrana plasmatica. Questo segnale esterno arriva ad una proteina che è il recettore (per il caso dei metabotropici 7 domini transmembrana). Attivato da questo legame con il recettore, abbiamo un trasduttore ed eventualmente un effettore primario (cioè una prima proteina che genera un qualcosa se viene attivata dal trasduttore).
Lezione 5 - 17 Marzo 2005
10

Schema 1
Questo effettore primario produce il secondo messaggero vero e proprio, che è una molecola che si trova all’interno della cellula. Questo secondo messaggero va a sua volta ad agire su di un effettore finale, che nel caso dei sistemi a secondo messaggero postsinaptici, è direttamente o indirettamente un canale ionico. Esistono sostanzialmente tre sistemi a secondo messaggero e che sono raffigurati nello schema 1. Ciascuno con il neurotrasmettitore tipico. In particolare, per quello che riguarda le sinapsi, abbiamo a che fare con i sistemi ad cAMP (AMP ciclico) e gli enositoli fosfati. Il sistema ad acido arachidonico è sempre un sistema a secondo messaggero ma non ha a che fare con la trasmissione dell’impulso nervoso perché è attivato da istamina e altre sostanza p r o - i n f i a m m a t o r i e .Il primo è il sistema a secondo messaggero che utilizza come secondo messaggero l’AMP ciclico (il nome deriva dal composto che funge da secondo messaggero). Un esempio è la noradrenalina attraverso il suo recettore di tipo β (recettore β-adrenergico). La noradrenalina si lega al recettore β-adrenergico che a sua volta attiva una proteina G si tipo S. Esistono vari tipi di proteine G, ciascuna delle quali è accoppiata in maniera diversa con altre proteine. La proteina GS, quando viene attivata dal legame della noradrenalina al recettore, attiva a sua volta l’adenilato ciclasi. Questo è l’effettore primario di questa via e produce il secondo messaggero che è l’AMP ciclico che va ad attivare una chinasi che dipende dall’AMP ciclico stesso. Maggiore è la concentrazione dell’AMP ciclico maggiore è l’attività della chinasi e questa andrà a
fosforilare ad un canale ionico, questo è l’effetto finale. La fosforilazione del canale ionico poi andrà a farlo aprire o a farlo chiudere dipende da che tipo di canale ionico si tratta. Per quanto riguarda i sistemi degli inositoli fosfati abbiamo come esempio quello dell’acetilcolina. Questa agisce sul suo recettore muscarinico (il nome deriva dal nome di un fungo, l’amanita muscaria, il cui ve leno t iene at t ivata questa v ia costantemente), a sua volta attiva un altro tipo di proteina G del tipo Q. Questa proteina GQ va ad attivare la fosfolipasi di tipo C che idrolizza i fosfatidilinositolo di membrana. C’è così la produzione di 2 diversi messaggeri L’inositolo-3-fosfato e il diacilglicerolo. Ciascuno dei due andrà ad attivare un effettore secondario che, nel caso dell’IP3 è l’induzione del rilascio di calcio da parte del reticolo endoplasmico, quindi fa aumentare la concentrazione del Ca2+ all’interno della cellula, ma non facendola arrivare dell’esterno come fanno i canali Ca voltaggio dipendenti bensì facendolo fuoriuscire dal reticolo endoplasmico dove viene immagazzinato. Per quanto riguarda il diacilglicerolo questo attiva una protein-chinasi (pKc) che a loro volta andranno a fosforilare dei canali che a seconda del tipo potrà aprirsi oppure chiudersi. In figura 11 si vede il recettore, che è sempre la proteina integrale di membrana con sette eliche che attraversano la membrana, e il neurotrasmettitore che si lega al recettore (la noradrenalina e il β-adrenergico). Il recettore è inserito nella membrana plasmatica e in prossimità di questo abbiamo la G proteina che non è una proteina integrale di membrana bensì rimane ancorata alla faccia citoplasmatica. La G proteina è composta da una subunità α e una subunità βγ che rimane complessata alla sub unità α. Fintanto che le
Lezione 5 - 17 Marzo 2005
11

Figura 11
due subunità sono tra loro complessate e tutti sono legati al GDP, la proteina G è inattiva perché è la subunità α che esplica la funzione della proteina. Sempre nelle vicinanze del recettore e la G proteina abbiamo l’adenilatociclasi. Nella membrana cellulare, quindi esistono questi che si chiamano micro-domini, dove si trovano tutte le componenti che compongono la via a secondo messaggero. Viene rilasciato il neurotrasmettitore; il neurotrasmettitore si lega al recettore che modif ica la sua conformazione ed espone un sito che è il sito di aggancio per la G proteina. A questo punto la G proteina si lega al recettore e nel legarsi scambia GDP per GTP. Una volta che viene caricato il GTP le subunità βγ si staccano e rimane attiva la subunità α, questa prende contatto con l’adenilatociclasi che si attiva. L’adenilatociclasi prende l’ATP e lo trasforma in cAMP. Questo è il procedimento che attiva questa via. Come viene acceso, però, deve anche venire spento. Allo spegnimento del segnale ci pensa l’attività GTPasica intrinseca della subunità α. Quindi trascorso un certo
lasso di tempo il GTP che è attaccato alla subunità α viene idrolizzato dalla subunità α stessa e torna ad essere GDP. A questo punto la subunità α torna a complessarsi con le seubunità βγ tornando alla sua forma inattiva. La via del segnale è ad opera del legame del neurot rasmett i tore a l recettore, lo spegnimento del segnale è ad opera della proteina G stessa la cui subunità α nel tempo (nel giro di alcuni millisecondi, variabili perché possono essere anche alcuni secondi) idrolizza il GTP che torna GDP. I due precursori di questa via sono due molecole che si trovano abbondanti all’interno della cellula che sono l’ATP, che viene idrolizzato in cAMP che è il secondo messaggero, e l’altro è il GTP. Da questo punto di vista non si corre il rischio che vengano a mancare i precursori per accendere questo processo a secondo messaggero, perché se ne trova in abbondanza all’interno della cellula. Nella figura 12 viene rappresentata la via degli inositoli fosfati. Come substrato di partenza per i secondi messaggeri si utilizza il fosfatidil inositolo di membrana, che si trova ovunque sul plasmalemma e viene sintetizzato normalmente come costituente di essa. Si usa
Lezione 5 - 17 Marzo 2005
12

questo precursore perché non si corre il rischio che venga meno al momento dell’utilizzo. Questo fosfatidil inositolo è il substrato per due tipi di fosfolipasi diverse. Una che la fosfolipasi A2 (non ci interessa), l’altra invece è la fosfolipasi C. La differenza tra queste due fosfolipasi è il legame che vanno a spezzare. La fosfolipasi C da origine all’inositolo-1-4-5-trifosfato (IP3) e al diacilglicerolo (DAG). Il meccanismo di questa via è identico all’altro se non che cambiano i nomi degli attori. Abbiamo il recettore (muscarinico per l ’acet i lco l i na) che v iene a t t i va to dall’acetilcolina; questo legame fa esporre al recettore il sito di legqme per la GQ proteina (nella quale la subunità α cambia rispetto a quella vista in precedenza mentre le subunità βγ rimangono invariate). La GQ proteina si lega al recettore, scambia GDP con GTP, la subunità α si sgancia dalle altre per andare ad attivare la fosfolipasi C. Questo enzima, che si trova già a ridosso della membrana laddove è presente il suo substrato, comincia a tagliare il fosfatidil inositolo e produce l’IP3 e il DAG. Il primo, che è il secondo messaggero, si sgancia dalla membrana, essendo la parte più esterna del fosfolipide di membrana, e diffonde nel citoplasma e va a legarsi ai recettori per l’IP3 presenti a livello delle membrane del reticolo endoplasmico. All’interno del reticolo endoplasmico (presente in tutte le cellule) esiste una concentrazione di Ca2+ paragonabile a quella che c’è nei liquidi extracellulari perchè viene pompato attivamente (sia all’esterno della cellula, sia all’interno del reticolo endoplasmico) tutte le volte che aumenta la concentrazione nel citoplasma per riportarla ad un valore ottimale. Una volta che l’IP3 stimola il rilascio del calcio dal reticolo endoplasmico, questo aumenta la sua concentrazione all’interno del citoplasma. Si può dire che questo è un processo puramente metabolico non è un processo dovuto alla variazione di potenziale elettrico e quindi all’apertura dei canali calcio voltaggio dipendenti. Il DAG rappresenta invece l’altra parte del fosfatidil inositolo di membrana che rimane confinato nella membrana. Riesce a svolgere il suo compito perché la pKc (alcune sue isoforme in verità tra cui la ε che è particolarmente implicata nei fenomeni della sensazione del dolore) ha un sito di legame per il DAG. Quando questo è presente a livello della membrana la pKc si lega ad esso e si attiva. Attivandosi la protein chinasi C fosforila una serie di proteine tra cui dei canali ionici. Alcune isoforme della pKc hanno bisogno anche del calcio per funzionare. Ma il DAG e il Ca2+ derivano dall’azione dell’IP3 quindi tutte le isoforme della pKc si attivano in questo processo. Il pKc è l’effettore secondario che andrà a fosforilare un canale ionico (o ad aprirlo o a chiuderlo a seconda dei casi).
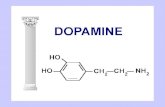
Qualo sono i neurotrasmettitori che ci interessano? Sono innanzitutto divisi in tre categorie a seconda della loro composizione e da dove derivano. Vengono divisi quindi in monoammine, amminoacidi e in neuropeptidi. Per quanto riguarda le monoammine abbiamo dei neurotrasmettitori molto importanti nel sistema nervoso centrale e non solo. L’acetilcolina, dopamina, noradrenalina, adrenalina e serotonina sono tutte monoammine. La dopamina, noradrenalina, e adrenalina sono catecolammine. Gli amminoacidi o derivati da essi abbiamo l’acido glutammico e gli unici due neurotrasmettitori che hanno funzione inibitoria: l’acido γ-ammino-butirrico (GABA) e la glicina. Mentre le monoammine possono avere sia funzione inibitoria che eccitatoria, nel gruppo degli amminoacidi ritroviamo questi due neurotrasmettitori che hanno solo funzione inibitoria. I neuropeptidi sono presenti sono in alcune particolari zone dell’encefalo quindi non sono diffusissimi all’interno del SNC. Sono delle grosse molecole, quindi anche dal punto di vista diffusionale, a parità di distanza da percorrere, impiegano molto più tempo. Le troviamo dunque in sinapsi lente, non hanno a che fare con eventi di vita di relazione ma con eventi vegetativi. Questi neuropeptidi sono l’encefalina, l’endorfina e sostanza P che si ritrovano nelle vie nocicettive (sensoriali o effettrici). Il peptide intestinale vasoattivo (VIP) la somatostatina e l’angiotensina II, altri neuropeptidi. Ultimamente si sono osservate d e l l e s o s t a n z e c h e f u n g o n o d a neurotrasmettitore che sono l’ATP e il monossido di azoto (plasticità sinaptica).L’acetilcolina la troviamo in alcuni neuroni del SNC ma soprattutto è il neurotrasmettitore delle cellule pregangliari dell’ortosimpatico e del parasimpatico. Quindi viene rilasciata dalle cellule pregangliari dell’orto e del parasimpatico e dalle cellule postgangliari del parasimpatico. Queste rilasciano acetilcolina su due tessuti: la muscolatura liscia dei visceri e il miocardio. Il nervo vago rilascia acetilcolina a livello del nodo seno-atriale e della muscolatura dei ventricoli del cuore. Poi abbiamo l’acetilcolina prodotta dai motoneuroni spinali che va a stimolare l’inizio della contrazione muscolare scheletrica.La noradrenalina è il neurotrasmettitore propriamente detto, cioè la sostanza che viene prodotta e rilasciata dai neuroni (la noradrenalina è un neurotrasmettitore l’adrenalina è un ormone). Anche la noradrenalina si trova in alcuni circuiti del tronco dell’encefalo ed è il neurotrasmettitore che viene rilasciato dalle cellule postgangliari dell’ortosimpatico. Anche la noradrenalina andrà ad agire a livello della muscolatura liscia dei visceri e a livello del muscolo c a r d i a c o .L’acido glutammico (glutammato) è il neurotrasmettitore eccitatorio per eccellenza
Lezione 5 - 17 Marzo 2005
13

di tutto il SNC. Il 90% delle sinapsi del SNC funziona con il glutammato, anche l’unico neurotrasmettitore usato da tutte le vie sensoriali per portare le informazioni all’encefalo (a parte poche eccezioni).Il GABA è il neurotrasmettitore a carattere inibitorio e si trova prevalentemente a livello dell’encefalo. Anche questo è derivato dall’acido glutammico (amminoacidi).
Visti i recettori e i neurotrasmettitori possiamo estendere il principio di Dale perchè visto com’era prima non è del tutto corretto. Si può riscrivere più correttamente così: ogni neurone produce uno e un so lo t ipo d i neurotrasmettitore (es. glutammato, tutte le sue sinapsi sono glutammatergiche) ma non è vero che ogni neurone ha solo e unicamente effetti eccitatori o inibitori con tutti i neuroni con cui viene a contatto. Questo perchè dipende dal tipo di neurotrasmettitore e dal tipo di recettore. Esempio è la noradrenalina tramite recettori α ha funzione eccitatoria e tramite recettori β un’azione inibitoria. A seconda del tipo di recettore possiamo avere o uno stimolo eccitatorio o inibitorio da parte dello stesso neurotrasmettitore. Due tipi di neurotrasmettitori inibitori, che sono il GABA e la glicina, semplificano di molto le cose perchè hanno sempre carattere inibitorio. I recettori per questi neurotrasmettittori aprono canali ionici che hanno sempre effetto inibitorio. Di recettore per la glicina per il momento se ne conosce solo un tipo e apre dei canali Cl-. Aprire dei canali cloro significa lasciar transitare ioni negativi, quindi il cloro ha un effetto un po’ più negativo rispetto al potenziale di riposo della cellula quindi impedisce un eventuale depolarizzazione. Nelle cellule che non regolano in maniera attiva la concentrazione del cloro, il cloro ha lo stesso potenziale di equilibrio del potenziale di riposo della cellula però aprire dei canali ionici per il cloro a livello della membrana significa diminuire la resistenza di membrana. Allora per la legge di Ohm, dato che la resistenza di membrana diventa più bassa è più difficile per una corrente far variare il potenziale di membrana. Ecco come si spiega l’effetto inibitorio dei canali cloro. Il GABA possiede tre tipi di recettori: il GABA A e il GABA C sono dei recettori ionotropici per il cloro (come quello della glicina); il recettore e il canale ionico sono la stessa molecola (GABA A E GABA C) il GABA B invece è un recettore metabotropico e non apre un canale cloro ma apre un canale potassio. Il potassio a un potenziale di equilibrio di -97 mV quindi ogni volta che si apre un canale potassio si ostacola la depolarizzazione della membrana. Sia il GABA che la glicina hanno un effetto puramente inibitorio. A livello embrionale, il potenziale di equilibrio del cloro non è uguale a quello dell’adulto ma è positivo quindi nel feto la glicina ha un effetto eccitatorio. Questo
perchè non è stato ancora raggiunto l’equilibrio di (?donnan?). Questa è l’unica eccezione per l’inibizione della glicina.Esempii di bivalenza a seconda del recettore posts inaptico è l’aceti lcol ina e la noradrenalina. L’acetilcolina sul muscolo liscio, grazie al recettore M3, aumenta la concentrazione di calcio all’interno quindi provoca la contrazione. A livello del sistema nervoso centrale l’acetilcolina, attraverso sempre il recettore M3 e M1, che sono due isoforme per il recettore muscarinico, provocano l’eccitazione perché diminuiscono la corrente di potassio calcio attivata che è presente a livello dell’ippocampo. Essendo recettor i muscarinici sono recettor i metabotropici, quindi l’acetilcolina tramite il recettore M3 diminuisce una corrente potassio e quindi eccita la cellula. Nel muscolo cardiaco, tramite l’M2, aumenta la corrente potassio e quindi ha un effetto inibitorio; di fatti l’effetto del nervo vago che rilascia acetilcolina è quella di rallentare la frequenza di contrazione e diminuire la forza di contrazione cardiaca. E’ sempre lo stesso tipo di neurotrasmettitore, cioè acetilcolina, che eccita o inibisce il miocardio a seconda dei recettori a cui vengono accoppiati (M3 e M2). A livello del muscolo scheletrico l’acetilcolina con il suo recettore ionotropico (nicotinico, perchè stimolato dalla nicotina) provoca l’eccitazione della fibra muscolare striata e quindi la contrazione. La noradrenalina ha gli stessi effetti, eccitatori o inibitori, a seconda dei recettori. Questo neuromediatore agisce tramite due recettori: gli α e i β. Sul muscolo liscio la noradrenalina, tramite i recettori α di tipo 1, provoca eccitazione quindi contrazione. Tramite i recettori β2 invece provoca inibizione; sono presenti a livello delle coronarie e dei bronchi perché, la noradrenalina rilasciata in condizioni di stress o in preparazione ad un’intensa attività motoria, da una parte vasocostringe dove non serve sangue e viene dirottato dove serve cioè dove la noradrenalina dilata le coronarie poiché il cuore deve essere ben irrorato; in secondo luogo dilaterà i bronchi per migliorare la ventilazione. Ecco che la noradrenalina può compiere entrambe le funzioni sempre perchè agisce su due recettori diversi. A livello del sistema nervoso centrale tramite gli α1 provoca eccitazione e tramite gli α2 (meccanismo usato anche in anestesia per aumentare il tono dell’anestesia tramite delle sostanze agoniste dell’α2) causa inibizione presinaptica quindi impedisce il rilascio del neurotrasmettitore. A livello del muscolo cardiaco tramite recettori β1 la noradrenalina causa eccitazione quindi aumento della forza di contrazione e a livello del nodo seno-atriale aumenta la frequenza di contrazione del miocardio.
Lezione 5 - 17 Marzo 2005
14

Figura 12
Lezione 5 - 17 Marzo 2005
15