Esercizi. Le serie prendono il nome dal valore di n di arrivo. Lyman n a =1 Balmer n a =2 Paschen n...
-
Upload
amedeo-mattei -
Category
Documents
-
view
214 -
download
0
Transcript of Esercizi. Le serie prendono il nome dal valore di n di arrivo. Lyman n a =1 Balmer n a =2 Paschen n...

Esercizi

)11
(22
partenzaarrivo nnE
Le “serie” prendono il nome dal valore di n di “arrivo”.
Lyman na=1
Balmer na=2
Paschen na=3
Quindi la riga a frequenza più bassa ( e lunghezza d’onda più grande) di ogni serie è quella tra i livelli che corrispondono a na e na+1.
Spettri atomo H

2220
2
42 1
32 n
meZEn
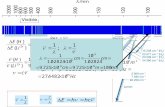
1.La riga di Lyman a numero d’onda più basso per l’atomo di H è a 82259 cm-1. Calcolare la frequenza in Hz e la lunghezza d’onda della transizione per l’atomo di Li2+ .
Per H Z=1
Per Li2+ Z=3
9
1
)(
)(2
LiE
HE
c
9
1
)(
)(2
Li
H
1612 102259.89822599)( mcmLi
E
Hz
HzLi14
862
102319.20
)1010()99.22259.89()(
ESERCIZIO 1

Esercizio 2Gli astronomi hanno trovato atomi di H nello spazio interstellare con numero
quantico n altissimo.
Calcolare la lunghezza d’onda della luce emessa da un elettrone che subisca una transizione da n=236 a n=235, e individuare la zona spettrale corrispondente.
1578.109677 cm Costante di Rydberg
112 6795.1106795.1 mcm
17122236235 105313.1
236
1
235
1
cmcmEE
12
cm
nEn
mm 595.06795.1
1

mm 595.06795.1
1 La zona è quella della
radiofrequenza.

Esercizio 3
Calcolare la probabilità di trovare la particella nei diversi punti di un’orbita circolare se la sua funzione d’onda è
im
m e2
1)( con m = 2.
La probabilità di trovare la particella tra e + d è:
2
1
2
1
2
1
2
1)()( )22(22*
22 iiii eee
d)()( *22 (interpretazione di Bohr)
------------------------------------------------------------------
Quindi la localizzazione della particella sull’orbita è del tutto indefinita perché non dipende da . Il risultato inoltre non dipende dalla particolare funzione, il risultato è lo stesso qualsiasi sia il valore di m.

Esercizio 4Calcolare la differenza di energia tra i primi due livelli energetici per una molecola di O2 in una scatola monodimensionale lunga 5 cm. Come potreste dimostrare che la quantizzazione dell’energia si può trascurare per una scatola di queste dimensioni? (Suggerimento: cfr. con l’energia media )
------------------------------------------------------------------Espressione dell’energia per la particella nella scatola: 2
22
8mL
hnEn
Dati che ci servono: sJh 341062.6
Massa della molecola di O2: 32 u.a. x peso in kg di 1 u.a. (mu)
kgmu271066.1
I primi due livelli energetici corrispondono ai numeri quantici n = 1 e n = 2.
2
2
1 8mL
hE
kgkgMO2727 101.53321066.1
2
2
2
2 8
4
mL
hE 2
2
12 8
3
mL
hEEE
Lunghezza della scatola: L = 5x10-2 m

JmL
hEEE 426
682
2
2
12 1010
10
2531.58
)62.6(3
8
3
kgMO261031.5
2
JJE 393068 1024.11010124.0
La scatola di 5 cm è una scatola di dimensioni ordinarie. Un confronto ragionevole può essere tra la differenza di energia calcolata tra due stati quantizzati per la molecola di O2 , e l’energia media ottenuta dalla termodinamica statistica per il moto di una molecola di gas perfetto in una direzione:
kTE2
1 dove k è la costante di Boltzmann. A
300K :
JJE 2123
101.22
3001038.1
La differenza di energia tra due stati quantizzati è piccolissima rispetto all’energia media.

Esercizio 5Il numero d’onda che corrisponde alla transizione vibrazionale per la molecola di 12C=16O è 2170 cm-1. Usando il modello dell’oscillatore armonico, ricavare la costante di forza del legame C=O. ------------------------------------------------------------------
Nel modello dell’oscillatore armonico abbiamo: hE )21(
Le transizioni permesse sono quelle con 1
La transizione “fondamentale” è quella tra lo stato con v=0 (che è il più popolato) e v=1 hhhE )21()23(
Ma per la relazione di Planck: hE

Quindi la frequenza del moto di vibrazione delle molecole biatomiche è anche la frequenza della radiazione elettromagnetica che possono assorbire.
Procedimento: 1. Si ottiene la frequenza dal numero d’onda.
2. La frequenza si pone eguale a quella di vibrazione.
3. Dall’espressione della frequenza per l’oscillatore armonico si ottiene la costante di forza.
1
Numero d’onda Per passare alla frequenza bisogna moltiplicare per c, velocità della luce.
Esprimiamo il numero d’onda in unità SI. Si ricordi che 11 1001 mcm151 10170.22170 mcm
18103 msc
THzHzssmm 1.651051.61051.610170.2103 131131158
cc

E adesso?
?
Adesso è quasi fatta!
k2
2
4
1
k
2
1
kgkgmm
mm
OC
OC 2727 1038.111066.11612
1612
224k
mC = 12 u.a.
mO = 15.9949 u.a. (Approssimiamo mO a 16 u.a.)
kgmu271066.1
Per calcolare la massa in kg dobbiamo moltiplicare la massa in u.a. per il peso in kg dell’u.a.:

))(1010)(38.1138.4287.94(4 2272622 skgk
))(10)(10905.1(4 21422 skgk
11905 mNk
1 N = kg x m x s-
2
Che risoluzione dovrebbe avere uno spettrometro IR per distinguere tra 12CO e 13CO ?

La funzione d’onda angolare degli atomi idrogenoidi è anche autofunzione degli operatori di momento angolare.
a. Quali sono gli autovalori di questi operatori per un elettrone in uno stato n,l,m?b. Siete capaci di dimostrare che le funzioni dette sono autofunzioni dell’operatore lz?
i
lz
)2
1(
2
1
2
1
imim
im
mlz emimei
e
il
Modulo del momento angolare:
)1( lll
mlz
Componente lungo z del momento angolare:
Esercizio 6

Che relazione c’è tra gli orbitali 2p0, 2p1, 2p-1, e gli orbitali 2px, 2py, 2pz?
cos2 0 p
iep sin2 1
iep sin2 1
cos22 0 ppz
cossin)(sin222 11
iix eeppp
sinsin)(sin222 11
iiy eeppp
i
lz Le funzioni reali degli orbitali non sono autofunzioni di lz
211
pp
px
211
pp
ipy
0ppz
Esercizio 7

cos22 0 ppz
cossin2 xp
sinsin2 yp

Disegnare la forma del potenziale per l’oscillatore armonico, la forma delle funzioni d’onda da v=0 a v= 3, e scriverne le energie
Esercizio 8

Sapete giustificare l’uso del modello dell’oscillatore armonico per descrivere i moti di vibrazione delle molecole? Quali sono i limiti del modello secondo voi?
v=0
v=1
v=2
v=3
La forma del potenziale in cui si muovono i nuclei assomiglia ad una parabola per gli stati a energia più bassa
Se si adotta il modello dell’oscillatore armonico si trova che i livelli energetici sono tutti equidistanti
Se si usa un potenziale più simile a quello reale, si trova che i livelli di energia si infittiscono al crescere di v.
Esercizio 9

Lo spettro vibrazionale della molecola di 1H19F ha una riga a 4138 cm-1 . Ricavare la costante di forza del legame H-F (assumete che le masse siano 1 u.a. per H e 19 u.a. per F).
1 966 Nm
21H
22H
FH191
ClH 351
214N
216O
10
cm pmr 1Nmk 1 kJmol
4400
3118
74
74
575
577
432
440
4138
2990
92
127
966
516
564
428
2358
1580
110
121
2294
1177
942
493
Esercizio 10

Una molecola che ruota in assenza di potenziale può essere considerata come una particella di massa μ che si muove su una superficie sferica di raggio r uguale alla distanza di legame. Quindi possiamo usare i risultati trovati per la particella sulla sfera per avere informazioni sul moto di rotazione delle molecole biatomiche.
rm1 m2
21
21
mm
mm
r
Moto di rotazione delle molecole

Esercizio 11Calcolare le energie dei primi cinque livelli rotazionali della molecola di H2, e per ognuno degli stati le grandezze del momento angolare, e i valori delle proiezioni del momento angolare lungo l’asse z.
Momento di inerzia per la molecola di H2 : I= 4.603 x 10-48 kg m2
------------------------------------------------------------------Suggerimento: ricalcolatevi per esercizio il momento di inerzia di H2!
IllEl 2
)1(2
Procedimento: le energie degli stati rotazionali di H2 si calcolano con il modello del “rotatore rigido”, che equivale al moto di una particella di massa ridotta su una sfera di raggio r. Quindi l’espressione per l’energia è:
I cinque stati a energia più bassa hanno numeri quantici l = 0,1,2,3,4 (per gli stati rotazionali si usa anche il simbolo J ).
Conviene calcolare I2
2

Calcoliamo :
2
22
48
23422
10
)10(
603.42
)055.1(
2 mkg
sJ
I
22
2
48
68
10
10
206.9
113.1
smkg
J
J
J 220101209.0 J2110209.1
sJ 3410055.1Costante di cui abbiamo bisogno
l = 0 00 E
JE 211 10209.12 l =
1JE 21
2 10209.16 l =2
JE 213 10209.112 l = 3
JE 214 10209.120 l = 4

Calcolatelo per esercizio per i primi cinque valori di l.
Quadrato del modulo del momento angolare:
2)1( ll
l = 0 0lm
1,0 ,1 lml = 1l =2
l = 3
l = 4
Valori delle proiezioni del momento angolare su un asse, in unità :
2,1,0 ,1 ,2 lm
3,2,1,0 ,1 ,2 ,3 lm
4,3,2,1,0 ,1 ,2 ,3 ,4 lm

La molecola di ossido di carbonio ha una distanza di legame di 113 pm. Ricavare la frequenza per la transizione tra i due stati rotazionali più bassi per la molecola 12C-16O.
rm1 m2
21
21
mm
mm
JJ EEE '
,...2,1,0JI
JJE j 2)1(
2
I due stati rotazionali a energia più bassa sono quelli con J=0 e J=1
101' EEEEEE JJ 2
222
1 22
rIIE
Esercizio 12