ESERCIZI CHIMICA ORGANICA
-
Upload
minchiazzurra -
Category
Documents
-
view
1.701 -
download
8
Transcript of ESERCIZI CHIMICA ORGANICA
Chimica Organica II - Programma ed esame 1 Parte Formazione del legame C-C mediante la chimica dei carbanioni (acidit degli H legati a C; attacco nucleofilo a centri elettrofili; applicazioni sintetiche) 2 Parte Chimica dei composti terociclici (Gli eterocicli aromatici reattivit e sintesi; sintesi di altri eterocicli mediante reazioni di cicloaddizione) Esame: Test con domande a risposta multipla o aperta
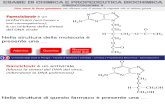
CHIMICA ACIDO-BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in a un gruppo carbonilico (aldeidi, chetoni, esteri)
chetone
ione enolato (stabilizzato per risonanza)
Lacidit del protone legato al carbonio in compete con la natura elettrofilica del carbonio carbonilico, analogamente a quanto accade con gli acidi carbossilici e le ammidi primarie e secondarie
ADDIZIONE AL CO DI UNA BASE/NUCLEOFILO
aldeide
acido carbossilico
Latomo di carbonio elettrofilo in grado di reagire con nucleofili
Acidit di acidi carbossilici, solfonici e fosforici
Maggiore la forza dellacido pi basso il valore di pKa.Gli acidi carbossilici tendono a fornire reazioni acido-base con i nucleofili. Il pKa di un acido carbossilico circa 5, cosa che li rende le pi acide molecole contenenti solamente C, H e O.
acido carbossilico Questa acidit origina dalla stabilizzazione della base coniugata, lo ione carbossilato
Acidit di acidi solfonici (pKa < 0) e fosforici (pKa2)
Un acido solfonico
Un acido fosforico
Gli altri solfonici e fosforici sono ancora pi forti. Gli acidi fosfonici in a basse concentrazioni posono anche perdere il secondo protone (cosa che accade ad esempio in condizioni fisiologiche)
Acidit di acidi carbossilici, solfonici e fosforici Reazione con H2O
In acqua tutti questi acidi si dissociano
Variazione di acidit Effetti Induttivi
Perch lacido cloro acetico ha una pKa pi bassa?Una razionalizzazione semplificata si basa sullelettronegativit dei sostituenti: la maggior elettronegaticit del cloro rende pi positivo il carbonio ad esso legati che a sua volta sottrae densit elettronica al carbonio carbonilico e allossigeno, rendendo il legame O-H pi debole e di consegnuenza il protone pi acido. Un effetto analogo viene svolto sulla base coniugata che risulta quindi pi stabile.
Variazione di acidit Effetti Induttivi Derivati acido acetico
Variazione di acidit Effetti Induttivi Derivati acido butanoico
Possiamo quindi dire che gli effetti induttivi influenzano lacidit degli acidi carbossilici: gruppi elettron attrattori aumentano lacidit; elettron donatori la dimuiscono. Inoltre leffetto diminuisce allaumentare del numero di atomi che separano il sostituente dalla funzione carbossilica.
Anche nel caso dei derivati degli acidi benzoici possiamo individuare un effetto induttivo dei sostituenti in anello sullacidit del sistema. Anche in questo caso i sostituenti elettronattrattori (EWG, -I) aumentano lacidit mentre quelli elettron donatori la diminuiscono (EDG, +I). E interessante notare che la presenza di un sostituente in posizione orto porta ad una diminuzione sul valore della pKa, indipendentemente dalla natura del sostituente. Questo fenomeno, conosciuto come effetto orto, deriva da interazioni di carattere sterico tra il sostituente e la funzione carbossilica.pKa pKa
pKa = 4.21
Acidi dicarbossiliciSulla base di quanto visto precedentemente, questi acidi sono pi acidi dellacido acetico, per lo meno per quel che riguarda la dissociazione della prima funzione carbossilica, e leffetto del sostituente dipende fortemente dal numero di legami che lo separano dalla funzione acida. Il valore pi alto della seconda pKa dipende dalla presenza di un sostituente carbossilato e dalla solvatazione.
Confronto dei valori di pKa di derivati carbonilici e dei loro analoghi metilenici
Per quali di questi acidi si possono generare i corrispondenti anioni in H2O?
Come si forma un enolato? Lenolato altro non che il prodotto di una reazione acido base di un enolo. Un enolo pu anche essere chiamato alcol vinilico. Si pu ottenere per idratazione di un alchino:
Lenolo per non un composto stabile e si trasforma velocemente in un composto carbonilico mediante una tautomeria (tautomeria cheto-enolica)
Meccanismo della tautomeria cheto-enolica (ambiente acido):
H2O come nucleofilo
H2O come base
Meccanismo della tautomeria cheto-enolica (ambiente basico):
Formazione di enolati a partire da composti carbonilici:
Reazioni di isomerizzazione di composti carboniliciIsomerizzazioni di zuccheri mediante trasposizione della funzione carbonilica (D-glucosio fosfato a D-fruttosio fosfato)
Processo di glicolisi:
La reazione avviene via formazione di un endiolo acido catalizzata (lenzima utilizza funzioni acide)
Reazioni di racemizzazione di composti carboniliciSe un chetone enantiopuro viene trattato con un acido o una base racemizza attraverso la formazione di un intermedio achirale, lenolo
La racemizzazione un processo energeticamente favorito poich la concentrazione dellenantiomero di partenza si dimezza durante il processo
H = O minima interazione intermolecolari in soluzione, S=-R x1lnx1 R x2lnx2 Per un racemo, allequilibrio, x1=x2=1/2
G= H - T S
S=-1/2R ln1/2 1/2R ln1/2= -R ln1/2 = R ln2 G= - T S = - RT ln2 = -0.41 Kcal/mol a 25C
Reazioni di racemizzazione di composti carboniliciRacemizzazione dell(R)-Thalidomide
sedativo
teratogeno
Anche gli ammino acidi possono racemizzare con questo tipo di meccanismo, anche se questo normalmente non avviene in condizioni fisiologiche
-Alogenazione di chetoni (via enolato, condizioni basiche)Formazione dellenolato
Addizione elettrofila
Formazione di un enolato (H pi acido)
Addizione elettrofila (Dibromo derivato) Ne consegue che la reazione di mono alogenazione non pu essere ottenuta in condizioni basiche. La maggior reattivit dei prodotti pu essere sfruttata per la produzione di aloformio (iodoformio, bromoformio, cloroformio)
-Alogenazione di chetoni (condizioni acide)
Protonazione del chetone
Formazione dellenolo
Addizione elettrofila
Br- agisce da base e rigenera la funzione carbonilica
-Alogenazione di chetoni (condizioni acide)Cosa accade se Br- porta un attacco nucleofilo al carbonio carbonilico?
Si genera una bromoidrina geminale che instabile e rigenera la funzione carbonilica eliminando HBr L-bromo-chetone enolizza pi lentamente del chetone non sostituito e quindi si pu ottenere il prodotto monoalogenato.
Sintesi di enolati con basi fortiSe si vogliono utilizzare nucleofili diversi da un alogenuro si deve generare lenolato in presenza di una base forte (pKa20-25).
Generalmente si utilizzano solventi aprotici quali il THF (nel quale LDA solubile). Con lLDA e la HDA si utilizza una base non nucleofila, con NaH si ottiene H2 come prodotto secondario La posizione di alchilazione al C quella termodinamicamente favorita!
Cosa avviene se abbiamo un chetone non simmetrico?
Si possono formare due enolati: il primo quello che si forma pi velocemente e viene chiamato prodotto cinetico (enolato cinetico) Il secondo quello pi stabile e viene chiamato prodotto termodinamico (alchene tetrasostituito). E quello che si forma principalmente se il sistema viene portato allequilibrio.
Prodotto cinetico e prodotto termodinamico
I protoni in posizione 6 sono meno ingombrati da un punto di vista sterico, per cui possono essere rimossi pi facilmente se si utilizza una base stericamente ingombrata come lLDA. Per cui scegliendo le condizioni di reazione possiamo favorire la formazione di un prodotto (prodotto cinetico) o dellaltro (prodotto termodinamico). Se lavoriamo a bassa temperatura e con una base forte favoriamo il prodotto cinetico (diminuiamo lenergia dello stato di transizione) se lavoriamo a temperature pi elevate, eccesso di chetone e con basi deboli favoriamo il prodotto termodinamico.
Controllo cinetico
Base forte e ingombrata, bassa temperatura Controllo termodinamico
Base meno forte poco ingombrata, alta temperatura
Esercizio: Razionalizzare la selettivit di queste due reazioni.
Reazione di un enolato con un alogenuro alchilico
Se si stratta un enolato con un alogenuro alchilico si ottiene un prodotto di alchilazione. La reazione procede con un tipico meccanismo SN2 se lalogenuro primario. Con alogenuri secondari e terziari i prodotti di eliminazioni prevalgono poich lenolato una base forte. In realt la reazione non si ferma a livello di mono alchilazione. Infatti lnolato di partenza pu agire da base e deprotonare nuovamente il prodotto mono-alchilato
Il nuovo enolato pu nuovamente essere alchilato portando al derivato dialchilato. Per cui si ottengono miscele di prodotti polialchilati. In alcuni casi si possono ottenere selettivamente prodotti di mono-alchilazione
Esercizio: Come preparereste questi composti utilizzando unalchilazione? Potete utilizzare composti organici fino a 8 atomi di carbonio e qualsiasi reagente inorganico
Enolati di esteri o nitriliLa pKa di un di un protone in di un estere 4-5 ordini di grandezza maggiore di quella di un chetone e aldeide (pKa=24-25). Questo deriva dalla minore stabilizzazione che si ottiene poich il sistema carbossilico gi parzialmente delocalizzato ancor prima della deprotonazione
Una delle formule di risonanza pone una carica positiva sul carbonio carbonilico, aumentando per effetti induttivi lacidit dei protoni in
Una delle formule di risonanza pone la carica positiva sullatomo di ossigeno piuttosto che su quello carbonilico
Vi comunque un elevato grado di stabilizzazione della caric negativa rispetto ad un alcano
Per i protoni legati al carbonio in ad un nitrile, anchesso stabilizzato per risonanza, si hanno valori di pKa= 25-30.
Se si utilizzano basi forti come LDA reazioni tipo condensazione usualmente non competono
Una volta formato, lenolato pu reagire con un alogenuro alchilico con un tipico meccanismo SN2 portando al prodotto alchilato. Se si utilizzano alogenuri secondari o terziari la reazione di eleminazione pu competere poich lavoriamo in presenza di una base forte.
Come elettrofili possono essere usati alogenuri alchilici o epossidi
Enolati di acidiPu essere generato lenolato di un acido?
La pKa dei protoni di un carbonio in al carbonio di un acido ha un valore confrontabile con quella di un estere
Per cui in presenza di 2 equiv. di base si ottiene lenolato
La reazione con un alogenuro alchilico seguita a trattamento acido porta allacido sostituito.
La reazione analoga alla formazione di un enolato di un estere, alchilazione e idrolisi. E quindi pi semplice da un punto di vista operativo e la reazione di condensazione non compete.
Esercizio: proporre delle vie sintetiche per i seguenti composti partendo sia da un acido che da un estere e da un arganoalogenuro con 5 o meno atomi di carbonio
Malonati, acetoacetati, cianoacetati
In questi derivati la presenza di due gruppi elettron attrattori rende i protoni del carbonio metinico o metilenico particolarmente acidi e reattivi nella formazione di enolati. Questi protoni hanno una pKa= 10-14.
Reazioni di alchilazione con reagenti contenenti metileni attivati
In questo caso lenolato che si forma il prodotto cineticamente e termodinamicamente favorito. Inoltre la reazione richiede condizioni molto meno estreme, si usa una base molto meno forte (NaOEt). In presenza di un eccesso di base si ottiene la doppia sostituzione Se si utilizzano --dialoalcani in presenza di un eccesso di base si possono ottenere cicloacani (anelli da 3 a 6 atomi).
Anche la presenza di un gruppo fenile riesce ad attivare un metilene consentendo lottenimento di -chetoni e esteri
Esercizio: Come preparereste i seguenti composti utilizzando un alogenuro alchilico e un derivato con metileni attivati?
Sostituenti solforati Diversi gruppi funzionali contenenti lo zolfo (e anche il fosforo) hanno propriet elettron attrattrici e sono quindi capaci di attivare gli idrogeni di un carbonio in . Lo stesso DMSO in condizioni basiche pu essere deprotonato
La presenza del gruppo carbonilico attiva ulteriormente i gruppi metilenici rendendoli pi acidi
Letil fenilsolfoacetato viene deprotonato facilmente in presenza di NaH generando lenolato corrispondente:
Quindi in generale:
Ad elevate temperature un solfossido elimina facilmente portando alla formazione di un doppio legame.
Come posso ottenere un -cheto solfossido?
Esercizio: un enolato di un estere reagisce con dimetil o difenildisolfuro producendo lanaloga specie -sulfenilica. Quale il prodotto che vi attendete dalla seguente sequenza di reazioni?
Decarbossilazione di funzioni carbossiliche in a gruppi carbonilici La presenza di due gruppi attivanti rende i protoni metilenici pi acidi e quindi reattivi e elimina problemi di regiochimica o reazioni collaterali
Cosa possiamo fare se in realt vogliamo il prodotto mono funzionalizzato?
Fortunatamente la funzione esterea decarbossila facilmente per semplice riscaldamento in acido diluito
Decarbossilazione di funzioni carbossiliche in a gruppi carbonilici Idrolisi acida Lacido carbossilico che si forma ha una funzione C=O in posizione che facilita la rimozione di CO2 in ambiente acido grazie alla formazione di un enolo. Il processo pu avvenire sia con lintervento dellH2O (2a) che per via intramolecolare (2b)
Lenolo poi tautomerizza generando il chetone
La stessa reazione pi essere fatta con il dietilmalonato e letil ciano acetato portando allottenimento di un estere o un nitrile
In questo caso si parla di ENOLATO EQUIVALENTE
Composti con metileni attivati che sono enolato equivalenti
Esempio: proporre una sintesi per il seguente composto utilizzando reagenti che abbiano fino a 7 atomi di carbonio
Esercizio: Come preparereste questi composti utilizzando un precursore dicarbonilico?
Decarbossilazione di beta-cheto acidi importante trasformazione metabolica in processi biologici
Questo processo avviene a causa della intrinseca instabilit degli acidi carbossilici in a una funzione carbonilica Ciclo dellacido citrico metabolismo aerobico
Il citrato viene isomerizzato a isocitrato via formale eliminazione e addizione di acqua
Ossidazione della funzione alcolica a CO da parte del NAD+ produce un intermedio -chetoacido che decarbossila fornendo lchetoglutarrato.
Il meccanismo di decarbossilazione non molto diverso da quello che abbiamo visto avvenire in soluzione.
La perdita di CO2 porta alla formazione di un enolato che stabilizzato dalla presenza di un catione Mn(II) presente nel sito attivo dellenzima.
Protonazione dellenolato porta ad ottenere il derivato carbonilico corrispondente
Addizioni Nucleofile di Enolati a Composti CarboniliciLaddizione di nucleofili allossigeno, azoto, zolfo a composti carbonilici una reazione che avete gi incontrato e studiato. Anche nucleofili al carbonio quali carbanioni (reagenti di Grignard, alchil litio) o gli enolati possono reagire con derivati carbonilici portando alla formazione di un nuovo legame C-C.
Questa classe di reazioni viene chiamata Condensazione Aldolica o Condensazione di Claisen a seconda che lelettrofilo sia un chetone/aldeide o un estere/tioestere
Condensazione aldolica base catalizzata (rivisitata)
In ambiente basico si forma lenolato. In ambiente acquoso la quantit di enolato presente molto bassa poich i protoni legati al carbonio in al carbonile sono meno acidi di quelli dellacqua di diversi ordini di grandezza.
Per cui nellambiente di reazione vi unelevata quantit di acetaldeide che pu reagire con lenolato, formando il nuovo legame carbonio-carbonio
Infine lalcolato risultante rimuove un protone dallacqua producendo una -idrossi aldeide e rigenerando il catalizzatore OH-
-idrossi aldeide prodotta ha ancora protoni acidi in ad un carbonile: se lOH- rimuove un altro protone, generando lenolato corrispondente, sono possibile due diverse reazioni: Condensazione con unaltra molecola di aldeide, ottenendo trimeri o oligomeri Eliminazione di H2O producendo unaldeide ,-insatura
La disidratazione del prodotto di una condensazione aldolica avviene con un meccanismo E1cb
Si forma un doppio legame coniugato con il gruppo carbonilico. Il meccanismo di eliminazione diverso da quelli visti in precedenza (E1 e E2) perch vi inizialmente la formazione di un carbanione, permessa dalla presenza della funzione carbonilica. Inoltre il gruppo uscente un OH-, un gruppo uscente non particolarmente buono. Questo meccanismo viene chiamato eliminazione unimolecolare, base coniugata (E1cb).
E1 Eliminazione Unimolecolare
Processo del tutto analogo alla SN1 C un ingombro troppo elevato per avere attacco nucleofilo al carbocatione Il nucleofilo troppo debole
Avviene invece la rimozione dellatomo di idrogeno in e spostamento del doppietto elettronico che neutralizza la carica positiva
E1 Eliminazione Unimolecolare - regiochimica
alchene interno
alchene terminale
Alchene terminale minor ingombro sterico e statisticamente favorito Alchene interno:Alchene terminale = 70:30
Perch si forma preferenzialmente lalchene interno?
La formazione dellalchene una reazione di equilibrio La reazione procede sotto il controllo termodinamico
E2 Eliminazione Bimolecolare
Eliminazione preferita alla sostituzione nucleofila, nucleofilo agisce da base
La base estrae uno degli idrogeni in a al centro elettrofilo Il processo viene denominato deidroalogenazione ed concertato La velocit dipende dalla concentrazione del substrato e della base e quindi una eliminazione bimolecolare E2
Stereochimica delle eliminazioni bimolecolariGeneralmente lE2 produce lalchene pi sostituito
Latomo di idrogeno e il gruppo uscente devono essere in posizione antiperiplanare nello stato di transizione
Stereochimica E2: processo stereospecifico
Eliminazione contro sostituzione
Condensazione aldolica acido catalizzata
In ambiente acido si ha la formazione dellenolo, un nucleofilo molto meno forte dellenolato. Per lambiente acido rende il C=O un elettrofilo pi forte, a causa della protonazione dellossigeno carbonilico
La deprotonazione porta alla -idrossi aldeide
Il processo acido base difficile da fermare a livello di -idrossi aldeide. Lambiente acido favorisce la reazione di eliminazione (E1 o E2)
Reazione RetroaldolicaLa condensazione aldolica, indipendentemente dalla catalisi acida o basica una reazione di equilibrio. Il processo inverso denominato reazione retroaldolica
La facitilt con cui questo processo avviene dipende da effetti sterici alle posizione e rispetto al carbonile.
Condensazione aldolica di chetoni
Chetoni enolizzabili e reattivi possono anchessi fornire la condensazione aldolica anche se, molto spesso, i fattori sterici rendono la reazione inversa, la reazione retroaldolica, pi favorevole. La reazione pu essere spostata a destra se si elimina acqua e si forma il derivato ,-insaturo (condizioni acide). Lapplicazione pi importante della condensazione aldolica di chetoni lanellazione intremolecolare di Robinson.
Condensazione aldolica mista
Lutilizzo di due aldeidi enolizzabili porta ad ottenere una complessa miscela di reazione; derivante dalla reazione di entrambi gli enolati con le due aldeidi (4 prodotti) e dai prodotti di eliminazine di acqua, i corrispondenti derivati ,-insaturi (4 prodotti).
Per rendere la condensazione aldolica mista un processo efficace dobbiamo utilizzare: Unaldeide che non sia enolizzabile Uno specifico enolato Un metodo enzimatico Aldeidi non enolizzabili: benzaldeide
Come si forma il derivato ,-insaturo?
Se il chetone pu formare solamente un enolato, la reazione procede agevoltente e si ottengono elevate rese di un singolo prodotto.
Per esempio se si utilizzano derivati del boro, quali dialchil boro triflati, in presenza di una base debole quale la DIEA si ottiene lenolato di boro corrispondente.
La condensazione aldolica pu anche essere controllata utilizzando acidi di Lewis.
Il derivato di boro, acido di Lewis, si coordina con lossigeno carbonilico
La base rimuove il protone acido generando il doppio legame con concomitante perdita dello ione triflato
Quindi lenolato di boro viene aggiunto ad unaldeide, coordinandola.
In questo modo il boro svolge il duplice ruolo di attivatore del carbonile (acido di Lewis) e di templante, portando i due reagenti vicini
A questo punto avviene lattacco nucleofilo al carbonile da parte dellenolato e si forma il nuovo legame C-C.
Ossidazione con H2O2 in base porta ad ottenere la -idrossi aldeide Se entrambi i composti carbonilici sono enolizzabili si riesce ad evitare la reazione di autocondensazione
La reazione pu anche decorrere con elevate stereoselezioni
La reazione pu anche decorrere con elevate stereoselezioni
Lenolato Z si forma preferenzialmente. La reazione con benzaldeide porta ad un solo prodotto, laddotto sin (si formano contemporaneamente due stereocentri).
sin
Lenolato Z si forma preferenzialmente. La reazione con benzaldeide porta ad un solo prodotto, laddotto sin (si formano conteporaneamente due stereocentri).
sin
anti
Linterazione 1,3-diassiale sfavorisce la formazione delladdotto anti
Esercizi: Quale il prodotto maggioritario atteso per ciascuna delle seguenti reazioni:
Laddizione di un estere enolato ad unaldeide o chetone una variante della condensazione aldolica assistita da un acido di Lewis
Si ha produzione dellenolato, laddizione nucleofila al carbonile e la protonazione per fornire lalcol
Esercizio. Un carbanione derivato da unimmina o da unammide terziaria pu anche reagire con un composto carbonilico. Quale il prodotto maggioritario atteso dalle seguenti reazioni?
Un enzima, la fruttosio-1,6-difosfato aldolasi , FDP-aldolasi, pu essere utilizzata come catalizzatore in sintesi organica. In particolare essa utilizza lidrossiacetone fosfato come reagente nucleofilo, insieme ad altri reagenti elettrofili.
La reazione fornisce in maniera stereospecifica due stereocentri, con completo controllo della stereochimica del processo.
Il meccanismo della reazione prevede la coordinazione del diidrossi fosfato allenzima attraverso un legame imminico, il quale attraverso una reazione acido base viene convertito in enammina
Lenolo reagisce con lelettrofilo generando due nuove funzioni alcoliche a geometria controllata.
Dopo aver reagito con il composto carbonilico il diidrossi acetone fosfato viene idrolizzato rilasciando il prodotto della condensazione aldolica.
La condensazione di Claisen (rivisitata)Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili. Quando un estere viene trattato con una base avviene una trasformazione che simile alla condensazione aldolica, la Condensazione di Claisen. La condensazione di Claisen porta alla formazione di -chetoesteri dopo trattamento acido.
Il meccanismo simile a quello delle condensazioni aldoliche, ma vi sono alcune differenze: a. Bassa concentrazione dellenolato (pKa24)
Lenolato reagisce con unaltra molecola di estere portando ad un intermedio tetraedrico
A questo punto la funzione carbonilica viene rigenerata con luscita di un gruppo etilato
La reazione sembrerebbe fermarsi qui. Invece poich il composto che si formato ha un metilene attivato, nelle condizioni di reazione la base in grado di deprotonarlo nuovamente generando un nuovo enolato, altamente stabilizzato.
Perch questa reazione avvenga deve essere presente almeno un equivalente di base. Questa unaltra differenza rispetto alla condensazione alcolica dove vengono richieste solamente quantit catalitiche di base.
Dopo trattamento acido si ottiene il -chetoestere.
Se il reagente lacetato di etile questa reazione viene chiamata condensazione acetoacetica o sintesi acetoaceticaNella Condensazione di Claisen la formazione dellenolato stabilizzato per risonanza permette di spostare lequilibrio della reazione a destra
Meccanismo della condensazione di Claisen
La deprotonazione dellintermedio C in ambiente basico irreversibile e quindi porta alla conversione completa in D. Solo in ambiente acido si riesce ad ottenere C come prodotto finale
Condensazione di Claisen Retro ClaisenTutti i passaggi della condensazione di Claisen sono processi di equilibrio. La formazione di un dicarbonil enolato porta la reazione a completamento. Se questo processo non pu avvenire allora lequilibrio favorisce i reagenti.
Etil isobutirrato contro etil acetato
In presenza di ioni EtO- vi un ulteriore attacco nucleofilo al centro carbonilico anzich deprotonazione e la reazione torna indietro oppure vi la formazione di un enolato e la reazione procede verso i prodotti
Un metodo per prevenire la retro Claisen lutilizzo di basi forti per la generazione dellenolato
Lenolato viene quindi trattato con un equivalente di estere o, ancor meglio, lacil cloruro corrispondente.
Esercizio. Quale sar il prodoto principale delle seguenti reazioni?
Ciclizzazione di Dieckmann: condensazione di Clasen intramolecolare
Il meccanismo del tutto analogo a quello della condensazione di Claisen: generazione dellenolato, formazione dellintermedio tetraedrico, espulsione del gruppo uscente, formazione del carbanione stabilizzato per risonanza
Un trattamento acquoso acido consente di ottenere il prodotto neutro nel quale la funzione carbonilica allinterno dellanello
Poich i -chetoesteri possono essere facilmente decarbossilati, questa una strategia sintetica per ottenere cicloalcanoni
Condensazione di Claisen mistaAnalogamente a quato avviene nella condensazione aldolica anche nella condensazione di Claisen possono essere usati due diversi esteri. La reazione ha esiti migliori se uno degli esteri non ha idrogeni in al carbonile
Esempi di condenzazione di Claisen mista appaiono anche nella ciclizzazione di Dieckmann quando una delle funzioni esteree non ha protoni in posizione . Questo consente la formazione di un unico prodotto.
Si pu ottenere un singolo prodotto anche in presenza di due funzioni esteree enolozzabili se la reazione reversibile
Unico prodotto
Uno dei due prodotti non ha protoni enolizzabili, per cui la retro-Claisen favorita. Per cui lequilibrio si sposta verso la formazione del regioisomero 2,6-disostituito.
Nella condensazione di Claisen mista possiamo anche utilizzare un chetone come partner enolizzabile. I chetoni cono circa 4 ordini di grandezza pi acidi degli esteri, per cui formano lenolato in modo preferenziale. Si preferisce utilizzare un estere non-enolizzabile, anche se i chetoni forniscono la reazione di autocondensazione lentamente. Unapplicazione comune di questa reazione lidrossimetilenazione dei chetoni
Un trattamento acido fornisce prodotto che esiste principalmente in forma enolica
Esercizio: spiegare i seguenti processi
Condensazione di Claisen mista: Carbonilazione
Gli enolati, essendo nucleofili, sono in grado di reagire con la CO2. Per, poich i composti -carbossi carbonilico decarbossilano, lareazione completamente reversibile
Ci sono diversi modi per superare il problema. Il pi semplice quello di preparare un estere piuttosto che lacido stesso, utilizzando letil cloroformiato o il dietilcarbonato invece che la CO2.
Gli enolati, essendo nucleofili, sono in grado di reagire con la CO2. Per, poich i composti -carbossi carbonilico decarbossilano, la reazione completamente reversibile
Unidrolisi controllata pu portare allacido, ma la reazione di decarbossilazione sempre possibile
Reazione di KnoevenagelLa reazione di Knoevenagel una variante della condensazione aldolica nella quale la base coniugata di un composto con metileni attivi il nucleofilo
Il prodotto che si ottiene un alchene che contiene due gruppi accettori geminali. La reazione avviene in condizioni debolmente basiche (basi organiche quali la piperidina) o neutre (acetato di piperidinio)
Reazione di Knoevenagel: meccanismo
Reazione di Knoevenagel: prodotti di reazione
Reazione di HenryLa reazione di Henry una variante della condensazione aldolica nella quale il nucleofilo la base coniugata di un nitroalcano (pKa