Chimica Fisica I · -m=-l, -l+1, …, l-1, l numero quantico magnetico - Le energie corrispondenti...
Transcript of Chimica Fisica I · -m=-l, -l+1, …, l-1, l numero quantico magnetico - Le energie corrispondenti...

Antonino Polimeno 1
Chimica Chimica FisicaFisica –– BiotecnologieBiotecnologie sanitariesanitarieLezioneLezione n. n. 1414
−− LL’’equazioneequazione didi SchrodingerSchrodinger−− LL’’atomoatomo didi idrogenoidrogeno−− OrbitaliOrbitali atomiciatomici

Antonino Polimeno 2
Dai Dai modellimodelli primitiviprimitivi allaalla meccanicameccanica quantisticaquantistica
- Perchè le energie sono quantizzate?- Esistono veramente delle “orbite” lungo le quali gli elettroni sono
costretti a muoversi?- Come si possono generalizzare le conclusioni di Bohr agli atomi
multielettronici?- Come si possono descrivere i legami chimici?- La risposta a questi ed a molti altri problemi deriva da una
rifondazionerifondazione completacompleta delladella descrizionedescrizione della materia a livellomolecolare ed atomico, secondo i principi della meccanicaquantistica che trova la sua base (non relativistica) nell’equazione diSchröndinger
ˆi Ht∂Ψ = Ψ
∂

Antonino Polimeno 3
PrincipioPrincipio didi HeisenbergHeisenberg
- Principio di indeterminazione di Heisenberg (1925)
- dove ∆x e ∆p sono rispettivamente le incertezze nella misura contemporanea della posizione x e del momento lineare (impulso) p=mv.
- Quindi le traiettorie classiche, che implicherebbero la determinazione contemporanea della posizione e dell'impulso (velocità) della particella, non sono possibili a meno di non considerare corpi macroscopici per i quali l'effetto di è trascurabile.
2p x∆ ∆ ≥

Antonino Polimeno 4

Antonino Polimeno 5
MeccanicaMeccanica quantisticaquantistica ed ed equazioneequazione didi SchrSchröödinger (1)dinger (1)
- Per descrivere il moto elettronico dobbiamo usare uno strumento diverso dalle traiettorie e compatibile con il principio di indeterminazione di Heisenberg.
- L’elettrone di un atomo di idrogeno è rappresentato da una funzionedelle coordinate spaziali, detta funzione d’onda che descrive la probabilità di trovare l’elettrone in un dato punto dello spazio
- N.B. Integrando su tutto lo spazio si ottiene 1 (la probabilità chel’elettrone esista da qualche parte) → condizione di normalizzazionedi un orbitale.
( ) ( ) ( ) 2, ,,r t r dP r t dVtΨ ≡ Ψ ⇒ = Ψ
( ) 2, 1r t dVΨ =∫

Antonino Polimeno 6
MeccanicaMeccanica quantisticaquantistica ed ed equazioneequazione didi SchrSchröödinger (2)dinger (2)
( ),r tΨtt11
tt22
tt33
tt44
( )r t

Antonino Polimeno 7
MeccanicaMeccanica quantisticaquantistica ed ed equazioneequazione didi SchrSchröödinger (3)dinger (3)
- Le funzioni d’onda elettroniche di un atomo o molecola si ottenegonorisolvendo l’equazione di Schrödinger (1925) che descrive la variazione nello spazio e nel tempo delle funzioni che descrivono gli elettroni
- L’equazione così definita sereve per studiare la variazione nel tempo degliorbitali, oltre che nello spazio. Se si vogliono conoscere gli stati stazionaridegli elettroni in una molecola si risolve l’equazione (derivata dallaprecedente) di Schrödinger indipendente dal tempo
ˆi Ht∂Ψ = Ψ
∂
( ) ( )H r E rΨ = Ψ

Antonino Polimeno 8
GlossarioGlossario (1)(1)
- Hamiltoniano / Operatore che descrive l’energia totaledel sistema
- Orbitale / Funzione d’onda stazionaria che descrive lo stato di un elettrone
- Energia dell’orbitale / Valore dell’energia dell’elettrone
( )2
2ˆ ˆ2 e
H rm
U= − ∇ +
( ) ( ), ,r x y zΨ = Ψ
E

Antonino Polimeno 9
GlossarioGlossario (2)(2)
- La funzione d’onda è detta autofunzione dell’hamiltoniano, e l’energiacorrispondente è detta autovalore dell’hamiltoniano, perchè per definizione, dall’equazione di Schrödinger
- Quindi applicando l’hamiltoniano alla funzione d’onda si ottiene la stessafunzione a meno di un fattore costante (l’autovalore).- Il problema matematico consiste nell'individuare i possibili stati del sistema
dati come funzioni d'onda e corrispondenti energie, risolvendo l’equazionedi Schrödinger
- L’insieme di possibili soluzioni è l’insieme di tutti i possibili stati elettronici(orbitali) dell’atomo o della molecola e delle loro energie
- Gli orbitali sono caratterizzati da etichette, dette numeri quantici, chedefiniscono completamente la loro forma e le loro proprietà
( ) ( )H r E rΨ = Ψ

Antonino Polimeno 10
AtomoAtomo didi idrogenoidrogeno ed ed equazioneequazione didi SchrSchröödinger (1)dinger (1)
- Ora possiamo descrivere l’atomo di idrogeno in modo corretto: non parliamo più diorbite (traiettorie degli elettroni), ma di orbitali, le funzioni d’onda dell’elettrone cherisente del potenziale esercitato dal nucleo
- In particolare gli orbitali (e le energie relative) delle’elettrone nell’atomo di idrogenosono caratterizzati da 3 numeri quantici
- n=1, 2, 3, … numero quantico principale- l=0, 1, …, n-1 numero quantico secondario o di momento angolare- m=-l, -l+1, …, l-1, l numero quantico magnetico
- Le energie corrispondenti dipendono solo dal numero quantico principale, secondo la stessa espressione di Bohr!
2 22
0
1ˆ ˆ2 4e
eHm rπε
= − ∇ −
( )nlm rΨ
2
1n HE hcR
n= −
4
2 308e
Hm eR
h cε=

Antonino Polimeno 11
AtomoAtomo didi idrogenoidrogeno ed ed equazioneequazione didi SchrSchröödinger (2)dinger (2)
- Gli orbitali con l=0, 1, 2 ... si dicono orbitali s, p, f ... Ed hanno forme caratteristiche- In particolare gli orbitali di tipo s, a cui corrisponde l’unico possibile valore del numero
quantico magnetico m=0 hanno sempre forma sferica- Le funzioni che rappresentano I primi orbitali di tipo s sono
0
0
0
/1 3/ 2
0
/ 22 3/ 2
00
2/3
3 23/ 20 00
2
1 28
1 4 469 3
r as
r as
r as
ea
r eaa
r r ea aa
−
−
−
Ψ =
⎛ ⎞Ψ = −⎜ ⎟
⎝ ⎠⎛ ⎞
Ψ = − +⎜ ⎟⎝ ⎠

Antonino Polimeno 12

Antonino Polimeno 13
AtomoAtomo didi idrogenoidrogeno ed ed equazioneequazione didi SchrSchröödinger (3)dinger (3)
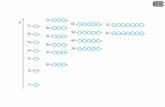
- Ogni numero quantico ha una relazione più o meno diretta con una proprietà chimico-fisica; - il numero quantico principale determina la quantizzazione dell’energia- Il numero quantico secondario determina la quantizzazione del momento angolare (legato
alla distribuzione nello spazio dell’elettrone)
- Gli orbitali con l=0 hanno una distribuzione sferica intorno al nucleo (momento angolare nullo)- Gli orbitali non sferici (l=1,2,…) hanno invece distribuzioni con direzioni preferenziali nello
spazio: il numero quantico magnetico definisce le possibili orientazioni
( )1l r p l l= × ⇒ +
l=0 (2s) EE2
n=12
m=1 (2p+1)
l=1 m=0 (2p0)
m=-1 (2p-1)

Antonino Polimeno 14

Antonino Polimeno 15
AtomoAtomo didi idrogenoidrogeno ed ed equazioneequazione didi SchrSchröödinger (3)dinger (3)
- Infine un elettrone ha una proprietà aggiuntiva, indipendentementedall’orbitale in cui risiede, detta spin elettronico
- L'elettrone ha un momento angolare intrinseco, che può essere visualizzatocome la ‘rotazione’ della particella elettrone su se stessa. Di fatto lo spin diun elettrone assume due valori soltanto per rotazioni orarie antiorarie; alladirezione di rotazione è associato il numero quantico di spin che assume i valori possibili mS=1/2 e mS=-1/2 detti anche spin α e spin β
- La funzione d’onda complessiva di un elettrone in un orbitale, con unodato stato di spin è caratterizzata da 4 numeri quantici
- Gli stati accessibili ad un elettrone in un atomo di idrogeno sono raggruppatiin gusci (ogni guscio riunisce tutti gli orbitali con la stessa energia)
, , , Sn l m mΨ

Antonino Polimeno 16

Antonino Polimeno 17
AtomoAtomo didi idrogenoidrogeno ed ed equazioneequazione didi SchrSchröödinger (3)dinger (3)
1. All’interno di ogni guscio, si può verificare come esistano differenza di energia tra i diversi orbitali, la cui energia non dipende solo dal numero quantico principale(verificabile mediante approssimazioni di ordine superiore → accoppiamento spin-orbita)
2. Il passaggio da un orbitale ad una data energia ad un orbitale con una diversaenergia avviene mediante assorbimento o emissione di energia
3. Non tutte le transizioni da un orbitale all’altro sono permesse (dipende dalla forma degli orbitali e dal tipo di stimolazione). Si hanno quindi regole di selezione, chedeterminano le transizioni permesse; per l’atomo di idrogeno
Emi
Ass
ssi
orbime
one:
nto:
iniz
ini
iale fina
ziale final
le
e
E h
E
E
E h
ν
ν= +
+ =
1 0, 1l m∆ = ± ∆ = ±

Antonino Polimeno 18
... e per ... e per finirefinire: : ilil gattogatto didi SchrSchröödinger ...dinger ...