* 4 = terapia di mantenimento dopo 2 dosi di induzione * giorni da dedicare alla vita… non alla...
-
Upload
mariella-bianchi -
Category
Documents
-
view
222 -
download
2
Transcript of * 4 = terapia di mantenimento dopo 2 dosi di induzione * giorni da dedicare alla vita… non alla...

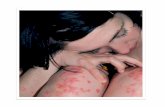
* 4 = terapia di mantenimento dopo 2 dosi di induzione
*
giorni da dedicare alla vita… non alla psoriasi
Primo di una nuova classe di farmaci biologici che agisce selettivamente su IL-12 e IL-23, per il trattamentodella psoriasi a placche moderata-grave 1
Dep
osi
tato
pre
sso
AIF
A i
n d
ata
03/0
9/20
10
R
CP
in
all
egat
o
1. Stelara® Riassunto delle caratteritiche del prodotto.

Stelara® (ustekinumab): primo di una classe di biologici con meccanismo d’azione unico, altamente selettivo1-5
• Struttura–Anticorpo monoclonale interamente umano
• Target–Subunità p40 di IL-12 e IL-23
• Meccanismo d’azione - ipotesi – Blocca il legame di IL-12 e IL-23 con il
recettore IL-12Rβ1 sulle cellule T indifferenziate
– Impedisce la differenziazione/espansione clonale delle sottopopolazioni linfocitarie Th1 e Th17 coinvolte nella patogenesi della psoriasi
IgG
Anti-p40 umano
1. Stelara® Riassunto delle caratteritiche del prodotto. 2. Gately MK et al. Annu Rev Immunol. 1998;16:495-521. 3. Wilson NJ et al. Nat Immunol. 2007;8(9):950-7. 4. Nickoloff BJ, Nestle FO. J Clin Invest. 2004;113(12):1664-75. 5. Nestle FO et al. J Invest Dermatol. 2004; 123:xiv-xv.

IL-12 e IL-236,7: come agiscono normalmente
6. Torti DC, Feldman SR. J Am Acad Dermatol. 2007;57(6):1059-68. 7 Trinchieri G, Nat Rev Immunol. 2003;3(2):133-46.

Inibizione di IL-12 e IL-23 con anticorpo anti-p405
5. Nestle FO, Conrad C. J Invest Dermatol. 2004;123(6):xiv-xv.6. Torti DC, Feldman SR. J Am Acad Dermatol. 2007;57(6):1059-68.

2. Gately MK et al. Annu Rev Immunol. 1998;16:495-521. 3. Wilson NJ et al. Nat Immunol. 2007;8(9):950-7. 4. Nickoloff BJ, Nestle FO. J Clin Invest. 2004;113(12):1664-75. 5. Nestle FO et al. J Invest Dermatol. 2004; 123:xiv-xv.
Viene limitata la differenziazione e l’espansione clonale di Th1 e Th17
L’anticorpo si lega alla subunità p40 di IL-12 e IL-23, impedendo il legame con i loro recettori di superficie
Down-regolazionedelle citochine infiammatorie
Stelara® ha un meccanismo d’azione unico, altamente selettivo2-5

ClearanceEfficacia rapida, significativa e prolungata8,9
8. Leonardi CL et al. Lancet. 2008;371:1665-74. 9. Papp K et al. Lancet. 2008;371:1675-84.

PHOENIX 1 e PHOENIX 2 Gli Obiettivi8,9
Studi di Fase 3, in doppio cieco, controllati verso placebo, multicentrici, su 1.996 pazienti, che hanno valutato efficacia e sicurezza di Ustekinumab nel trattamento di pazienti con psoriasi a placche di grado da moderato a grave 1,2
Obiettivo primario: − Percentuale di pazienti che hanno raggiunto un miglioramento
PASI >75% dal basale alla settimana 12 Obiettivi secondari:
− Percentuale di pazienti con malattia eliminata o minima secondo Physician Global Assessment (PGA) alla settimana 12
− Miglioramento del Dermatology Life Quality Index (DLQI)− Tempo alla perdita della risposta nei soggetti randomizzati a
continuare il trattamento di mantenimento o a placebo (PHOENIX 1) − N° visite con risposta PASI 75 (settimane 40-52) nei pazienti trattati
con ustekinumab ogni 8 settimane e in quelli trattati ogni 12 settimane (PHOENIX 2)
8. Leonardi CL et al. Lancet. 2008;371:1665-74. 9. Papp K, et al. Lancet. 2008;371:1675-84.

PHOENIX 1 e PHOENIX 2 Criteri di inclusione ed esclusione
Criteri di inclusione8,9
Età ≥18 anni Diagnosi di psoriasi a
placche da almeno 6 mesi Candidato per fototerapia o
trattamento sistemico della psoriasi
PASI ≥12 BSA ≥10% Anamnesi negativa o
assenza di sintomi di TB attiva
Criteri di esclusione8,9
Forme di psoriasi non a placche Recente infezione grave, sistemica o
locale Neoplasia nota (eccetto carcinoma
cutaneo basocellulare o squamocellulare trattato da almeno 5 anni)
Precedente trattamento con un farmaco anti-IL-12 o anti-IL-23
Assunzione di farmaci biologici o sperimentali entro i 3 mesi precedenti
Trattamento con terapia sistemica convenzionale per la psoriasi o fototerapia entro le 4 settimane precedenti
Trattamento topico per la psoriasi entro le 2 settimane precedenti
8. Leonardi CL et al. Lancet. 2008;371:1665-74. 9. Papp K, et al. Lancet. 2008;371:1675-84.

PHOENIX 1 - Totale 8
Ustekinumab45 mg
Ustekinumab90 mg
Placebo
Pazienti randomizzati 255 256 255
Maschi, n (%) 175 (68,6%) 173 (67,6%) 183 (71,8%)
Età (anni) * 44,8 (12,5) 46,2 (11,3) 44,8 (11,3)
Peso (kg) * 93,7 (23,8) 93,8 (23,9) 94,2 (23,5)
Trattamento precedente con:
Topici 245 (96,1%) 239 (93,4%) 242 (94,9%)
Fototerapia 173 (67,8%) 169 (66,0%) 150 (58,8%)
Sistemici convenzionali 141 (55,3%) 141 (55,1%) 142 (55,7%)
Biologici 134 (52,5%) 130 (50,8%) 128 (50,2%)
Pazienti con tubercolosi latente 8 (3,1%) 7 (2,7%) 10 (3,9%)
PHOENIX 1Caratteristiche demografiche simili al basale
8. Leonardi CL et al. Lancet. 2008;371:1665-74.
*Media (DS)

PHOENIX 2 - Totale 9
Ustekinumab45 mg
Ustekinumab90 mg
Placebo
Pazienti randomizzati 409 411 410
Maschi, n (%) 283 (69,2%) 274 (66,7%) 283 (69,0%)
Età (anni) * 45,1 (12,1) 46,6 (12,1) 47,0 (12,5)
Peso (kg) * 90,3 (21,0) 91,5 (21,3) 91,1 (21,6)
Trattamento precedente con:
Topici 393 (96,1%) 384 (93,4%) 396 (96,6%)
Fototerapia 286 (69,9%) 267 (65,0%) 276 (67,3%)
Sistemici convenzionali 223 (54,5%) 224 (54,5%) 241 (58,8%)
Biologici 157 (38,4%) 150 (36,5%) 159 (38,8%)
Pazienti con tubercolosi latente 16 (3,9%) 16 (3,9%) 11 (2,7%)
PHOENIX 2Caratteristiche demografiche simili al basale
9. Papp K et al. Lancet. 2008;371:1675-84.
*Media (DS)

PHOENIX 1 - Totale8
Ustekinumab45 mg
Ustekinumab90 mg
Placebo
Pazienti randomizzati 255 256 255
Durata della psoriasi (anni) * 19,7 (11,7) 19,6 (11,1) 20,4 (11,7)
BSA (%) * 27,2% (17,5) 25,2% (15,0) 27,7% (17,4)
Artrite psoriasica, n (%) 74 (29,0%) 94 (36,7%) 90 (35,3%)
Punteggio PASI (0-72) * 20,5 (8,6) 19,7 (7,6) 20,4 (8,6)
PGA Marcato o Grave, n (%) 114 (44,7%) 109 (42,6%) 112 (43,9%)
Punteggio DLQI (0-30) * 11,1 (7,1) 11,6 (6,9) 11,8 (7,4)
PHOENIX 1 Gravità della malattia simile al basale
8. Leonardi CL et al. Lancet. 2008;371:1665-74.
*Media (DS)

PHOENIX 2 - Totale9
Ustekinumab45 mg
Ustekinumab90 mg
Placebo
Pazienti randomizzati 409 411 410
Durata della psoriasi (anni) * 19,3 (11,7) 20,3 (12,3) 20,8 (12,2)
BSA (%) * 25,9% (15,5) 27,1% (17,4) 26,1% (17,4)
Artrite psoriasica, n (%) 107 (26,2%) 94 (22,9%) 105 (25,6%)
Punteggio PASI (0-72) * 19,4 (6,8) 20,1 (7,5) 19,4 (7,5)
PGA Marcato o Grave, n (%) 169 (41,3%) 159 (38,7%) 160 (39,0%)
Punteggio DLQI (0-30) * 12,2 (7,1) 12,6 (7,3) 12,3 (6,9)
PHOENIX 2 Gravità della malattia simile al basale
9. Papp K et al. Lancet. 2008;371:1675-84.
*Media (DS)

PHOENIX 1: disegno dello studio8
Interruzione vs mantenimento del trattamento nel lungo termine
8. Leonardi CL et al. Lancet. 2008;371:1665-74.

PHOENIX 2: disegno dello studio9
Frequenze diverse di somministrazione
9. Papp K et al. Lancet. 2008;371:1675-84.

8. Leonardi CL et al. Lancet. 2008;371:1665-74.
Clearance rapida e significativa con solo 2 somministrazioni sottocutanee
Risposta PASI 75 rapida già alla settimana 48
100
Pazi
en
ti (
%)
80
60
40
20
0 0 4 8 12 16 20 24 28 32 36 40Settimane
79%71%
85%
76,1%
Iniezione di ustekinumab
Ustekinumab 45 mg Ustekinumab 90 mg

Risposta PASI 75 a 12 settimane: PHOENIX 1 simile a PHOENIX 2
Paz
ien
ti (
%)
100
20
40
60
80
Placebo(n=255)
45 mg(n=255)
90 mg(n=256)
100
20
40
60
80
Placebo(n=410)
45 mg(n=409)
90 mg(n=411)
PHOENIX 1 PHOENIX 2
3,7
66,7*75,7*
3,1
67,1* 66,4*
0 0
*p<0.0001 vs placebo per ogni confronto
PASI 75 alla settimana 12 Endpoint primario in PHOENIX 1 e PHOENIX 28,9
8. Leonardi CL et al. Lancet. 2008;371:1665-74. 9. Papp K et al. Lancet. 2008;371:1675-84.

Risposta PASI 75 a 28 settimane:PHOENIX 1 simile a PHOENIX 2
Paz
ien
ti (
%)
100
20
40
60
80
Ustekinumab45 mg
100
20
40
60
80
PHOENIX 18 PHOENIX 29
71,278,6
0Ustekinumab
90 mgUstekinumab
45 mg
69,578,5
Ustekinumab90 mg
0
PASI 75 alla settimana 28(iniezioni alla settimana 0, 4 e 16)
8. Leonardi CL et al. Lancet. 2008;371:1665-74. 9. Papp K et al. Lancet. 2008;371:1675-84.

Effetto massimo raggiunto dopo soltanto 3 somministrazioni sottocutanee
100
Pazi
en
ti (
%)
80
60
40
20
0 0 4 8 12 16 20 24 28 32 36 40Settimane
PASI 75 alla settimana 40 (iniezioni alla settimana 0, 4, 16 e 28)8
79%71%
Massima efficacia osservata a 24 settimane
85%
76,1%
Iniezione di ustekinumab
Ustekinumab 45 mg Ustekinumab 90 mg
8 Leonardi CL et al. Lancet. 2008;371:1665-74.

Risposta PGA : PHOENIX 1 simile a PHOENIX 2
Paz
ien
ti (
%)
100
20
40
60
80
Ustekinumab45 mg
100
20
40
60
80
PHOENIX 18 PHOENIX 29
58,866,3
0Ustekinumab
90 mgUstekinumab
45 mg
61,270
Ustekinumab90 mg
0
PGA “psoriasi eliminata o minima”a 28 settimane
8. Leonardi CL et al. Lancet. 2008;371:1665-74. 9. Papp K et al. Lancet. 2008;371:1675-84.

Miglioramento dell’onicopatia psoriasica in pazienti con psoriasi da moderata a severa10
10. Rich P et al. Poster presented at EADV, Sep 17-21 2008, Paris. Poster FP1007.
Percentuale di pazienti con punteggio PGA ungueale assente o lieve dopo 12 e 24 settimane di
trattamento

Risposta al trattamento mantenuta con una somministrazione ogni 12 settimane8
Miglioramento percentuale mediano del punteggio PASI rispetto al basale (settimane 40-76)*
*Tutti i pazienti randomizzati alla terapia di mantenimento o all’interruzione del trattamento alla settimana 40.
8. Leonardi CL et al. Lancet. 2008;371:1665-74.
Med
ian
a (%
)
100
20
40
60
80
400
Placebo Ustekinumab 45 mgogni 12 settimane
44 48 52 56 60 64 68 72 76
100
20
40
60
80
400
Placebo Ustekinumab 90 mgogni 12 settimane
44 48 52 56 60 64 68 72 76

Efficacia nei pazienti naive paragonabile a quella dei pazienti trattati in precedenza con altre terapie11
11. Papp K et al. Poster presented at EADV, Sep 17-21 2008, Paris. Poster FP1388.
PASI 75 a 12 settimane in base al precedente trattamento con altre terapie
*p<0.001 vs placebo
Paz
ien
ti (
%)
Naïve a trattamenti precedenti Precedenti trattamenti
(n=602)
Terapie sistemiche convenzionali
(n=729)
100
40
20
60
8067,6*71,8*
67,7* 70,4*
Fototerapia
(n=436) (n=895)
74,3*
63*
Biologici(n=760) (n=571)
0

Per i pazienti con psoriasi la pelle può essere solo una parte del problema
Negli studi clinici PHOENIX 1 e PHOENIX 2 i pazienti al basale mostravano una compromissione della qualità di vita valutata con l’indice DLQI12
15
Pu
nte
gg
io m
edio
DL
QI a
l bas
ale
10
5
PHOENIX 18
12. Finlay AY, Khan GK. Clin Exp Dermatol. 1994;19:210-6. 8. Leonardi CL et al. Lancet. 2008;371:1665-74. 9. Papp K et al. Lancet. 2008;371:1675-84.
0
Punteggio DLQI al basale delle popolazioni degli studi PHOENIX 1 e PHOENIX 28,9
PHOENIX 29
Punteggio medio in volontari sani1
11,1
12,2
0,5
11,612,6
Stelara 45 mg Stelara 90 mg

Miglioramento significativo della qualità di vita già dopo 2 somministrazioni sottocutanee 13
Paz
ien
ti (
%)
100
80
60
40
20
Placebo
21,4
Ustekinumab 45 mg
71,8*
Ustekinumab 90 mg
76,9*
0
*p<0.001 vs placebo† Una riduzione ³5 rispetto al basale è considerata clinicamente significativa26
Pazienti con miglioramento clinicamente significativo (≥5 punti)† del punteggio DLQI a 12 settimane (iniezioni alle settimane 0 e 4)14
14 Langley R et al. Presented at WCD, Sep 30 – Oct 5 2007, Buenos Aires. 26. Khilji FA et al. Br J Dermatol. 2002;147(Suppl 2):50.

Miglioramento medio rispetto al basale dei punteggiDLQI, SF-36 PCS e MCS* a 12 settimane
13 - Lebwohl M et al. Poster presented at EADV, Sep 17-21 2008, Paris. Poster FP1362.
DLQI
10,0
8,0
4,0
2,0
Mig
liora
men
to m
edio
6,0
-2,0 -1,3PCS MCS
0,0
2,0**
-0,5
8,0**8,7**
0,6
3,2**2,1** 2,5**
Placebo Ustekinumab 90 mgUstekinumab 45 mg
*PCS: componente fisica del questionario SF-36; MCS: componente psicologica del questionario SF-36**p<0.001 vs placebo
Miglioramento significativo della qualità di vita già dopo 2 somministrazioni sottocutanee 13

ACCEPT – Il primo studio di confronto diretto tra biologici nella psoriasi disegnato per superiorità15
• Obiettivo primario: confrontare l’efficacia di ustekinumabe di etanercept
• Gruppi di trattamento*:• Ustekinumab 45 mg, alle settimane 0 e 4• Ustekinumab 90 mg, alle settimane 0 e 4• Etanercept 50 mg, due volte alla settimana fino a 12 settimane
15. Griffiths C et al. N Engl J Med. 2010;362:118-28.
*confronto diretto tra ustekinumab ed etanercept nelle prime 12 settimane dello studio.

ACCEPTEndpoint principali
• Endpoint primario15
─ Percentuale di pazienti che hanno raggiunto una risposta PASI 75 alla settimana 12
• Endpoint secondari principali15
– Percentuale di pazienti con punteggio PGA di psoriasi eliminata (0) o minima (1) alla settimana 12
– Percentuale di pazienti con risposta PASI 90 alla settimana 12
15. Griffiths C et al. N Engl J Med. 2010;362:118-28.

ACCEPTCriteri di inclusione ed esclusione
Criteri di inclusione15
– Età ≥18 anni
– Diagnosi di psoriasi a placche da almeno 6 mesi
– PASI ≥ 12
– BSA ≥ 10%
– PGA ≥ 3
– Candidato per fototerapia o terapia sistemica
– Mancata risposta, controindicazione o intolleranza ad almeno una terapia sistemica convenzionale (metotrexate, ciclosporina o PUVA)
Criteri di esclusione15
– Forme di psoriasi non a placche o forme iatrogene
– Terapia con biologici entro 3 mesi o 5 emivite del farmaco dall’arroulamento
– Precedente trattamento con etanercept o ustekinumab
– Farmaci sistemici per la psoriasi o fototerapia entro 4 settimane dall’arruolamento
– Farmaci topici per la psoriasi entro 2 settimane dall’arruolamento
– Infezione seria recente o storia pregressa di infezioni croniche o ricorrenti.
– Neoplasia (eccetto tumore a cellule basali, tumore a cellule squamose o cancro cervicale in situ trattati e senza evidenza di recidiva almeno negli ultimi 5 anni)
15. Griffiths C et al. N Engl J Med. 2010;362:118-28.

ACCEPTStudio in doppio cieco vs controllo attivo 15
15. Griffiths C et al. N Engl J Med. 2010;362:118-28.

ACCEPT: Efficacia di ustekinumab statisticamente superiore ad etanercept dopo 12 settimane15
Paz
ien
ti (
%)
100
20
40
60
80
Etanercept(n=347)
PASI 75
56,8
67,5*
Ustekinumab45 mg(n=209)
73,8**
Ustekinumab90 mg(n=347)
0
N° di iniezioni 24 2 2
*p=0.01 per la superiorità vs etanercept; **p<0.001 per la superiorità vs etanercept
24 2 2
100
20
40
60
80
PASI 90
23,1
36,4**44,7**
0Etanercept
(n=347)Ustekinumab
45 mg(n=209)
Ustekinumab90 mg(n=347)
15. Griffiths C et al. N Engl J Med. 2010;362:118-28.

Etanercept (n=347)
100
80
40
20
Ustekinumab 45 mg (n=209)
Ustekinumab 90 mg(n=347)
Paz
ien
ti (
%)
60 49
65*71*
0
PGA psoriasi minima o eliminata
*p<0.001 per la superiorità vs etanercept
ACCEPT: Efficacia di ustekinumab statisticamente superiore ad etanercept dopo 12 settimane15
15. Griffiths C et al. N Engl J Med. 2010;362:118-28.

ACCEPT – Consistenza di risposta di ustekinumab ed etanercept negli studi clinici sulla psoriasi
16. Papp KA et al. Br J Dermatol. 2005; 152:1304-12; 8. Leonardi CL et al. Lancet. 2008;371:1665-74; 9. Papp K et al. Lancet. 2008;371:1675-84; 15 Griffiths C et al. N Engl J Med. 2010;362:118-28.
Paz
ien
ti (
%)
Risposte PASI 75 a 12 settimane
Etanercept 50 mg Ustekinumab 90 mgUstekinumab 45 mg
0
100
80
40
20
60
6874
57
ACCEPT15
100
80
40
20
60
67 66
PHOENIX 18
49
Papp K et al160
100
80
40
20
60
6776
PHOENIX 290
100
80
40
20
60

ACCEPT - Conclusioni
– Primo studio di confronto diretto, disegnato per superiorità, tra due farmaci biologici per il trattamento della psoriasi
– Alla settimana 12 ustekinumab 45 mg o 90 mg con 2 iniezioni, alle settimane 0 e 4, ha mostrato un’efficacia superiore ad etanercept 50 mg, due volte la settimana
– Ustekinumab ed etanercept sono risultati ben tollerati con profili di sicurezza simili nelle 12 settimane di confronto
– L’efficacia nello studio ACCEPT è paragonabile a quella osservata negli altri studi clinici su ustekinumab
15. Griffiths C et al. N Engl J Med. 2010;362:118-28.

AffidabilitàSicurezza e tollerabilità simili a placebo8,9
8. Leonardi CL et al. Lancet. 2008;371:1665-74. 9. Papp K et al. Lancet. 2008;371:1675-84.

Profilo di sicurezza simile a placebonel breve termine
PHOENIX 1 8
Eventi avversi (EA)fino alla settimana 12
Ustekinumab 45 mg
(n=255)
Ustekinumab 90 mg
(n=255)
Placebo(n=255)
Pazienti con ≥1 EA 147 (57,6%) 131 (51,4%) 123 (48,2%)
EA causa di interruzione del farmaco in studio 1 (0,4%) 4 (1,6%) 6 (2,4%)
EA Seri 2 (0,8%) 4 (1,6%) 2 (0,8%)
Infezioni 80 (31,4%) 66 (25,9%) 68 (26,7%)
Infezioni serie 0 (0%) 2 (0,8%) 1 (0,4%)
Neoplasie cutanee 0 (0%) 0 (0%) 0 (0%)
Neoplasie non-cutanee 0 (0%) 0 (0%) 0 (0%)
Eventi cardiovascolari 1 (0,4%) 0 (0%) 0 (0%)
8. Leonardi CL et al. Lancet. 2008;371:1665-74.
I dati sono espressi come numero di pazienti (%)

Profilo di sicurezza simile a placebonel breve termine
PHOENIX 1 8
Eventi avversi (EA) con frequenza 5% in uno qualunque dei gruppi fino alla settimana 12
Ustekinumab 45 mg
(n=255)
Ustekinumab 90 mg
(n=255)
Placebo(n=255)
Infezione delle vie respiratorie superiori 18 (7,1%) 16 (6,3%) 16 (6,3%)
Nasofaringite 26 (10,2%) 21 (8,2%) 22 (8,6%)
Artralgia 7 (2,7%) 6 (2,4%) 7 (2,7%)
Cefalea 14 (5,5%) 13 (5,1%) 6 (2,4%)
Tosse
Eritema nel sito di iniezione
I dati sono espressi come numero di pazienti (%)
8. Leonardi CL et al. Lancet. 2008;371:1665-74.

Profilo di sicurezza simile a placebonel breve termine
PHOENIX 2 9
Eventi avversi (EA)fino alla settimana 12
Ustekinumab 45 mg
(n=409)
Ustekinumab 90 mg
(n=411)
Placebo(n=410)
Pazienti con ≥1 EA 217 (53,1%) 197 (47,9%) 204 (49,8%)
EA causa di interruzione del farmaco in studio 1 (0,2%) 6 (1,5%) 8 (2,0%)
EA Seri 8 (2,0%) 5 (1,2%) 8 (2,0%)
Infezioni 88 (21,5%) 92 (22,4%) 82 (20,0%)
Infezioni serie 0 (0%) 1 (0,2%) 2 (0,5%)
Neoplasie cutanee 0 (0%) 1 (0,2%) 1 (0,2%)
Neoplasie non-cutanee 0 (0%) 0 (0%) 1 (0,2%)
Eventi cardiovascolari 0 (0%) 1 (0,2%) 0 (0%)
I dati sono espressi come numero di pazienti (%)
9. Papp K et al. Lancet. 2008;371:1675-84.

Profilo di sicurezza simile a placebonel breve termine
PHOENIX 2 9
Eventi avversi (EA) con frequenza 5% in uno qualunque dei gruppi fino alla settimana 12
Ustekinumab 45 mg
(n=409)
Ustekinumab 90 mg
(n=411)
Placebo(n=410)
Infezione delle vie respiratorie superiori 18 (4,4%) 12 (2,9%) 14 (3,4%)
Nasofaringite 30 (7,3%) 28 (6,8%) 29 (7,1%)
Artralgia 14 (3,4%) 10 (2,4%) 12 (2,9%)
Cefalea 19 (4,6%) 19 (4,6%) 17 (4,1%)
Tosse 3 (0,7%) 4 (1,0%) 7 (1,7%)
Eritema nel sito di iniezione 6 (1,5%) 6 (1,5%) 1 (0,2%)
I dati sono espressi come numero di pazienti (%)
9. Papp K et al. Lancet. 2008;371:1675-84.

ACCEPTEventi avversi fino a 12 settimane
15. Griffiths C et al. N Engl J Med. 2010;362:118-28.
Ustekinumab
Etanercept 45 mg 90 mg
Pazienti trattati, n° 347 209 347
Durata media del follow-up, n° di settimane 12,1 12,1 12,2
Esposizione media, n° di somministrazioni 23,2 2,0 2,0
Reazioni al sito di iniezione, n° (%) 86 (24,8%) 9 (4,3%) 13 (3,7%)
Pazienti con ≥1 EA, n° (%) 243 (70,0%) 138 (66,0%) 240 (69,2%)
EA seri, n° (%) 4 (1,2%) 4 (1,9%) 4 (1,2%)
EA causa di interruzione del trattamento, n° (%) 8 (2,3%) 4 (1,9%) 4 (1,2%)
Infezioni, n° (%) 101 (29,1%) 64 (30,6%) 103 (29,7%)
Infezioni che richiedono trattamento, n° (%) 34 (9,8%) 18 (8,6%) 33 (9,5%)
Neoplasie, n° (%)
- NMSC 0 (0%) 2 (1,0%) 1 (0,3%)
- Altre neoplasie 0 (0%) 1 (0,5%) 0 (0%)
NMSC: tumore cutaneo non melanoma

8. Leonardi CL et al. Lancet. 2008;371:1665-74.
Eventi avversi durante la terapia a lungo termine (settimane 40–76)
Terapia di mantenimento (ustekinumab)
(n=161)
Terapia interrotta (Placebo) (n=160)
Pazienti con uno o più eventi avversi (EA) 108 (67,1%) 121 (75,6%)
EA comuni*:
- Infezione delle vie respiratorie superiori 22 (13,7%) 21 (13,1%)
- Nasofaringite 16 (9,9%) 17 (10,6%)
- Artralgia 3 (1,9%) 12 (7,5%)
- Cefalea 6 (3,7%) 4 (2,5%)
EA causa di interruzione del trattamento 3 (1,9%) 3 (1,9%)
EA seri 1 (0,6%) 7 (4,4%)
EA di particolare interesse:
- Infezioni 71 (44,1%) 76 (47,5%)
- Infezioni serie 0 (0%) 2 (1,3%)
- Carcinomi cutanei 2 (1,2%) 0 (0%)
- Neoplasie non-cutanee 0 (0%) 1 (0,6%)
- Eventi cardiovascolari 0 (0%) 0 (0%)
Profilo di sicurezza simile a placebo nel lungo termine
I dati sono espressi come numero di pazienti (%)
*EA occorsi in almeno il 5% dei pazienti di uno qualunque dei gruppi di trattamento

Una terapia ben tollerata
PHOENIX 18 PHOENIX 29
Anticorpi anti-ustekinumab:
Pazienti con anticorpi 5,1% (38/746) 5,4% (65/1202)
Titolo Basso (<1/320) Non disponibile
Reazioni nel sito di iniezione:
Ustekinumab0,7% (32/4559)Lieve (32/32)
1% (56/5632) Lieve (55/56)
Placebo 0,23% (37/16,063) 0,4% (67/14,919)
Reazioni anafilattiche o malattia da siero
Nessuna Nessuna
8. Leonardi CL et al. Lancet. 2008;371:1665-74. 9. Papp K et al. Lancet. 2008;371:1675-84.

17. Gordon K et al. Poster presented at EADV, Oct 7-11, 2009, Berlin. P1170.
Profilo di sicurezza a 3 anni: il rischio di infezioni è basso e stabile nel tempo17
Ustekinumab 45 mg Ustekinumab 90 mg
0,0
3,0
1,0
2,0
Ustekinumab combinato
N 732 790 792 1582 1110 1156 2266 1319 1906 3117
Anni-paziente 177 203 203 406 1113 1138 2251 2184 2598 4782
# di eventi 3 1 4 5 12 12 24 18 39 57
1.19(0.90, 1.64)
1.50(0.07, 2.05)
0.82(0.49, 1.30)
1.07(0.68, 1.59)
1.05(0.54, 1.84)
1.08(0.56, 1.88)
1.23 (0.40, 2.97)
0.49(0.01, 2.75)
1.70 (0.35, 4.96)
1.97 (0.54,5.03)
Placebo
1,5 anni 3 anniPeriodo controllato
Inci
den
za p
er 1
00 A
-p
(IC
95%
)
Infezioni serie

17. Gordon K et al. Poster presented at EADV, Oct 7-11, 2009, Berlin. P1170.
Profilo di sicurezza a 3 anni: il rischio di infezioni è basso e stabile nel tempo17
N 732 790 792 1582 1110 1156 2266 1319 1906 3117
Anni-paziente 177 203 203 406 1113 1138 2251 2184 2598 4782
Ustekinumab 45 mg Ustekinumab 90 mg Ustekinumab combinatoPlacebo
Infezioni che hanno richiesto terapia antinfettiva
0
30
10
20
34.834.736.637.238.137.4
38.8
1,5 anni 3 anniPeriodo controllato
Inci
den
za p
er 1
00 A
-p
4036.2 36.0 34.9

Ustekinumab 45 mg Ustekinumab 90 mg
0,0
3,0
1,0
2,0
Ustekinumab combinato
N 732 790 792 1582 1110 1156 2266 1319 1906 3117
Anni-paziente 177 203 203 406 1111 1134 2245 2178 2591 4769
# di eventi 2 1 2 3 7 11 18 14 20 34
0.71(0.49, 1.00)
0.77(0.47, 1.19)0.64
(0.35, 1.08)
0.80(0.48, 1.27)
0.97(0.48, 1.74)
0.63(0.25, 1.30)
0.74 (0.15, 2.16)0.49
(0.01, 2.75)
1.13 (0.14, 4.09) 0.98
(0.12, 3.55)
Placebo
Profilo di sicurezza a 3 anni: il rischio di carcinoma cutaneo non melanoma (NMSC) è basso e stabile nel tempo17
1,5 anni 3 anniPeriodo controllato
Inci
den
za p
er 1
00 A
-p
(IC
95%
)
17. Gordon K et al. Poster presented at EADV, Oct 7-11, 2009, Berlin. P1170.

Ustekinumab 45 mg Ustekinumab 90 mg
0,0
3,0
1,0
2,0
Ustekinumab combinato
N 732 790 792 1582 1110 1156 2266 1319 1906 3117
Anni-paziente 177 203 203 406 1111 1138 2249 2180 2594 4774
# di eventi 1 1 0 1 7 1 8 15 12 27
0.57(0.37, 0.82)0.46
(0.24, 0.81)
0.69(0.39, 1.13)
0.36(0.15, 0.70)0.09
(0.00, 0.49)
0.63(0.25, 1.30)
0.25(0.01, 1.37)
0.49(0.01, 2.75)
0.57(0.01, 3.15)
0.00 (0.00, 1.47)
Placebo
I tassi di neoplasie non NMSC in 3 anni sono stati in linea con quelli attesi nella popolazione generale del database SEER
(che copre circa il 26% della popolazione statunitense) SIR (IC 95%)= 1.05 (0.69-1.53)
Profilo di sicurezza a 3 anni: il rischio di altre neoplasie è basso e stabile nel tempo17
Inci
den
za p
er 1
00 A
-p
(IC
95%
)
1,5 anni 3 anniPeriodo controllato
17. Gordon K et al. Poster presented at EADV, Oct 7-11, 2009, Berlin. P1170.

Ustekinumab 45 mg Ustekinumab 90 mg
0,01,5 anni 3 anni
3,0
1,0
2,0
Ustekinumab combinato
N 732 790 792 1582 732 1110 1156 2266 1319 1906 3117
Anni-paziente 177 203 203 406 182 1113 1138 2251 2184 2598 4782
# di eventi 0 2 3 5 1 6 4 10 9 9 18
0.38(0.22, 0.59)0.35
(0.16, 0.66)
0.41 (0.19, 0.78)
0.44 (0.21, 0.82)
0.35 (0.10, 0.90)
0.54 (0.20, 1.17)
1.23 (0.40, 2.87)0.98
(0.12, 3.56)
0.00 (0.00, 1.69)
1.47 (0.30, 4.31)
Incid
en
za p
er
100
A-p
(IC
95
%)
Periodo controllato
Placebo
* IM, ictus e morte CV
0.55 (0.01, 3.06)
I tassi di IM e ictus erano simili o inferiori a quelli attesi nella popolazione generale del database Framingham
– SIR (IC 95%)=0.52 (0.31-0.84)
Profilo di sicurezza a 3 anni: il rischio di eventi avversi cardiovascolari maggiori* è basso e stabile nel tempo17
17. Gordon K et al. Poster presented at EADV, Oct 7-11, 2009, Berlin. P1170.

Parametri di laboratorio: analisi integrata della sicurezza
Nessun impatto di Ustekinumab sui parametri delle analisi di routine18
Emocromo completo inclusa formula leucocitaria Ematochimica: elettroliti, funzionalità epatica e renale
Nessuna variazione sostanziale nei seguenti parametri: 18,19
Livelli sierici di TN alfa e altre citochine Percentuale di linfociti T (CLA) (antigene linfocitario cutaneo) Risposta Th1/Th2 a stimoli esterni
18. Disponibile su: http://www.fda.gov/ohrms/dockets/ac/08/briefing/2008-4361b1-02-CENTOCOR.pdf 19. Reddy M et al. J Dermatol 2010; 37:413-425

Risposta ai vaccini: analisi integrata della sicurezza20
Nessun impatto sulla risposta al vaccino antitetanico e a Pneumovax (Fase 1)
Tossicologia nei primati: Risposta normale alla risposta vaccinale cellule T-dipendente nei primati (KLH)
20. Brodmerkel C et al., J Drugs Dermatol 2010; 9 (6): 677-683
Dep
osi
tato
pre
sso
AIF
A i
n d
ata
03/0
9/20
10

PraticitàSolo 1 dose ogni 12 settimane*
* dopo 2 dosi di induzione

Minimizza il tempo impiegato per assumere la terapia21
Dopo 2 dosi iniziali, le iniezioni sottocutanee di Stelara®
si somministrano ogni 12 settimane21
La posologia raccomandata di STELARA è una dose iniziale di 45 mg somministrata per via sottocutanea alla settimana 0, seguita da una dose di 45 mg alla settimana 4 e, successivamente, ogni 12 settimane. In pazienti con un peso superiore a 100 kg la dose da somministrare è di 90 mg per via sottocutanea alla settimana 0, seguiti da una dose di 90 mg alla settimana 4 e, successivamente, ogni 12 settimane. È stato dimostrato che la dose di 45 mg è efficace anche in pazienti con un peso >100 kg. Tuttavia, per questa categoria di pazienti, la dose di 90 mg ha evidenziato una maggiore efficacia 21
21. Stelara® Riassunto delle caratteritiche del prodotto
Dose aggiustata in baseal peso corporeo21
Gennaio Febbraio Marzo Aprile
Maggio Giugno Luglio Agosto
Settembre Ottobre Novembre Dicembre
Inizio della terapia*Peso del paziente
Dose di Stelara®
raccomandata
≤100kg 45 mg
>100kg 90 mg
Dose di mantenimento (ogni 12 settimane)