Valutazione della sicurezza biologica dei dispositivi medici · diverse funzioni cellulari...
Transcript of Valutazione della sicurezza biologica dei dispositivi medici · diverse funzioni cellulari...

Valutazione della sicurezza biologica dei sicurezza biologica dei
dispositivi medici

Il ciclo di vita dei dispositivi medici

Progettazione di un organo artificiale
Livello 1(cellule/materiali)
Livello 2(tessuti/componenti)
Livello 3(organo naturale/artif.)
Fase di identificazione dell’organo naturale
Identificazione e
caratterizzazione chimico/fisica
delle cellule
Identificazione e
caratterizzazione
morfologica e funzionale dei
tessuti
Identificazione e
caratterizzazione
morfologica e funzionale
dell’organo
Fase di progettazione
Scelta dei materiali Definizione funzionale e
disegno dei componenti
Definizione delle modalità di
assemblaggio e di progettazione dell’organo artificiale
interfaccia dei componenti
Fase di verifica Caratterizzazione
chimico/fisica dei materiali
Prove funzionali dei
componenti
Realizzazione del prototipo,
prove funzionali in vitro e in
vivo
Fase di realizzazione
Produzione industriale
Fase di utilizzazione
Uso clinico definitivo

• La caratterizzazione dei biomateriali e dei dispositivi destinati ad un contattocon l’organismo a medio e lungo termine (fluidi biologici, tessuti e organi) nonpuò essere completa senza una valutazione circa la loro risposta biologica.
• Questa valutazione va condotta allo scopo di esaminare le prestazioni delbiomateriale in condizioni simili a quelle dell’ambiente biologico.
• La biocompatibilità dei dispositivi, e quindi quella dei loro componenti, deveessere acquisita con certezza (testata e documentata) e poi approvata dagliorganismi deputati (per esempio, FDA, marchio CE, etc.) prima dellacommercializzazione e dell’utilizzo in ambito clinico.
Introduzione
commercializzazione e dell’utilizzo in ambito clinico.
• Questo è quanto prescritto dalle leggi nazionali ed internazionali che, ingenerale, richiedono la prova della sicurezza ed efficacia nell’utilizzo deidispositivi medici in condizioni di lavoro realistiche.
• La valutazione della biocompatibilità viene di norma condotta all’interno dicentri di ricerca accreditati, seguendo ben precise procedure e standard,facendo ricorso a strumentazione particolare e a personale adeguatamenteaddestrato: di fatto, queste condizioni fanno sì che le valutazioni dibiocompatibilità esulino dalle possibilità economiche e dalle priorità scientifichedei gruppi di ricerca e delle imprese di medio-piccole dimensioni.

La normativa ISO 10993
Oggi: 18 parti
Quasi tutte le parti sonostate rielaborate eriemesse nel 2009(sostituzione completaentro il 2010)

Norme specifiche

Quali sono gli aspetti critici?

Dal punto di vista pratico, la valutazione della sicurezza biologica di unmateriale e/o di un dispositivo si realizza mediante una serie di prove checomprendono:
1. test in vitro (con cellule e tessuti)
2. test in vivo (quando siano applicabili)
3. test su modello animale e trials clinici.
A questo scopo, sono già state sviluppate ed adottate specifiche linee guida e
Valutazione della biocompatibilità
A questo scopo, sono già state sviluppate ed adottate specifiche linee guida especifiche procedure; le informazioni relative sono conservate pressoorganizzazioni ed agenzie nazionali ed internazionali che si occupano distandardizzazione (ASTM*, ISO, FDA, NIH).

ISO 10993-1

Valutazione della biocompatibilità

Dispositivo medico vs. farmaco
Il grado di compliance delpaziente è il grado di adesionedel paziente stesso a tutte leprescrizioni del suo medico edefinisce la sua volontà dicollaborazione con le strutturecollaborazione con le strutturesanitarie. In questa suaaccezione assume in manieraeccessiva la dimensione di virtù,di idealità, di mito fine a sestesso, quindi, ancora, di un rito,essendo soltanto l’espressione diuna disciplinata obbedienza.Oppure di una non semprebenevola e benefica complicità.

Valutazione della biocompatibilità
Rilevazione non a contatto e a distanza del battito
cardiaco (Vibrocardiografia)

Valutazione della biocompatibilità

Valutazione della biocompatibilità
Reazione del sistema immunitarioIRREVERSIBILE
Cessa quando l’agente irritante è rimossoREVERSIBILE

Valutazione della biocompatibilità

Valutazione della biocompatibilità


La caratterizzazione chimico-fisica (in superficie e nel complesso) e dellealtre proprietà specifiche (per esempio, elettriche, meccaniche, di trasporto, edeventualmente di biodegradazione) va condotta sulle materie prime
La caratterizzazione in vitro (con tessuti viventi) dei materiali e delleprestazioni dei prototipi di dispositivi biomedici è necessariamente preliminarealla valutazione della loro biocompatibilità.
Questi dati vanno comparati con i risultati che si hanno al termine di ogni fasedel processo produttivo (manifattura, sterilizzazione, confezionamento,
Valutazione della biocompatibilità
del processo produttivo (manifattura, sterilizzazione, confezionamento,stoccaggio) che può inficiare la stabilità del dispositivo e comprometterne lasicurezza e l’efficacia di impiego.
La verifica della biocompatibilità viene eseguita sui soli dispositivi cheabbiano superato queste prove preliminari.
I principali vantaggi dei test in vitro sono legati ai costi contenuti, alle piccoledimensioni delle apparecchiature richieste e alla relativa velocità di esecuzioneche permette di valutare rapidamente, e confrontare, molti materiali e moltidispositivi.

Test “in vitro”
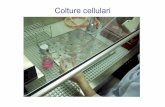
Colture cellulari
o Si disseziona il tessutoo Si taglia finementeo Si estraggono le cellule
19
o Si estraggono le celluleo Si pongono le cellule in coltura con
opportuni nutrienti tenendole al caldo

• I progressi nelle colture cellulari hanno fornito modelli in vitrodi eccezionale versatilità e utilità al fine di valutare i diversiaspetti connessi con la biocompatibilità dei materiali e deidispositivi in relazione al processo di guarigione delle ferite.
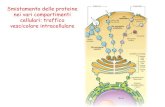
• Si possono ad esempio utilizzare cellule di mammiferoprelevate dai tessuti/organi con i quali i materiali e i dispositiviandranno posti a contatto: si possono così determinare lediverse funzioni cellulari (adesione, migrazione,proliferazione, etc.) sui materiali da testare.
• A seconda delle applicazioni, si possono ricercare materialiche favoriscono o impediscono l’adesione delle proteine
Test “in vitro”
che favoriscono o impediscono l’adesione delle proteinee la conseguente adesione delle cellule.
• Se si desidera che il materiale/dispositivo generi una forteinterazione con i tessuti circostanti o consenta la crescita dinuovo tessuto, allora si ammetteranno i soli materiali capacidi favorire l’adesione di cellule specifiche e/o di minimizzarel’interazione con cellule di altri tessuti.
• I test in vitro con cellule di mammifero sono anche utilizzatiper verificare, in condizioni analoghe a quelle fisiologiche, glieffetti del rilascio di sostanze chimiche: ad esempio, il tipoe la concentrazione degli ioni che vengono rilasciati durantela corrosione di materiali metallici, o le macromolecole e imonomeri che si formano per degradazione di materialipolimerici.

I test in vitro sono attualmente considerati efficaciper una valutazione preliminare dellabiocompatibilità dei materiali.
Come per qualsiasi altro modello, anche in questocaso va prestata parecchia attenzionenell’interpretare i risultati, evitando rischioseestrapolazioni.
Senza dubbio, i modelli servono a studiare le
Test “in vitro”
Senza dubbio, i modelli servono a studiare lefunzioni e i meccanismi di una singola lineacellulare alla volta; questo comporta deglievidenti limiti in considerazione della notevolecomplessità reale dell’ambiente biologico.
Per queste ragioni, i dati dei test in vitro vannointegrati con i risultati che si devono ottenereattraverso studi su modelli animali per fornireuna spiegazione più adeguata dei meccanismi chedirigono, mediano e controllano le interazioni tramateriali e tessuti, in un ambiente che è di per séestremamente complesso, interattivo e dinamico.

Definizione: metodo di valutazione dei danni biologici acuti provocati dalle
sostanze rilasciate dai dispositivi medici tramite l’osservazione degli effetti che
queste producono su cellule di mammifero coltivate in vitro su un mezzo
nutriente.
Esistono due test di citotossicità alternativi basati:
• su un estratto (metodo di eluizione)
Gli estratti ottenuti dal materiale da esaminare e da uno di riferimento, vengonoutilizzati come nuovo nutriente delle colture cellulari.
Test di citotossicità
utilizzati come nuovo nutriente delle colture cellulari.
I monostrati cellulari vengono quindi osservati al microscopio per scoprirel’insorgere nel tempo di eventuali segnali di un’azione tossica (cambiamentinelle dimensioni o nell’aspetto dei componenti cellulari, lisi cellulare, ecc.).
• sull’utilizzo diretto del materiale.
Il campione da esaminare e il confronto vengono direttamente posti nellacoltura cellulare.

Test di citotossicità
• Contatto diretto
– Si crea un singolo strato di cellule di topo L-929
– si pone il materiale a direttocontatto
– 24 ore, 37°C– Le cellule possono:
• Cambiare la loro morfologia• Cambiare la loro morfologia• Morire• Perdere aderenza con la capsula
• Perchè proprio le L-929?
– Facili da conservare– Buona correlazione con i test in
vivo– Si tratta di cellule presenti nei
processi di riparazione delle ferite
Biomaterial

Test di citotossicità

Test di citotossicità
Fibroblasti: Cellule del tessuto connettivo che danno originealle fibre della matrice del tessuto (in questo caso cute)

Modelli animali
Questi modelli sono ovviamente utilizzati per verificare labiocompatibilità dei materiali e dei dispositivi in vivo equindi prevedono un’interazione diretta tra il dispositivo el’organismo vivente
Risultati negativi rendono del tutto inaccettabile ilsistema testato.
Purtroppo, risultati positivi non necessariamente provanola compatibilità sull’uomo: infatti, come è noto, differenzenelle specie animali possono invalidare l’estrapolazionedegli esiti delle prove in vivo fra modelli diversi.degli esiti delle prove in vivo fra modelli diversi.
In virtù della loro omologia con l’uomo, sono i primatinon umani i modelli animali più attendibili.
L’utilizzo di animali in laboratorio per la ricerca e per leprove di biocompatibilità implica una granderesponsabilità e dovrebbe essere preso in considerazionesolo dopo una completa caratterizzazione preliminare deimateriali/dispositivi, dopo adeguate simulazioni alcomputer ed esauriente verifica in vitro.
Di fondamentale importanza è da un lato la necessità diprovvedere alla salute umana, ma anche di evitare aglianimali l’esposizione a sofferenze non necessarie.

Modelli animali
l test su animali utilizzati per la valutazione della sicurezza biologica dei dispositivipossono essere suddivisi in tre principali categorie:
• test non funzionali
In questo caso, campioni di forma arbitraria sono impiantati nei tessuti molli (per esempio, per sotto cute,nel muscolo, nella cavità peritoneale) mediante interventi chirurgici poco invasivi.
Questi test hanno breve durata (giorni o alcune settimane) ma forniscono significative informazioni circa leinterazioni locali tra materiale e tessuto e le eventuali complicanze sistemiche.
I dati sono raccolti in assenza di carichi meccanici e mancano di ogni valutazione circa la funzionalità dellaprotesi.protesi.
• test ex vivo
Si realizzano derivazioni arteria-vena e vena-vena che permettono al sangue dell’animale di fluireattraverso i materiali da testare in un loop esterno.
In questo caso si valutano l’accumulo di proteine, l’adesione delle piastrine, la formazione di coaguli, alloscopo di verificare la compatibilità del materiale con il sangue.
• test funzionali
In questo caso si inserisce nell’animale il dispositivo, in scala appropriata, da testare: ad esempio, unaprotesi d’anca o una valvola cardiaca opportunamente dimensionate, per svolgere la funzione previstanell’animale in condizioni analoghe a quelle previste per l’impiego nell’uomo.
Si tratta di studi a lungo termine che richiedono speciali progettazioni e risultano pertanto assai costosi ecomplessi.

Test di sensibilizzazione
La sensibilizzazione è uno dei possibili tipi di “reazionedi ipersensibilità”. Esse si concretizzano in una rispostaimmunitaria dannosa che provoca alterazioni tessutalie può causare graviNell'ambiente in cui viviamo si trovano numerose sostanze in grado distimolare il nostro sistema immunitario. Il contatto con questi antigeni,porta ad una risposta immune protettiva, ma anche a reazioni chepossono risultare dannose per i tessuti conosciute appunto come reazionidi ipersensibilità.
Descrizione: metodo di osservazione su cavie
dell’insorgere di reazioni di sensibilizzazione indell’insorgere di reazioni di sensibilizzazione in
conseguenza dell’azione ripetuta e prolungata di
sostanze rilasciate capaci di interagire con il sistema
immunitario.
Il test viene effettuati sulla pelle di cavie (tipicamenteporcellini d’India, Guinea Pig). La reazione disensibilizzazione si manifesta come arrossamento erigonfiamento dei tessuti.
Vi sono due modi alternativi di condurre il test disensibilizzazione:
• Test di Buehler
• Test massimizzazione o di Magnuson-Kligman.Reazione di sensibilizzazione all’uso
ripetuto di guanti di lattice

Test di Buehler
Molto usato per dispositivi che devono andare acontatto con la pelle quali elettrodi e teli chirurgici
Il test si articola in tre fasi:
1. fase di “induzione” nel corso della quale ilmateriale da saggiare viene posto, inconcentrazioni variabili, direttamente a contattocon la pelle rasata del dorso di porcellini d’India etenuto in sede mediante bendaggi occlusivi 6ore/giorno, 3 giorni/settimana, 3 settimane
2. fase di recupero (periodo di riposo di duesettimane per permettere il manifestarsi di unarisposta nella cavia)
3. fase di applicazione scatenante, che prevede lasomminstrazione dell’intero campione di prova inuna sola applicazione su un’area sulla quale nonsono ancora state eseguite prove
Le concentrazioni alle quali preparare le compresse,si definiscono mediante prove preliminari anche inbase al tipo di contatto che si prevede di avere nellarealtà clinica

Test massimizzazione o di Magnuson-Kligman
Impiegato in particolar modo per testare materiali che saranno posti a contatto conaltre aree del corpo oltre la pelle.
Prevede l’applicazione ripetuta, a gruppi separati di porcellini d’India, di estratti delmateriale da testare emulsionati con soluzioni saline od olii secondo tre fasi
1. Fase di induzione intradermica (iniezioni)
2. Fase di riposo (due settimane)
3. Fase di applicazione scatenante (estratto puro)
Questo tipo di test serve a simulare l’estrazione da parte dei fluidi corporei dei liquidiQuesto tipo di test serve a simulare l’estrazione da parte dei fluidi corporei dei liquidiintravenosi e di eventuali prodotti farmaceutici che possono venire in contatto prima con ildispositivo e poi con il paziente, ma presentano molti limiti nel caso di sostanze chimiche:
• solo debolmente sensibilizzanti;
• che agiscono come coadiuvanti, sono cioè capaci di aumentare la risposta immunitariadi altre sostanze alle quali il paziente può essere esposto.

Test di irritazione
Secondo la norma ISO 10993-10 si definisceirritazione una risposta infiammatoria locale adapplicazioni singole, ripetute e continue dellasostanza in prova, senza che sia coinvolto unmeccanismo immunitario
Sintomi tipici dell’irritazione sono arrossamento,gonfiore e riscaldamento e dolore.
Il test utilizza estratti del materiale emulsionati confluidi salini o in olio vegetale o direttamente ilfluidi salini o in olio vegetale o direttamente ilmateriale in esame e l’applicazione del campioneavviene generalmente a livello intracutaneo, ooculare.
Nel primo caso si inietta per via intracutanea l’estrattodal materiale in punti multipli della pelle rasata diconigli albini, mentre nel caso oculare si instillanopiccole quantità (0.1 ml) di liquido non diluito.
Trascorse 24, 48 e 72 ore si va ad osservarel’eventuale insorgenza dei sintomi di arrossamento egonfiore nelle zone interessate dalle iniezioni.

Test di impianto
La norma ISO 10993-6 (“Prove per gli effetti
locali dopo l’Impianto”) fornisce indicazioni:
• sulla specie animale da impiegare come cavia;
• sul tipo di tessuto più adatto all’impianto;
• su quanto tempo il materiale deve rimanereimpiantato;
• sul metodo d’impianto; Risposta minima
• sulla valutazione della risposta biologica.
L’applicazione generale di questi test prevede iltaglio del materiale in un campione della formadesiderata, la sterilizzazione di tale campione e ilsuo impianto in condizioni asettiche.Successivamente si procede ad esaminare itessuti circostanti il luogo dell’impianto dopo unperiodo variabile tra una settimana e alcuni mesi.
Il test di impianto più diffusamente impiegato èquello che utilizza come cavie conigli e interessail muscolo paralombare.
Risposta severa

Trials clinici
A prescindere dal successo dei precedenti test in vitroe su modello animale, non è possibile prevedere leprestazioni di materiali e dispositivi sull’uomosenza trials clinici.
La sperimentazione clinica è necessaria prima direndere disponibile al pubblico il materiale/dispositivo.
Inoltre, in aggiunta alle valutazioni legate alleprocedure e ai metodi di ordine scientifico, lasperimentazione clinica deve sottostare a limitazionidi ordine normativo.di ordine normativo.
Prerequisito per richiedere alle agenzie nazionali edinternazionali (per esempio, FDA o Ministero dellaSalute) l’autorizzazione alla sperimentazione clinica, èil documentare con precisione e chiarezza gli esitipositivi della precedente sperimentazione (in vitro, exvivo e in vivo). Va poi data prova dei benefici per iriceventi e dell’assenza di rischi.
Inoltre, devono essere descritti nel dettaglio: ilmateriale/dispositivo, la procedura chirurgica, iltrattamento post-operatorio, e il tipo di valutazioneattesa.

Trials clinici
La valutazione può riguardare il confronto tra le condizioni del paziente prima edopo l’applicazione del materiale/dispositivo, oppure il confronto con altrisoggetti sani di un gruppo di controllo scelto adeguatamente per sesso, età,salute.
I protocolli sperimentali sono sottoposti al giudizio degli organismi deputati la cuiapprovazione assicura il rispetto non solo delle leggi vigenti, ma anche dei diritti edella dignità dei pazienti che si sottopongono alla sperimentazione fornendo illoro consenso informato.
Una volta approvata, la sperimentazione prevede di inserire ilUna volta approvata, la sperimentazione prevede di inserire ilmateriale/dispositivo in un certo numero di soggetti come parte di uno studio,limitato ma ben controllato e monitorato, finalizzato allo svolgimento di unasequenza di tre fasi (I, II e III).
È evidente che non si possono trascurare alcune considerazioni di ordine etico,legate ai criteri con i quali scegliere se un paziente potrà o no ricevere undispositivo che potrebbe salvare, migliorare e/o prolungare la sua vita.
Gli esiti della sperimentazione con l’indicazione dei risultati, dei dati di follow-up,dei dati quantitativi e delle discussioni circa il significato delle conclusioni, devonoessere presentati all’organismo notificato che avrà la responsabilità dellaapprovazione finale prima della commercializzazione.

Trials clinici (esempio farmaci)

Fallimento, recupero e valutazione di un impianto
In alcuni casi, le complicazioni che insorgono possono condurre al fallimentodell’impianto, con conseguente dolore e disagio oltre alla eventuale comparsa diinfezione e di sintomi che minacciano complessivamente lo stato di salute delpaziente.
A questo punto, si rende necessaria la rimozione del materiale o del dispositivomediante un nuovo intervento chirurgico.
Informazioni importanti possono essere ricavate anche dal recupero degliimpianti e delle protesi, e dei tessuti circostanti, dai pazienti al termine dellaimpianti e delle protesi, e dei tessuti circostanti, dai pazienti al termine dellaloro vita.
Va ricordato che la progettazione dei materiali e dei dispositivi è basata su datifisiologici di individui sani e normali, mentre nella maggior parte dei casi coloroche li ricevono sono persone anziane e/o malate.
È impossibile prevedere le prestazioni di materiali e dispositivi nella enormevarietà di possibili condizioni di impiego reale.

Fallimento, recupero e valutazione di un impianto
L’esame dei materiali espiantati fornisce utilievidenze circa la loro sicurezza ed efficacia. Nonsolo, ma lo studio degli impianti falliti permette dideterminare le cause del fallimento.
Queste informazioni potrebbero essere cruciali permigliorare la progettazione e la fabbricazione, perstabilire criteri di selezione, per sviluppareprotocolli e tecniche per le diverse fasi dellavalutazione degli impianti.valutazione degli impianti.
L’esame dei materiali espiantati può anchepermettere di aumentare la conoscenza deimeccanismi di interazione tra materiali e tessutibiologici.