Unità didattica: Forze intermolecolari – legame a idrogeno Classe: III Scuola: Liceo Scientifico
-
Upload
carter-carpenter -
Category
Documents
-
view
36 -
download
4
description
Transcript of Unità didattica: Forze intermolecolari – legame a idrogeno Classe: III Scuola: Liceo Scientifico

Unità didattica:
Forze intermolecolari –
legame a idrogeno
Classe: III
Scuola: Liceo Scientifico

Legami intermolecolari•Sono legami che si formano tra atomi appartenenti a molecole differenti da evidenziare la differenza con i legami intramolecolari, che si formano tra atomi appartenenti alla stessa molecola o ad un unico reticolo cristallino
•Sono forze di natura elettrostatica
•Impediscono alle molecole di una sostanza di essere indipendenti tra di loro: senza di essi non esisterebbero sostanze molecolari allo stato solido, come lo zucchero, o liquido, come l’acqua perché le singole molecole si allontanerebbero le une dalle altre come nei gas rarefatti
•Sono considerati legami deboli se confrontati con i legami intramolecolari, definiti legami forti
•I legami intermolecolari si suddividono in:
forze dipolo-dipolo
forze di dispersione (tra molecole non polari)
legame idrogeno

Tipi di interazioni Energia di legame (KJ/mol)
a) Legame ionico
b) Legame covalente
100 - 1000
100 - 1000
Interazioni intermolecolari:
a) Forze dipolo-dipolo forze di 1 - 10
b) Forze dipolo indotto- van der Waals 0.1 - 1
dipolo indotto (forze di London)
c) Legame a idrogeno 10 - 40
Valori delle energie di legame
Energia necessaria per rompere un numero di Avogadro di legami di un certo tipo (presenti in una mole di una
sostanza in fase gassosa)
Interazioni intramolecolari:
Legami
forti
Legami
deboli

Interazioni dipolo - dipolo (forze di orientazione)
Sono attrazioni elettrostatiche che si originano tra le parti parzialmente positive (δ+) e le parti parzialmente negative (δ-) di molecole polari contigue (dipoli permanenti)
Si forma una rete di interazioni a corto raggio (cioè significative solo tra molecole molto ravvicinate)
Una molecola polare può indurre un dipolo in una molecola non polare; anche un’attrazione di questo tipo è significativa solo per molecole molte ravvicinate (1/r7)
Interazioni dipolo – dipolo indotto

Interazioni dipolo indotto – dipolo indotto (forze di London)
Legame tra molecole non polari; avviene quando una molecola apolare, per un istante, diventa polare (dipolo temporaneo)
•Il moto degli elettroni è disordinato e casuale e si può creare una asimmetria nella nuvole elettronica della molecola
•Nella frazione infinitesima di tempo in cui esiste, il dipolo temporaneo induce la polarizzazione di una molecola contigua (dipolo indotto), poiché respinge o attrae i suoi elettroni
Sono interazioni molto deboli e hanno durata brevissima ma si formano continuamente tra le molecole e permettono a molti gas e ai gas nobili di liquefare (a basse T o alte P). Esempio: H2, O2, CO2, N2, F2, Cl4C

•Le sostanze con molecole polari possiedono punti di fusione e di ebollizione più alti rispetto alle sostanze costituite da molecole non polari; pertanto, sono spesso solide o liquide a temperatura ambiente. Es: acetone (polare) = pb 56.2 °C; 2-metilpropano (apolare) = pb -11.7 °C
•Negli idrocarburi il punto di fusione e di ebollizione aumenta all’aumentare degli atomi di C aumentano le dimensioni molecolari e perciò gli elettroni di valenza possono essere più facilmente spostati e danno un maggior contributo alla polarizzabilità maggiori sono le forze di London
•Anche la forma della molecola gioca un ruolo nel determinare l’entità delle forze intermolecolari più le molecole sono allungate e sottili, più si possono avvicinare, aumentano i punti di contatto e quindi le forze intermolecolari
Proprietà fisiche delle molecole sulle quali agiscono le interazioni di van der Waals e
forze di London

Legame a idrogenoPuò essere considerato come un’interazione dipolo-dipolo particolarmente intensa, che si instaura tra un atomo di idrogeno appartenente ad un dipolo (H X) e un atomo elettronegativo di un’altra molecola polare.
Rappresentazione del legame a idrogeno
X - H … Y X e Y = F, O, N
X ……. Y
H

Perché il legame a idrogeno è più forte delle forze di van der Waals e delle forze di
London?
•Accentuata polarità del legame HX
•Piccole dimensioni di H
Provocano una forte concentrazione della carica positiva
I legami a idrogeno più forti sono quelli in cui X è N, O, F, cioè atomi piccoli e molto elettronegativi
Le sostanze che hanno le interazioni più intense, come H2O, HF e NH3, hanno punti di fusione e di ebollizione particolarmente alti
Le molecole polari che possono fare legami idrogeno sono più alto-bollenti delle molecole polari che possono fare solo forze dipolo-
dipolo o molecole che possono fare solo forze di dispersione

Legame a idrogeno e proprietà fisiche

A temperatura ambiente:
H2O liquida
OH H
SH H
Associazione molecolare nell’ H2O liquida
H2S gassoso
OH
H
OH
H
OH
H

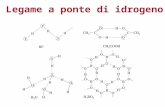
Legame a ponte di idrogeno

Anomalia della struttura del ghiaccio
Densità inferiore all’acqua liquida
d (H2Osolida) = 0,9163 g/cm3
d (H2Oliquida) = 1,000 g/cm3
Struttura aperta del ghiaccio

Solubilità nell’acqua di composti contenenti O, N e F
ammoniaca
H
H - N …….H - O
H H
alcol metilico
CH3 - O ….H - O
H H
Le vitamine idrosolubili possono fare legami H perché possiedono tanti gruppi OH solubili in acqua
Zuccheri solubili in acqua perché hanno tanti gruppi OH fanno legami idrogeno

Legame a idrogeno nelle proteine
Legamia idrogenoin una -elica

Legame a idrogeno nelle proteine
Legamia idrogenoin un foglietto

Legame a idrogeno nel DNA