Struttura e Fisiologia Della Cellula Vegetale
-
Upload
mestessooo -
Category
Documents
-
view
131 -
download
3
Transcript of Struttura e Fisiologia Della Cellula Vegetale
STRUTTURA E FISIOLOGIA DELLA CELLULA VEGETALE Parte 1: Cecilia Del Casino
Il MICROSCOPIO OTTICOLorigine del microscopio ottico ancora materia di discussione. La maggior parte degli studiosi, tuttavia, fanno risalire i primi microscopi ottici alla fine del 1500, primi del 1600 e ne attribuiscono la costruzione agli olandesi Zacharias e Hans Janssen e allitaliano Galileo Galilei. Tali microscopi erano costituiti da due o tre tubi, che potevano scorrere uno dentro laltro, con lenti alle due estremit. Questi microscopi permettevano di ingrandire il campione da tre a dieci volte. E soprattutto durante la seconda met del diciassettesimo secolo che furono costruiti numerosi altri modelli di microscopio ottico, cercando soprattutto di migliorarne i sistemi di lenti per lingrandimento dei campioni.
STRUTTURA del MICROSCOPIO OTTICOI microscopi sono strumenti costruiti per produrre immagini ingrandite di oggetti molto piccoli. Il microscopio deve svolgere tre funzioni principali: Ingrandire limmagine del campione osservato Separare i dettagli dellimmagine Rendere visibili i dettagli allocchio umano Di base il microscopio ottico costituito da due unit ottiche di
ingrandimento:
Lobiettivo (sistema di lenti posto vicino al campione) Loculare (sistema di lenti posto vicino allocchio dellosservatore)
Lingrandimento dato dal sistema di lenti poste nellobiettivo (1-100X), da altre poste nelloculare (5-20X) e, se presenti da quello prodotto da lenti intermedie (poste tra oculare e obiettivo). E possibile calcolare lingrandimento totale (
M):
M = Mob. X Moc. ( X Mint.)Con:
Mob. = ingrandimento obiettivo; Moc. = ingrandimento oculare Mint. = ingrandimento lenti intermedie
N.B. Per aumentare il potere
di risoluzione occorre agire sulla lunghezza donda oppure sullapertura numerica dellobiettivo. Il potere di risoluzione indipendente dallingrandimento dellobiettivo
La MICROSCOPIA a FLUORESCENZALa luce visibile una piccola porzione dello spettro elettromagnetico (tra 400nm e 700nm) e si propaga come unonda e sotto forma di particelle (FOTONI).
La microscopia a fluorescenza sfrutta le lunghezze donda pi corte dello spettro (verso lultravioletto) per eccitare delle particolari molecole che quando vengono irradiate riemettono luce nello spettro del visibile (autofluorescenza).
(fluorocromi), oppure sfrutta la fluorescenza naturale del preparato
Il termine FLUORESCENZA stato coniato intorno alla met del 19
secolo, quando Stokes vide che un minerale diventava fluorescente se illuminato con luce ultravioletta. I primi microscopi a fluorescenza sono stati costruiti agli inizi del 20 secolo. Gli studi effettuati con tali microscopi hanno permesso di capire che molte sostanze (cristalli, resine, clorofilla, vitamine.) sono in grado di emettere luce fluorescente se irradiate a determinate lunghezze donda (fluorescenza primaria o autofluorescenza). Intorno agli anni 30 sono state, messe a punto tecniche che utilizzano i
fluorocromi, per rendere fluorescenti campioni che, normalmente, non lo sono (fluorescenza secondaria).Inoltre, intorno agli anni 50, Coons e Kaplan utilizzarono anticorpi marcati con la fluoresceina per localizzare antigeni specifici nei diversi tessuti tessuti (immunofluorescenza).Fluorocromo FITC Rodamina DAPI assorbimento 495nm 570nm 345nm emissione 519nm 576nm 455nm
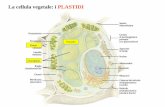
LA CELLULA VEGETALE
E caratterizzata dalla presenza: di una parete primaria costituita principalmente da cellulosa e talvolta (in alcuni tessuti) da una secondaria di organelli, i Plastidi, con diverse importanti funzioni del Vacuolo, organello molto importante nel mantenimento del turgore cellulare (piccoli e numerosi che si fondono in un unico grande vacuolo in cellule adulte).
I Plastidi (i Cloroplasti)
Esperienza nr. 1
Obiettivi: Osservazione di alcuni tipi di Plastidi nei tessuti vegetali. Occorrente: materiale vegetale (es. parti verdi di piante diverse) acqua distillata, bisturi o lametta, pipetta, pinzetta, vetrini porta e coprioggetto, carta assorbente. Procedimento: Preparare un vetrino portaoggetto per ciascun campione contenente: una goccia di acqua distillata
Effettuare una spellatura delle parti verdi della pianta con lausilio del bisturi o con la lametta per cercare di ottenere un unico strato di cellule. Porre i campioni sui vetrini portaoggetto dove stata precedentemente messa una goccia di acqua distillata e coprire delicatamente con un vetrino coprioggetto. Osservare i preparati al microscopio. Risultati:
Cellule contenenti cloroplasti ricchi Cloroplasti nelle foglioline di muschio di clorofilla Conclusioni: Il colore verde di molti organi vegetali dovuto alla presenza, allinterno delle cellule, di specifici pigmenti, le clorofille. Questi pigmenti sono contenuti allinterno di particolari plastidi, detti CLOROPLASTI, importanti perch sede del processo della fotosintesi clorofilliana.
Esperienza nr. 2 I PLASTIDI (i Cromoplasti)
Obiettivi: Osservazione di alcuni tipi di Plastidi nei tessuti vegetali. Occorrente: materiale vegetale (es. Carota, pomodoro) acqua distillata, bisturi o lametta, pipetta, pinzetta, vetrini porta e coprioggetti, carta assorbente.
Procedimento: Preparare un vetrino portaoggetto per ciascun campione contenente: una goccia di acqua distillata Togliere dalla carota lo strato superficiale e raschiare un po di materiale con la punta del bisturi o con la lametta oppure effettuare una sezione sottile della carota. Prelevare una piccola quantit di polpa di pomodoro, eseguendo il prelievo al di sotto della buccia dove la polpa ancora compatta. Porre i campioni su un vetrino portaoggetto dove stata precedentemente messa una goccia di acqua distillata e coprire delicatamente con un vetrino coprioggetto. Osservare i preparati al microscopio. Risultati: Nella carota, allinterno delle cellule, si possono osservare numerose strutture rettangolari o aghiformi di colore arancione che rappresentano il carotene (pigmento arancione). La polpa del pomodoro costituita da cellule piuttosto grosse e rotondeggianti con allinterno corpuscoli sferoidali o strutture aghiformi di colore rosso. Le grosse cellule della polpa di pomodoro contengono il pigmento del pomodoro che il licopene che, cristallizzando, forma i piccoli aghi visibili al microscopio. Conclusioni: Il colore rosso, arancione o giallo di molti organi vegetali spesso dovuto alla presenza, allinterno delle cellule, di specifici pigmenti che talvolta cristallizzano. Questi pigmenti, a loro volta, sono contenuti allinterno di particolari plastidi, detti CROMOPLASTI.
Esperienza nr. 3 Lamido secondario (gli Amiloplasti)
Obiettivi: Osservazione di alcuni tipi di Plastidi nei tessuti vegetali. Occorrente: materiale vegetale (es. patate, banane, riso)
soluzione di Lugol (a 2g di ioduro di potassio in 100ml di acqua distillata, aggiungere 0.2g di iodio) acqua distillata, bisturi o lametta, pipetta, pinzetta, vetrini porta e coprioggetto, carta assorbente.
Procedimento: Preparare un vetrino portaoggetto per ogni campione contenente: una goccia di soluzione di Lugol Prelevare, con la punta del bisturi o con la lametta, una piccola quantit delle parti interne di ogni vegetale in esame oppure effettuarne una sezione sottile. Porre il campione sul vetrino portaoggetto precedentemente preparato, attendere 10-20 sec. e coprirlo con un vetrino coprioggetto. Osservare i preparati al microscopio. Risultati: Al microscopio sono visibili molti granuli dallaspetto caratteristico, la cui forma varia nei diversi preparati. La soluzione di Lugol, colora i granuli di amido di blu-violetto. Conclusioni: Le strutture colorate osservate al microscopio sono, pertanto, i granuli di amido contenuti nei plastidi delle cellule dei campioni in esame. Poich i campioni esaminati appartengono a parti non fotosintetizzanti della pianta (non sono verdi, non c clorofilla), possibile affermare che i plastidi osservati sono AMILOPLASTI. In essi lamido si forma a partire da glucosio che stato sintetizzato a livello di zone fotosintetizzanti e trasportato fino agli organi in esame sotto forma di saccarosio per essere, in queste sedi, nuovamente convertito in glucosio e quindi in amido. Si tratta pertanto di AMIDO SECONDARIO, depositato nella pianta in zone adibite allaccumulo di riserve energetiche. I granuli di amido possono assumere forme diverse nelle varie specie (vedi figura). Nei tessuti della patata, per esempio, rivelano una struttura a cerchi concentrici; questi si originano in quanto lamido viene via, via depositato nellamiloplasto intorno ad un nucleo centrale (ilo) secondo anelli concentrici di diametro sempre crescente. La forma complessa dei granuli damido nel riso dovuta, invece, alla sua deposizione intorno a pi ili contemporaneamente.
GRANULI DI AMIDO DI DIVERSE FORME .a. Patata. b. Fagiolo. c. Riso. Ciascun granulo si forma, negli amiloplasti, in seguito alla deposizione di amido.
Esperienza nr. 4Obiettivi: Osservare al microscopio la struttura di una cellula vegetale con particolare attenzione a nucleo, parete e vacuolo Occorrente: materiale vegetale (es. bulbo di cipolla, polline) acqua distillata, bisturi o lametta, pipetta, pinzetta, vetrini porta e coprioggetto, carta assorbente DAPI (4',6-diamidino-2-phenylindole) colorante per DNA (attenzione nelluso, prodotto pericoloso). Fissativo (acido acetico ed etanolo in proporzioni 1:3) Calcofluor white (soluzione allo 0,1% in acqua)
Osservazione di PARETE e VACUOLOProcedimento: Preparare un vetrino portaoggetto per ciascun campione contenente: una goccia di acqua distillata Prelevare una scaglia dal bulbo di cipolla. Incidere con la lametta lepidermide interna (faccia concava) in maniera da ritagliarne dei quadrati o rettangoli. Prendere delicatamente le porzioni ritagliate di epidermide con una pinzetta e porle sul vetrino portaoggetto. Mettere su un altro vetrino del polline
Coprire delicatamente i vetrini coprioggetto. Osservare i campioni al microscopio.
portaoggetto
con
un
vetrino
Attenzione, per una migliore osservazione, porre sul vetrino portaoggetto la parte dellepidermide di cipolla che era attaccata ai tessuti della scaglia. Ci importante poich la spellatura provoca la lacerazione delle pareti cellulari sottostanti, alcuni lembi delle quali restano attaccati allepidermide. Essendo la parte osservata, corrispondente al piano superiore del preparato, questi frammenti a contatto col vetrino coprioggetto, ne disturberebbero losservazione, ci non avviene se si trovano al di sotto. Risultati: Nella cipolla possibile osservare lo strato di cellule epidermiche contenenti ognuna un grosso vacuolo, la parte esterna di cellule risulta circondata da una parete primaria. Nel polline visibile una spessa parete protettiva
Osservazione dei NUCLEI e della PARETE al microscopio ottico a fluorescenzaNUCLEI Procedimento: Preparare due nuovi vetrini portaoggetto e porre su di essi rispettivamente una porzione di epidermide di cipolla (come in precedenza) e del polline. Mettere sui campioni una goccia di fissativo e lasciar evaporare. Successivamente mettere sulle cellule una goccia di DAPI, attendere 20-30 sec. e coprire con vetrino coprioggetto. Questo materiale, colorato con DAPI, deve essere osservato al microscopio a fluorescenza dato che contiene un fluorocromo eccitabile a lunghezza donda intorno a 358nm. Risultati: Data la specificit del colorante DAPI per gli acidi nucleici, saranno visibili (di colore blu) i nuclei delle cellule epidermiche di cipolla e il nucleo vegetativo e generativo dei granuli pollinici.
PARETE Procedimento: Preparare un vetrino portaoggetto contenente una goccia di Calcofluor white e porre su di esso una porzione di epidermide di cipolla (come in precedenza), attendere 10-20 sec. e coprirlo con un vetrino copri oggetto. Questo materiale, deve essere osservato al microscopio a fluorescenza utilizzando una lunghezza donda intorno a 358nm. Risultati: Le pareti cellulari che circondano le cellule epidermiche di cipolla, colorate con Calcofluor white (specifico per la cellulosa), saranno visibili di colore blu.
Parte 2: Lorenza Bellani, Simona CalabrEsperienza n1 PLASMOLISI Obiettivi: Verificare il comportamento di cellule vegetali poste in ambienti con diversa tonicit e verificare la semipermeabilit del tonoplasto Materiale occorrente: Bulbi di cipolla rossa Soluzione 1M di saccarosio Soluzione 10% di NaCl Acqua distillata, vetrini porta e copri-oggetto, pinze, carta assorbente, microscopio ottico. Procedimento: Prelevare lepidermide dai catafilli interni del bulbo di cipolla con le pinze e disporli su un vetrino portaoggetti, aggiungere una goccia di acqua distillata, coprire con il vetrino coprioggetto e osservare al microscopio. Aggiungere ad un lato del vetrino alcune gocce della soluzione di saccarosio o di NaCl e contemporaneamente assorbire lacqua in eccesso dal lato opposto del vetrino. Lasciare agire per alcuni minuti ed osservare di nuovo al microscopio. Osservazione Alla prima osservazione le cellule appaiono uniformemente colorate per la presenza di pigmenti (antociani) allinterno del vacuolo che occupa quasi interamente il lume cellulare mentre il citoplasma e la membrana cellulare non sono visibili. Ambiente ISOTONICO: la concentrazione dei soluti interna uguale a quella esterna Ambiente IPOTONICO:la concentrazione dei soluti interna maggiore di quella esterna (entra in gioco la parete cellulare e si ha TURGORE) Ambiente IPERTONICO: la concentrazione dei soluti interna minore di quella esterna (fenomeno della PLASMOLISI). Sostituendo lacqua con la soluzione di saccarosio la cellula si viene a trovare in ambiente ipertonico e lacqua esce dal vacuolo per osmosi. I pigmenti non
passano dal tonoplasto, risultano pi concentrati allinterno del vacuolo e lo fanno apparire pi scuro. Quando diminuisce il volume del vacuolo lo strato di citoplasma segue la contrazione e si ha un distacco del plasmalemma dalla parete cellulare. Questo fenomeno detto: PLASMOLISI. Quando si aggiunge di nuovo acqua distillata si osserva che le cellule riprendono il loro assetto iniziale, perch la cellula pu riassorbire per osmosi lacqua precedentemente persa. Questo fenomeno detto: DEPLASMOLISI Ponendo sul vetrino contenente lepidermide di cipolla una base (ammoniaca diluita) o un acido si avr un viraggio del colore del succo vacuolare, perch gli antociani assumono colore rosso in ambiente acido e blu in ambiente basico.
Esperienza n2 ISOLAMENTO DI CLOROPLASTI Materiale occorrente: Foglie verdi fresche (per esempio spinaci) Soluzione di saccarosio 0.5M conservata a 0 Omogenizzatore potter Centrifuga e provette Eppendorf Garza, imbuto, vetrini porta e coprioggetto, pipette, microscopio ottico. Procedimento: Pesare 2,5 gr di foglie fresche e sminuzzarle. Aggiungere 15 cc di soluzione di saccarosio 0.5 M a 0 C. Omogeneizzare per 2. Filtrare lomogenato attraverso una garza posta su un imbuto. Porre il filtrato in provette Eppendorf e centrifugare per 10 a 50xG. Asportare il surnatante con una pipetta, porlo in provette Eppendorf e centrifugare di nuovo per 10 a 600xG. Eliminare il surnatante e sospendere il precipitato ottenuto in saccarosio 0.5M. Prelevare due gocce con una pipetta Pasteur, porle su un vetrino portaoggetti, coprire con un coprioggetti ed osservare al microscopio ottico fino ad arrivare al massimo ingrandimento. Osservazione Mediante le due centrifugazioni a bassa temperatura ed con forza centrifuga crescente, stato possibile separare le diverse strutture subcellulari secondo la loro massa e densit. Con la prima blanda centrifugazione sono precipitati i nuclei, le cellule non rotte e le fibre. Con la seconda stata provocata la precipitazione dei cloroplasti. Al microscopio ottico si osservano i cloroplasti isolati che appaiono sferoidali e di colore verde.
Principi di base del funzionamento della centrifuga Particelle in sospensione in una soluzione lasciata decantare per un tempo determinato, si depositano sul fondo del contenitore spinte dalla forza di gravit terrestre.In alcuni casi (fluidi biologici) il tempo impiegato per la sedimentazione spontanea sarebbe troppo lungo e alcune particelle
impiegherebbero anni per sedimentare.Se lo stesso contenitore viene fatto ruotare in circolo, la soluzione viene sottoposta ad una forza di gravit artificiale proporzionale alla distanza dal centro di rotazione e al quadrato della velocit di rotazione. Con la centrifuga si puo quindi generare un aumento di gravit rispetto alla gravit terrestre accelerando il processo di sedimentazione. La forza di gravit relativa a quella terrestre sviluppata artificialmente dalla centrifuga viene chiamata RCF (Relative Centrifugal Force), e si indica con "x G". G= 2r Dove la velocit angolare del rotore (in radianti/sec) ed r la distanza della particella della particella dallasse di rotazione. Dal momento che una rivoluzione del rotore pari a 2 radianti, la sua velocit angolare pu essere espressa in rotazioni per minuto (rpm)