Neoplasie del Testicolo - sdc858063671d84c6.jimcontent.com · Tumore del sacco vitellino (Yolk sac...
Transcript of Neoplasie del Testicolo - sdc858063671d84c6.jimcontent.com · Tumore del sacco vitellino (Yolk sac...
Neoplasie del Testicolo
• Cellule germinali: 95% dei tumori deriva dalle cellule spermatogeniche rapidamente proliferanti del testicolo (germ cell tumors)
• Cellule interstiziali e stromali di supporto danno origine ai rari tumori della cordoni sessuali stromali (sex-cord stromal tumor) (alcuni sono vere neoplasie, molti sono amartomi, collegate ad altre sindromi cliniche)
usualmente
• Tumori altamente maligni, invasivi
• Uomini giovani
Tumori testicolari:
Classificazione
TUMORI DELLE CELLULE GERMINALI
Lesione in situ IGCNU
Tumori di un solo tipo istologico:
Seminoma
Seminoma variante sinciziotrofoblastica
Seminoma spermatocitico
Spermatocitico con variante sarcomatosa
Carcinoma embrionale
Tumore del sacco vitellino (Yolk sac tumor, tumore dei seni endodermici)
Corioncarcinoma
Teratoma (teratoma maturo, cisti dermoide, teratoma immaturo, teratoma maligno, neuroectodermico)
Tumori di più tipi istologici:
Tumore misto a cellule germinali
Poliembrioma
Embrioma diffuso
TUMORI STROMALI DEI CORDONI SESSUALI
Tumori delle cellule di Leydig
Tumori delle cellule del Sertoli
Tumori a cellule della granulosa
Tumori misti dei cordoni sessuali
Tumori non classificati
• TUMORI MISTI GERMINALI E DEI CORDONI SESSUALI
• TUMORI DELLA RETE TESTIS
• LINFOMI PRIMITIVI e METASTATICI
Neoplasie germinali del Testicolo
WHO: Classifica i tumori per somiglianza morfologica
• Seminoma: ricorda cellule gonadiche primitive
• Carcinoma embrionale: ricorda le cellule indifferenziate del disco embrionale
• Tumore del sacco vitellino: ricorda le strutture del sacco embrionale dei roditori, mesenchima extra-embrionario e membrane allantoidee
• Teratoma: tessuti somatici misti maturi o immaturi
BTT (British Testicular Tumor) Basata sulla erronea convinzione che le neoplasie non seminomatose derivino da tessuti non propriamente localizzati, (gemme tessutali residue)
Tumori testicolari:Istogenesi
Derivano tutti, tranne il seminoma spermatocitico, da un precursore comune: (Skakkebaek, carcinoma in situ)
• Iniziale proliferazione intra-tubulare di cellule simili al seminoma
• Anomalie genetiche: cromosoma 12p (isocromosoma). Delezione del braccio corto del cromosoma 11p
• Espressione: fosfatasi alcalina placentare (PLAP TRA-1-60), e glutatione trasferasi (GST isoenzima pi), recettori lectinici.
Tumori testicolari:Istogenesi
Il seminoma può essere considerato come il precursore di tutti i tumori della linea germinale
• Può sviluppare elementi non seminomatosi (30-40%) dei casi avanzati
• Può contenere sinciziotrofoblasti 10%-20%
• Cellule del seminoma possono differenziare in cellule epiteliali (ME)
• Il contenuto di DNA delle cellule del seminoma è più alto di quello degli altri tumori delle linee germinali (suggerendo una evoluzione per GENE LOSS)
Tumori non seminomatosi possono insorgere direttamente dal carcinoma in situ o evolvere da seminomi
Tumori testicolari:Istogenesi
In situ
ITu
Troph
ITu
S
Germ
cell
SS
P -T P-YST
S EC
CC
ITu
YST
YST
T S+
ECF IT
S+
STGG ITu
EC
EC+
STGG
S+
AFP
EC+
AFP
Trasformazione
Maligna
Invasione
Trasformazione
rara
Rara
Crescita
rara
rara
rara
Modello di Srigley di trasformazione del seminoma
In situ (IGCNU); AFP: alfa-fetoproteina; CC: corioncarcinoma;
EC: carcinoma embrionale; ECF: early carcinomatoso; IT: teratoma immaturo;
ITu: intratubulare; P-T: teratoma pediatrico; P-YST: Yolk sac tumor pediatrico;
S: seminoma; SS: seminoma spermatocitico; STGC: sinciziotrofoblasto; T: teratoma
YST: Yolk cas tumor adulto
Neoplasie del testicolo: epidemiologia
Condizione rischio
• Criptorchidismo 3.5-5x
• Altro tumore testicolare 5 -10x
• Familiarità (Li-Fraumeni) 5.5x
• Disgenesia gonadica (presenza di XY) 50x
• Sindrome di inensibilità androgenica 15x
Neoplasia intratubulare a cellule germinali (in situ,
IGCNU)
• Proliferazione di
cellule maligne miste
a normali in alcuni
tubuli
• Glicogeno + (PAS)
• PLAP+(immuno-
HRP)
• DNA tri-ipotetraploide
• FORMA invasiva:
cromosoma iso 12p
Seminoma
• Più comune
• Puri 50%
• 40 anni
Siero Non alfafetoproteina
serica, HCG elevata (prognosi),
LDH,PLAP, ENS elevata
Macroscopica:
Nodulare, giallastro,
solo 10% invade le
strutture
paratesticolari
• Rare emorragie,e
aree necrotiche
Seminoma
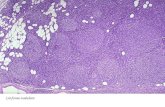
Microscopica: Nastri di cellule rotondeggianti, intenso infiltrato linfocitario stromale
• Cellule omogenee, chiare, uniformi, cromatina granulare, due nucleoli
• Presenza di mitosi anche abbondante
Carateri cellulari: glicogeno+, PLAP+, Citocheratina 8,18+, EMA+, vimentina+, NSE, desmoplachina+
DNA: tri- ipotetraploide C-myc, Ras, C-kit
PLAP
Seminoma spermatocitico
• Entità discreta
• Masson 1946
• 1-2% dei tumori testicolari
• Colpisce solamente i testicoli
• Non è associato con criptorchidismo
• Pazienti più vecchi
Macroscopica: 3-15 cm di diametro
• Zone carnose, mucoidi, friabili, cistiche
• Raramente estensione paratesticolare
Seminoma spermatocitico
Microscopica: pattern diffuso, con microghiandole e microcisti
• Non infiltrato linfoide
• Popolazione polimorfa: linfocitica, intermedia, a cellule giganti
Caratteri: vimentina-, PLAP-, HCG-, Actina-,CEA-, citocheratina-,
DNA: cromosomi filamentosi, iperdiploidia,anepluoidia
Diagnosi differenziale: linfoma testicolare
Carcinoma embrionale
• Misto,maggioranza dei casi
• Differenzia in altre forme di carcinoma testicolare
• Esprime SSEA-3, non SSEA-1 piu’ maturo
• 30 anni
• 30-40% metastatici all’esordio
Macroscopica: tumore non circoscritto, aree di necrosi ed emorragia
Carcinoma embrionale
Microscopica: nidi coesivi
di cellule epiteliali
anaplastiche, 1)solido,
2)tubulare, 3)papillare
• Foci di necrosi
Caratteri: PLAP+patchy,
citocheratina+, EMA-, Ki-1-.
DNA: indice1.4-1.6,
cromosoma iso12p, del
12(q13-q22), N-ras, p53
Tumore del sacco vitellino
INFANTILE: 18 mesi
• Puro
• Rare metastasi, massa non dolente
Adulti : 25-30 anni
• Misto
• Elementi presenti nel 40% dei tumori germinali
• Stadio piu’ basso
Pattern di crescita per frequenza: microcistico, sinusale endodermico, papillare, mixomatoso, ghiandolare, sarcomatoide, polivescicolare
Caratteri: Fp, TR, citocheratina, PLAP, EMA-
DNA: non i(p12), bambini diploide
Teratoma
• Secondo per frequenza nei bambini 14-18% dei casi
• 20 mesi, dopo 4 anni raro
• Adulti: componente di un tumore misto germinale
Istologia: 1)maturo: diametro sotto1 cm, mucoide, cistico e aree solide (tessuti somatici misti, ben differenziati); 2)immaturo: neuroepitelio, blastema, tubuli embrionali.
• E’ una neoplasia maligna
• Non e’ chiaro se la presenza di atipe possa determinare un grading
• Teratomi con componenti a cellule germinali sono più aggressivi
TERATOMI MATURI: Trasformazione in carcinoma invasivo adenocarcinoma o carcinoma squamoso
TERATOMI IMMATURI: Trasformazione in sarcoma della componente stromale
• vengono diagnosticati e stadiati come tumore del tipo cellulare trasformato, rabdomiosarcoma, tumore di wilm’s, tumore neuroectodermico
Corioncarcinoma
• Rara componente dei tumori misti germinali
• Puro rarissimo 0.3%
• Metastatico alla diagnosi
• Primario spesso occulto
• Metastasi polmonari, cerebrali, intestinali
• 20-30 anni
Macroscopica: testicolo di dimensioni normali, emorragico e necrotico, con cicatrici
Microscopica: cellule mononucleate chiare o poco eosinifile (citotrofoblasti) e cellule multinucleate con nuclei degenerati (sinciziotrofoblasti)
• Simili a villi immaturi placentari
Caratteri: nei sinciziotrofoblasti: HCG+, beta1glicoproteina, lattogeno placentare, citocheratina+, EMA+
Tumori misti germinali del testicolo
• Composti da più di un tipo delle cellule
germinali già descritte
• Classificati sempre come non
seminomatosi
• 1/3 delle neoplasie testicolari
• Combinazioni piùcomuni includono
teratoma e carcinoma embrionale
• Teratoma e seminoma
Stadiazione dei tumori testicolari
• Boden e Gibb:
1° Localizzato: limitato al testicolo
2° Disseminazione precoce: linfonodiretroperitoneali
3° Disseminazione avanzata:coinvolgimento sopradiaframmatico
La disseminazione retroperitoneale deve essere suddivisa
in ulteriori stadi clinicamente significativi?
TNM dei tumori testicolari
TMN sec UICC (International Union against Cancer)
T0- Mancanza di primario apparente
T1- Testicolo senza invasione della rete testis
T2- Invasione della tonaca albuginea
T3- Invasione della rete testis e dell’epididimo
T4- Invasione delle corde spermatiche
a- corde spermatiche
b- scroto
N0- linfonodi non coinvolti
N1-coinvolgimento dei linfonodi ipsilaterali
N2- coinvolgimento dei linfonodi controlaterali o bilaterali addominali ed inguinali
N3- linfonodi inguinali palpabili
N4-linfonodi juxtaregionali
M0- non metastasi distanti
M1- metastasi distanti
TNM sec AJICI (System American Joint Commitee)
Tx- Sconosciuto
T0- Mancanza di primario apparente
Tis- Tumore intratubulare
T2- Oltre la tunica albuginea o nell’epididimo
T3- invasione delle corde spermatiche
T4- Scroto
Nx- Stato nodale sconosciuto
N0- Non coinvolti
N1- Linfonodo singolo <2cm
N2- Linfonodo singolo >2-5cm
N3- ogni linfonodo >5cm
Mx- non conosciuto
M0- assenza di metastasi
M1-metastasi presenti
Stadiazione dei tumori testicolari
TMN sec UICC (International Union against Cancer)
T0- Mancanza di primario apparente
T1- Testicolo senza invasione della rete testis
T2- Invasione della tonaca albuginea
T3- Invasione della rete testis e dell’epididimo
T4- Invasione delle corde spermatiche
a- corde spermatiche
b- scroto
N0- linfonodi non coinvolti
N1-coinvolgimento dei linfonodi ipsilaterali
N2- coinvolgimento dei linfonodi controlaterali o bilaterali addominali ed inguinali
N3- linfonodi inguinali palpabili
N4-linfonodi juxtaregionali
M0- non metastasi distanti
M1- metastasi distanti
STADIO 0 : T1, N0, M0
STADIO I: ogni altro T
STADIO II: ogni T, N1-N3, M0
SATDIO III: ogni T, ogni N, M0
SATDIO iV: ogni T, Ogni N, M1
Pattern di metastatizzazione dei tumori a
cellule germinali
a) Linfonodi retro-peritoneali a) Seminoma: via linfatica
b) Corioncarcinoma: via ematica
c) Carcinoma embrionale: via linfatica ed ematica
b) Sedi linfonodali selettive 1. Testicolo destro: LN interaortocavale e paracavale e precavale
2. Testicolo sinistro: LN paraaortici, entro lo spazio definito dal decorso dell’uretere sinistro, vena renale,aorta ed origine della mesenterica inferiore
3. Metastasi soprailari: tardive con primario a destra, precoci con primario a sinistra
4. Bilateralizzazione dei LN
5. Coinvolgimento retrogrado dei LN inguinali (precoce nello scrotale)
6. LN mediastinici, sopraclavicolari, laterocervicali
c) Ematogene : polmoni, fegato, sistema nervoso centrale
Diagnosi istologica
• Il testicolo, completo di tuniche e corde spermatiche deve pervenire a fresco
• L’orchiectomia radicale messa in formalina per intero e dissecata solo ore più tardi quando arriva alla patologia, non permette la penetrazione del fissativo oltre le tuniche e spesso i cambiamenti autolitici del tessuto tumorale sono già tali da non permettere una diagnosi (meglio che gli urologi diano un taglio completo al pezzo operatorio se non può giungere a fresco)
Diagnosi istologica
• Orchiectomia radicale: testicolo, tunica vaginale, una porzione delle corde spermatiche
• Peso, misura delle tre dimensioni, e lunghezza delle corde spermatiche
• Incisione della tunica vaginale, descrizione delle anomalie, misura dell’eventuale liquido contenuto, palpazione della tunica per l’individuazione di infiltrazioni neoplastiche
• Testicolo suddiviso per l’asse attraverso l’ilo e fotografato
• Tessuto fresco neoplastico preservato e congelato per studi di genetica, citometria, biologia molecolare
• Testicolo sezionato e lasciato fissare in formalina
• Dopo fissazione descrizione della lesione e delle eventuali infiltrazioni
• Prelievi specifici in ogni area del tumore infiltrazioni, necrosi, emorragia (1 inclusione ogni cm di tumore). Ricerca di elementi non seminomatosi
• Parenchima testicolare normale, epididimo, albuginea, cordoni spermatici e limiti di resezione.







































![LA TERZA SETTIMANA - TERZA SETTIMANA.pdfAmnios epiblasto ipoblasto Entoderma del sacco vitellino POST ANT La comparsa della linea primitiva al 15 JLRUQRLQGLFDO L QL]LR della gastrulazione](https://static.fdocumenti.com/doc/165x107/5c695fa709d3f25c6a8cf716/la-terza-settimana-terza-settimanapdfamnios-epiblasto-ipoblasto-entoderma-del.jpg)
