La materia Slideshow
-
Upload
carla-petrini -
Category
Documents
-
view
7.183 -
download
1
Transcript of La materia Slideshow

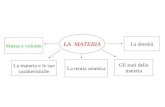
LA MATERIA
Materia è tutto ciò che occupa un volume. La materia possiede una massa. La materia è costituita da atomi.
Le gocce d'acqua e le particelle di polvere sono tipi di materia, così come le piante, gli animali, i pianeti.

Massa e peso
La massa misura la quantità di materia contenuta in un corpo. E’ indipendente dalla forza di gravità.
Gli scienziati misurano la massa, in chilogrammi (Kg) e il peso in newton (N): 1Kg è pari a una forza di 9,81 N.
Il peso di un oggetto è la forza che questo esercita sulla Terra: si tratta della conseguenza della gravità che agisce sul corpo. Sulla Luna il nostro peso è molto minore che sulla Terra e questo a causa della minore forza di gravità.

La forza di gravità La gravità è una proprietà fondamentale della materia,
consistente nel fatto che due corpi qualsiasi si attraggono, cioè esercitano tra loro una forza.
La legge di gravitazione, formulata da Newton, stabilisce che due corpi si attraggono con una forza direttamente proporzionale al prodotto delle masse e inversamente proporzionale al quadrato della distanza.
La gravità è la forza che muove i pianeti attorno al Sole, che ci tiene sulla Terra e che ….. fa cadere le mele sulla testa degli scienziati!!!
La forza di gravità è universale, è ovunque, e agisce su tutti gli oggetti, pianeti, atomi, rocce, ecc.
2
21F
d
mGm
dove:F = forza gravitazionale tra i due oggetti m1 = massa del primo oggetto m2 = massa del secondo oggetto d = distanza tra i due oggetti G = costante di gravitazione universale

La densità Un oggetto metallico è di solito molto
più pesante di uno di legno, a parità di volume: questo avviene perché l’oggetto metallico ha una densità maggiore.
La densità di una sostanza dipende dalla massa di un volume dato di quella sostanza. Un oggetto metallico ha atomi impaccati più strettamente, rispetto a un oggetto in legno, perciò ha densità maggiore.
Possiamo misurare la densità di un oggetto con la seguente formula.
Densità = massa/volume (g/cm3)

Che cos'è l'energia?
Tutto ciò che succede, succede grazie all’energia. Gli scienziati classificano l’energia in diversi tipi, tra cui energia chimica, energia luminosa, energia nucleare.
Quando l’energia passa da una forma all’altra succedono le cose, ovvero viene compiuto un lavoro.
Nel motore dell’automobile, per esempio, la benzina fornisce energia chimica, che, quando il motore viene avviato, viene convertita in energia meccanica, energia termica, energia elettrica ed energia acustica.

Autoverifica
1. Perché gli astronauti nello spazio galleggiano e sembrano privi di peso?
2. Le nuvole sono costituite da materia? E l’aria che respiriamo?
3. Esistono attorno a te cose che non possiedono una massa?
4. Elenca alcune situazioni in cui è necessaria l’energia, in qualunque forma.
5. Uno scooter, quando è in movimento, sviluppa diversi tipi di energia. Quali?
6. Metti in ordine di densità crescente i seguenti materiali: acqua, olio, gommapiuma, ferro, sabbia.

Gli stati della materia Gli stati di aggregazione della materia sono tre: solido, liquido e
gassoso e dipendono dalla temperatura. Le proprietà di cui gode una sostanza alle diverse temperature dipendono
dall’energia e dalle forze che agiscono tra gli atomi e tra le molecole. Le molecole di un solido sono legate da forze intense, quelle di un gas,
invece si diffondono facilmente perché sono legate da forze deboli.

Lo stato solido Un solido è una sostanza compatta, formata da atomi strettamente legati tra loro da forze
intense e disposti in configurazioni ben definite.
La durezza di un solido dipende dalla configurazione e dai movimenti dei suoi atomi. A seconda della configurazione degli atomi i solidi si dicono cristalli o amorfi.L'elemento carbonio, per esempio, può presentarsi sotto forma di grafite, friabile, ma anche di diamante, che è uno dei solidi più duri. La differenza è dovuta dalla diversa disposizione degli atomi.
Il diamante
La grafite

Lo stato liquido I liquidi si spostano con libertà
maggiore rispetto ai solidi ma con libertà minore rispetto ai gas, perché l'energia delle particelle che li costituiscono è maggiore di quella dei solidi ma minore di quella dei gas; inoltre non possono essere compressi.
La resistenza opposta dai liquidi al flusso è detta viscosità. Questa è alta nei liquidi come gli sciroppi, che scorrono lentamente, mentre è bassa in liquidi come l'acqua.

Lo stato gassoso
I gas, come le altre forme della materia, sono costituiti da atomi.Le particelle di gas si muovono molto liberamente, a grande velocità, occupando grandi spazi.
Muovendosi, le particelle di gas ricche di energia si scontrano e urtano contro le pareti dei contenitori ed esercitano una pressione.

gas liquido solido
Assume la forma e il volume del suo contenitore.
Le particelle si possono muovere
indipendentemente le une dalle altre.
Assume solo la forma del suo contenitore, ma possiede un volume
proprio. Le particelle possono
scivolare le une accanto alle altre.
Possiede una forma e un volume proprio.
Le particelle sono bloccate nella loro posizione.
Comprimibile. Molto spazio tra le
particelle.
Non comprimibile. Poco spazio tra le particelle.
Non comprimibile. Poco spazio tra le particelle.
Caratteristiche degli stati gassoso, liquido e solido.
Riscaldamento Riscaldamento
Raffreddamento Raffreddamento

I passaggi di stato

Autoverifica
SOLIDOSOLIDO LIQUIDOLIQUIDO AERIFORMEAERIFORME

Autoverifica Esiste un tipo di materia che non occupa alcuno spazio?
Nell’aria è presente materia allo stato gassoso?
In quali stati fisici è presente l’acqua sulla terra?
Per sciogliere il ghiaccio devo aumentare o diminuire la temperatura?
Come si chiama il passaggio dallo stato solido allo stato di vapore?

L'atomo
Tutte le sostanze sono costituite da piccole particelle: gli atomi. Gli atomi sono così piccoli che in una capocchia di spillo ve ne sono 60 miliardi.
A loro volta, gli atomi sono costituiti da particelle ancora più piccole: i protoni, i neutroni e gli elettroni. I protoni hanno carica elettrica positiva, gli elettroni negativa e i neutroni non hanno carica.

Il cuore di un atomo è formato da un nucleo che è molto piccolo rispetto all'atomo, ma ne contiene quasi tutta la massa. Le particelle che lo compongono sono i protoni e i neutroni.
Il numero dei protoni del nucleo è il numero atomico di un elemento; quello di protoni e dei neutroni insieme indica, invece, il numero di massa.
Gli elettroni sono lontani dal nucleo, formano un guscio esterno e sono numericamente uguali ai protoni, ma hanno una massa molto piccola.
Struttura dell’atomo
C126
Numero di massa protoni + neutroni
Numero atomicoprotoni

Le dimensioni degli atomi
Un atomo ha un diametro di circa 10-10 m.
Il nucleo ha un diametro di circa 10-15 m.
Se il nucleo fosse delle dimensioni di una mosca e stesse al centro del cerchio di centrocampo, gli elettroni starebbero in curva.
Se gli elettroni si muovessero sulla superficie del nucleo, gli oggetti si contrarrebbero di 105 volte, conservando la stessa massa. L’Everest diventerebbe una montagna alta 8 cm, ma con una densità elevatissima.

Gli elementi
Gli elementi sono sostanze costituite da un’unica specie di atomi.
In natura esistono 92 elementi diversi.
Ciascun elemento è identificato dal numero atomico, cioè dal numero dei protoni.
Ogni elemento ha un nome.
Ogni nome è sintetizzato con un simbolo.
Gli elementi chimici unendosi tra di loro formano tutte le sostanze dell' Universo
Tutti gli elementi presenti in natura e quelli creati in laboratorio sono organizzati in una tabella che si chiama TAVOLA PERIODICA DEGLI ELEMENTI.


Idrogeno Massa atomica = 1 Numero atomico = 1
Deuterio Massa atomica = 2 Numero atomico = 1
Gli isotopi
Gli isotopi sono atomi di uno stesso elemento che possiedono un eguale numero di protoni, ma un diverso numero di neutroni.
Gli isotopi di un elemento possiedono, quindi, lo stesso numero atomico, ma un numero di massa diverso.
Isotopi dell’idrogeno

Gli ioni
Atomi che possiedono un numero di elettroni diverso rispetto al numero dei protoni sono detti ioni.
Atomi che hanno ceduto uno o più elettroni assumono tante cariche positive quanti sono gli elettroni persi e prendono il nome di cationi o ioni positivi.
Gli atomi che acquistano uno o più elettroni, al contrario, si chiamano anioni e possiedono tante cariche negative quanti sono gli elettroni acquisiti.
H+ : ione idrogeno con carica positiva
Catione
H : atomo di idrogeno neutro
H- : ione idrogeno con carica negativa
Anione

Autoverifica Come si chiamano le particelle contenute nel nucleo di un atomo?
Disegna un atomo di elio, con evidenziate tutte le sue particelle e descrivilo a parole.
Elenca il numero di protoni, neutroni ed elettroni per ciascuno dei seguenti atomi:
Come si chiamano gli atomi di uno stesso elemento che differiscono per la massa?
Come si chiama un atomo che ha perso due elettroni? Che carica elettrica possiede
52
He U H N C 52
23892
21
147
136

2 atomi di idrogeno condividono i loro elettroni per formare la molecola del gas
idrogeno (formula: H2).
I legami chimici
La maggior parte degli atomi si lega con altri atomi per formare composti.
Ciò che ci circonda è quasi interamente costituito da composti, cioè da atomi legati tra di loro. Gli atomi isolati infatti, con l'eccezione dei gas nobili, tendono ad unirsi in aggregati stabili in cui i singoli atomi sono tenuti insieme da forze di natura elettrica che vengono definite legami chimici.
Tutti gli atomi, ad esclusione dell’idrogeno e dell’elio, nel loro guscio più esterno possono contenere fino a 8 elettroni. Solo i gas nobili hanno il guscio esterno completo. Tutti gli altri atomi devono legarsi tra loro per raggiungere l’ottetto completo (= 8 elettroni).
Quando due atomi si legano, la molecola risultante è un sistema più stabile rispetto ai due atomi isolati; questo è il motivo per cui in natura si trovano pochissimi atomi isolati. Esistono diversi tipi di legame tra gli atomi, tra cui il legame ionico e il legame covalente.

Legame ionico Alcuni atomi raggiungono l'ottetto
stabile acquistando o cedendo degli elettroni. In questo modo l'atomo acquista una carica elettrica positiva o negativa, a seconda che ceda o acquisti un elettrone.
Un atomo che cede uno o più elettroni diventa uno ione positivo.
Un atomo che acquista uno o piu' elettroni diventa uno ione negativo.
Il legame che si stabilisce tra due atomi di questo tipo si dice legame ionico ed è dato dalle forze elettriche opposte che si attraggono

Legame covalente
Fra gli atomi instabili, alcuni completano l'ultimo strato senza ne' cedere ne' acquistare elettroni, ma mettendoli in comune con atomi dello stesso tipo o di tipo diverso, in modo tale che la molecola risultera' formata da atomi che hanno completato l'ultimo strato.
Questo tipo di legame si dice legame covalente.
Il legame covalente consiste nella condivisione di una o più (massimo tre) coppie di elettroni.

Le reazioni chimiche Le reazioni chimiche sono processi
in cui due o più sostanze interagiscono, trasformandosi in sostanze con composizione molecolare diversa da quella di partenza. Le sostanze che interagiscono sono dette reagenti, quelle finali prodotti.
Una reazione chimica può essere rappresentata in modo sintetico attraverso un’equazione in cui al primo membro sono scritti i reagenti e al secondo membro i prodotti.
I simboli e le formule chimiche usate mettono in evidenza i cambiamenti che si verificano nel passaggio da reagenti a prodotti.
Simulazione della reazione chimica: 2H2 + O2 → 2H2O
reagenti → prodotti

Molecola di acqua allo stato gassoso
Modello molecolare di un cristallo di ghiaccio
Molecole di acqua allo stato liquido
Gli stati della materia a livello molecolare

Atomi dell’elemento Argo (Ar) in fase gassosa
Molecole dell’elemento Azoto (N) in fase gassosa.
Un elemento: consiste di un solo tipo di atomi; Non può essere scomposto in un tipo più semplice di materia, né con sistemi
fisici né con sistemi chimici; Può esistere sia come atomi da soli (es. Argo) sia come molecole (es. l’azoto).
Elementi, Composti & Miscele: Elementi

Molecole di acqua in fase gassosa. Gli atomi di ossigeno sono di colore rosso e quelli di idrogeno sono bianchi.
Un composto: consiste di atomi di due o più elementi diversi legati assieme; può essere scomposto in sostanze più semplici (elementi) attraverso mezzi chimici; possiede proprietà differenti rispetto agli elementi che lo compongono; può essere rappresentato da una formula chimica (es. H2O).
Elementi, Composti & Miscele: Composti

Una miscela: consiste di due o più elementi e/o composti; può essere separata nei suoi componenti attraverso mezzi fisici; spesso mantiene le proprietà dei suoi componenti può essere omogenea, se non sono distinguibili i componenti (es. soluzione di
acqua e sale), oppure eterogenea, in cui sono visibili le diverse sostanze che la compongono (es. acqua e olio, acqua e sabbia)
Elementi, Composti & Miscele: Miscele
Miscela gassosa contenente due elementi (argo e azoto) e un composto (acqua).

Sostanze pure e miscele
Sostanze PureSostanze Pure MisceleMiscele
ElementiElementi CompostiComposti Miscele Miscele OmogeneeOmogenee
Miscele Miscele EterogeneeEterogenee
La MateriaLa Materia

Autoverifica
A B C
D E F
Quale disegno o disegni rappresentano un composto, un elemento, una miscela di elementi?