La Cellula - Wikibook
-
Upload
michele-scipioni -
Category
Documents
-
view
903 -
download
8
Transcript of La Cellula - Wikibook

PDF generato attraverso il toolkit opensource ''mwlib''. Per maggiori informazioni, vedi [[http://code.pediapress.com/ http://code.pediapress.com/]].PDF generated at: Sat, 28 Nov 2009 11:02:59 UTC
LA CELLULAAnatomia - Volume 1

IndiceVociMEMBRANA CELLULARE 1
Membrana cellulare 1Modello a mosaico fluido 9Composizione della membrana cellulare 11
TRASPORTO DI MEMBRANA 16
Trasporto di membrana 16Trasporto passivo 19Diffusione facilitata 22Trasportatore di membrana 23Trasporto attivo 26Recettore (biochimica) 29Recettore transmembrana 34Recettori accoppiati a proteine G 35Recettore intracellulare 39Canale ionico 41Potenziale di membrana 45Citoplasma 49
ORGANULI NON MEMBRANOSI 51
Citoscheletro 51Microvilli 54Ciglia (cellule) 55Flagello (biologia) 56Centriolo 59Ribosoma 60
ORGANULI MEMBRANOSI 64
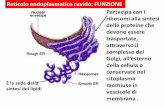
Mitocondrio 64Nucleo cellulare 70Reticolo endoplasmatico 76Apparato del Golgi 78Lisosoma 79Perossisoma 82

GIUNZIONI INTERCELLULARI 84
Giunzione cellulare 84Desmosoma 86
CICLO CELLULARE 87
Ciclo cellulare 87Interfase 91Fase G1 92Fase S 93Fase G2 94Replicazione del DNA 95Mitosi 98
NoteFonti e autori delle voci 101Fonti, licenze e autori delle immagini 103
Licenze della voceLicenza 104

1
MEMBRANA CELLULARE
Membrana cellulareLa membrana cellulare, anche dettamembrana plasmatica, plasmalemma ocitomembrana, è un sottile rivestimentoche delimita la cellula in tutti gliorganismi viventi, la separa conl'ambiente esterno e ne regola gli scambicon questo.
Formata in prevalenza da lipidi, e piùprecisamente fosfolipidi, viene chiamataanche bilayer fosfolipidico. Nellacomponente lipidica si vanno a collocare,con importanti funzioni fisiologiche,proteine e una piccola percentuale diglucidi, in forma di glicoproteine eglicolipidi, e di molecole di colesteroloche la stabilizzano.
Negli organismi procarioti è ricoperta daun rivestimento protettivo chiamatoparete cellulare, assente invece neglieucarioti; nelle cellule eucarioti vegetaliessa è presente sottoforma di una paretecellulare primaria (compostaprincipalmente da peptina) e di unaparete cellulare secondaria (composta principalmente da lignina).
La membrana cellulare presiede all'omeostasi cellulare, grazie alla sua permeabilità selettiva.Per la sua posizione di interfaccia, la membrana plasmatica, oltre alla funzione strutturale, svolge tre funzioniessenziali:1. la funzione di filtro selettivo, che lascia passare alcune sostanze piuttosto che altre, assicurando così l'integrità
biochimica del → citoplasma;2. la funzione di superficie di comunicazione, permettendo sia lo scambio di informazioni tra l'ambiente intra- ed
extracellulare, sia l'interazione fisica con le strutture extracellulari circostanti.3. la funzione di superficie catalitica, dato l'abbondante numero di enzimi ad essa legati, in gran parte coinvolti nella
produzione di messaggeri intracellulari, come le fosfolipasi e la sfingomielinasi, che idrolizzano i fosfolipidi dimembrana, e l'adenilciclasi, che sintetizza AMP ciclico.
Infine, la membrana cellulare partecipa a funzioni complesse: esocitosi (secrezione), endocitosi (ingestione disostanze esterne mediante la formazione di vescicole), adesione e movimento cellulare ameboide (es. leucociti).La struttura e le funzioni della membrana plasmatica sono comuni a quelle delle membrane intracellulari, come adesempio la membrana nucleare.

Membrana cellulare 2
Il modello a mosaico fluido
Modello di membrana plasmatica
Secondo il "→ modello a mosaicofluido", proposto nel 1972 da Singer eNicholson, il doppio strato lipidicodella membrana plasmatica è allo statodi liquido-cristallino (vedi "fosfolipidi:polimorfismo dei fosfolipidi") ed inesso sono immerse numerose proteine,che grazie alla fluidità dellacomponente lipidica presentano unnotevole grado di mobilità; ad essespetta lo svolgimento della gran partedelle funzioni di membrana. Il doppiostrato lipidico non ha carattereomogeneo, ma piuttosto all'interno delmosaico fluido sono presentimicrodomini lipidici meno fluidi (rafts.Simon e Ikonen, 1997), formatiprincipalmente da sfingolipidi e colesterolo allo stato liquido-ordinato, che funzionerebbero sia da zattere ditrasporto di componenti di membrana, sia da piattaforme per la genesi di segnali intracellulari, per cui in essi sonoconcentrate proteine specifiche.
Attualmente si distinguono due tipi di rafts: le caveole e i rafts "non invaginati". Le prime si presentanomorfologicamente come fossette (caveolae) della superficie cellulare e biochimicamente sono caratterizzate dallapresenza della proteina strutturale caveolina, essenziale per la loro costituzione. I rafts "non invaginati" sonopiattaforme morfologicamente indistinguibili dalla restante porzione della membrana cellulare; in condizioni basalisono di piccolissime dimensioni, ma sono ingrado di confluire per formare piattaforme di maggiori dimensioni inseguito a stimolazione, ad esempio in conseguenza del legame dei recettori, contenuti nei rafts, con i corrispondentisegnali extracellulari.Il concetto iniziale del modello a mosaico fluido, che prevedeva una distribuzione casuale delle proteine con ampialibertà di movimento laterale e di rotazione, deve quindi essere rivisto in favore di un modello di membrana in cuiall'interno del doppio strato lipidico fluido esistono domini lipidici e aggregati proteici a carattere dinamico, la cuimobilità è ristretta sia dai legami lipidi-lipidi, proteina-proteina o proteina-lipidi, sia dalle interazioni delle proteinecon il → citoscheletro, con la matrice extracellulare o con cellule adiacenti.
Composizione e asimmetria della membrana cellulareNella membrana cellulare si trova una grande quantità di lipidi (in particolare fosfolipidi). Oltre alla componentelipidica si trovano numerose proteine (per ogni proteina ci sono circa 50 lipidi), aventi importanti funzionifisiologiche. Si riscontra anche una piccola percentuale di glucidi, in forma di glicoproteine e glicolipidi, e dimolecole di colesterolo che stabilizzano la membrana.La composizione dei due foglietti, esterno e interno, della membrana cellulare presenta notevoli differenze, non solonella componente proteica, ma anche nella stessa componente lipidica, per cui la membrana plasmatica ècaratterizzata da una marcata asimmetria, che riflette le differenti funzioni dei due monostrati. Tale asimmetriapresenta importanti funzioni ed è finemente controllata dalla cellula.

Membrana cellulare 3
Fluidità della membrana cellulare
Due stati della membrana cellulare
In condizioni fisiologiche, sia le molecolelipidiche sia quelle proteiche in esseimmerse sono in grado di muoversiall'interno del proprio monostrato dellamembrana cellulare. A temperaturefisiologiche, la membrana cellulare è allostato lamellare liquido-cristallino, in cui lecatene idrocarboniose dei lipidi sono allostato fluido, per cui manifestano unanotevole libertà di movimento (stato L alfadi Luzzati). Al contrario, allo statocristallino le catene idrocarboniosepresentano una disposizione rigida, parallelaalla perpendicolare della superficie deldoppio strato (L beta) o angolata rispetto aquesta (L beta’). La temperatura alla quale siverifica la fusione delle catene alifatiche, cioè il passaggio dallo stato cristallino a quello liquido-cristallino, sidefinisce temperatura di transizione (Tc o Temperatura Critica oppure Tm da melting).
La maggior parte delle proteine presenta movimenti di spostamento (diffusione) laterale; fanno eccezione le proteinedi membrana ancorate al citoscheletro. Per quanto riguarda i lipidi di membrana, sono stati descritti diversi tipi dimovimenti, che possono essere intramolecolari (1) o intermolecolari (2-4):1. Rotazione intorno ai legami semplici C-C2. Rotazione intorno all'asse longitudinale3. Rotazione intorno all'asse trasversale (la rotazione di 180° porta ad un movimento di flip-flop)4. Diffusione laterale5. Movimenti collettivi, come l'ondulazione della membranaIl movimento intermolecolare si svolge soprattutto in direzione orizzontale (diffusione laterale), oltre che intorno agliassi longitudinale e trasversale della molecola (rotazione e oscillazione), ma solo raramente avviene la rotazionetrasversale di 180°, che causa il passaggio della molecola da un monostrato all'altro (movimento di flip-flop). Infattidal punto di vista termodinamico è sfavorevole per una molecola polare penetrare con la sua estremità idrofilaattraverso la parte idrofoba del doppio strato; la spesa di energia è minore nel caso di una molecola lipidica, maanche in questo caso lo spostamento da una parte all'altra della membrana avviene molto lentamente. Nellemembrane artificiali e naturali, una singola molecola lipidica scambia il posto con quelle vicine con una frequenza dicirca 107 volte al secondo e diffonde alcuni micron al secondo a 37 °C, con un coefficiente di diffusione (D) di circa10-8 cm²/s. A questa velocità di spostamento, una molecola lipidica può diffondere lungo l'intera cellula batterica(≈1 micron) in un solo secondo, mentre può percorrere l'intera circonferenza di una cellula animale in circa 20secondi.I movimenti intramolecolari consistono nella rotazione intorno ai legami semplici C-C, che comporta l'isomerizzazione tra le differenti conformazioni della molecola lipidica, in particolare l'isomerizzazione trans-gauche. I movimenti di rotazione dei gruppi metilici e di isomerizzazione trans-gauche sono massimi verso il centro del doppio strato lipidico. La conformazione trans è la più stabile (minor contenuto di energia) in quanto i gruppi metilici sono alla massima distanza tra loro. Alla configurazione all trans (quando tutti i gruppi metilici sono in conformazione trans) la catena idrocarboniosa ha la sua massima lunghezza, in quanto la molecola è completamente distesa, mentre la presenza di conformazione gauche causa un piegamento della molecola. Allo stato

Membrana cellulare 4
cristallino (L beta), le catene alifatiche dei fosfolipidi sono in conformazione all trans, con l'aumento dellatemperatura l'eccitazione termica delle catene favorisce l'isomerizzazione trans-gauche. Poiché la percentuale delleconformazioni gauche aumenta con l'aumentare della temperatura, alle alte temperature le catene idrocarboniose deifosfolipidi sono più corte.
La frequenza dei vari movimenti dei lipidi di membrana
I principali fattori che determinano lafluidità della membrana cellulare sono,oltre alla temperatura:
1. lunghezza degli acidi grassi;2. grado di insaturazione degli acidi
grassi delle code dei fosfolipidi;3. caratteristiche della testa polare;4. concentrazione del colesterolo nella
membrana.Nei fosfogliceridi si trovano due tipi diacidi grassi: quelli saturi, in cui tutti ilegami che gli atomi di carboniopossono formare sono saturati conatomi di idrogeno, e quelli insaturi, neiquali si formano doppi legami tra gliatomi di carbonio.La fluidità del doppio strato lipidico èin parte dovuta alla abbondanza relativa degli acidi grassi insaturi; in genere l'acido grasso in posizione 2 deifosfogliceridi è insaturo, tuttavia il grado di insaturazione varia a seconda della specie lipidica, essendo lafosfatidiletanolamina e la fosfatidilserina (prevalenti nel monostrato interno della membrana) più insature rispettoagli altri fosfolipidi, in primo luogo rispetto alla sfingomielina, che presenta circa il 70% di acidi grassi saturi.
La presenza di catene insature provoca un maggiore disordine nell'allineamento delle catene, rendendo più fluida lamembrana, mentre le catene sature con il loro allineamento più compatto favoriscono la formazione di un reticolorigido.Infatti, i doppi legami con configurazione cis (che costituiscono la configurazione di quasi tutti gli acidi grassiinsaturi naturali) causano un inginocchiamento della catena idrocarboniosa, per cui si riduce la lunghezza deisegmenti paralleli che interagiscono con le molecole vicine, ottenendo lo stesso effetto di un accorciamento dellacatena; il massimo effetto si ha quando il doppio legame occupa la posizione intermedia tra la fine della catena ed ilglicerolo: allontanandosi il doppio legame dalla posizione intermedia, la lunghezza del segmento parallelo aumentaprogressivamente e diventano maggiori le interazioni con le catene vicine.Al contrario i doppi legami in conformazione trans hanno un effetto di gran lunga inferiore sulla fluidità dimembrana, in quanto la catena idrocarboniosa mantiene quasi la stessa conformazione delle catene sature (lasfingosina presenta un doppio legame trans).Un altro fattore che influisce sulla fluidità della membrana cellulare è il volume occupato dalla testa polare dei fosfolipidi, che è dipendente dal suo grado di idrofilia. Il volume occupato dalla testa idratata rispetto all'area occupata dalle due catene idrocarboniose influenza lo spazio a disposizione per il movimento delle catene idrocarboniose e quindi la compattezza del loro allineamento. Per esempio, le teste della fosfatidiletanolamina occupano poco spazio per la formazione di legami idrogeno tra i gruppi –NH e i gruppi -PO-4, mentre le teste di fosfatidilcolina, prive di gruppi donatori, intergiscono attraverso le molecole di acqua legate, cosicché l'area occupata da ciascuna testa misura 47-54 Å, molto di più dell'area di sezione occupata dalle due catene idrocarboniose. Ciò determina una minore vicinanza delle catene idrocarboniose, che possono così formare un minor numero di legami fra loro. Di conseguenza, gli acidi grassi della fosfatidilcolina hanno una maggior libertà di movimento, per cui la

Membrana cellulare 5
fluidità della membrana risulta aumentata.La libertà di movimento della catena idrocarboniosa è espressa dal parametro S o parametro di ordine diorientamento, che è funzione degli angoli tra la perpendicolare alla membrana e gli assi x,y,z del sistema cartesianorelativo al gruppo CH2 in esame, in modo che S = 1 significa ordine e S = 0 disordine.Marcando con deuterio gli atomi di C in posizioni sequenziali lungo la catena idrocarboniosa, le tecniche dirisonanza hanno dimostrato che la massima mobilità si verifica alla estremità delle code idrocarboniose ecorrisponde al centro del doppio strato, mentre la minore mobilità si registra in prossimità della testa polare.La natura della testa polare influenza l'ordine della catena idrocarboniosa prossimale, cosicché la mobilità è minoreper gli etilenamminofosfolipidi rispetto ai colinofosfolidi.L'ordine della catena è influenzato anche dalla presenza di colesterolo e dal grado di saturazione della catena enaturalmente dalla temperatura.
Effetti del colesterolo sulla fluidità della membranaSebbene il colesterolo sia troppo idrofobico per formare, in dispersione pura, lamine bimolecolari, tuttavia essoconcorre alla struttura della membrana cellulare intercalandosi tra le molecole di fosfolipidi. Il nucleo steroideo delcolesterolo ha una struttura planare relativamente rigida, che viene in contatto con i gruppi CH2 prossimali (C1 –C10) delle catene alifatiche dei fosfolipidi, mentre il suo gruppo ossidrilico in posizione 3 è in contatto conl'ambiente acquoso extracellulare, posizionandosi nei pressi della testa polare dei fosfolipidi, nelle immediatevicinanze del gruppo carbossilico esterificato degli acidi grassi.Per questa sua posizione, il colesterolo riduce la libertà di movimento del tratto prossimale (più vicino al glicerolo)delle catene degli acidi grassi, con scarso effetto sul tratto distale, che occupa il centro della membrana cellulare. Glistudi di risonanza hanno, infatti, dimostrato che il colesterolo aumenta l'ordine del tratto prossimale delle catenealifatiche, diminuendo l'isomerizzazione trans-gauche e gli inginocchiamenti transitori delle catene stesse.Quindi, a causa della rigidità della sua struttura, l'effetto del colesterolo sui fosfolipidi, a temperature al di sopra dellaTm, è quello di aumentare l'ordine del tratto prossimale delle catene degli acidi grassi, mentre l'effetto sul trattodistale, al centro del doppio strato lipidico della membrana, è scarso.Al contrario, a temperature inferiori alla Tm, l'effetto del colesterolo è quello di diminuire l'ordine delle catenealifatiche degli acidi grassi e di ostacolarne la cristallizzazione, in quanto interferisce con l'interazione CH2-CH2 trale catene idrocarboniose dei fosfolipidi.A causa del maggior contenuto di sfingolipidi e di colesterolo, i rafts presentano un minor grado di fluidità rispettoalle restanti regioni della membrana plasmatica. Proprio il maggior ordine delle catene lipidiche nei rafts, porta allaseparazione di questi microdomini dalla restante membrana allo stato liquido-cristallino L alfa.

Membrana cellulare 6
Rapporti tra rafts e resto della membrana
La nuova fase che si forma per l'effetto del colesterolosugli altri lipidi è stata denominate da Zuckermann(1993) liquido-ordinata o lo, intermedia tra la fasecristallina e quella liquido-cristallina. Le cateneidrocarboniose in fase lo sono distese e strettamenteimpaccate, come nella fase cristallina, ma conservanoun alto grado di mobilità laterale.
Nelle miscele binarie di colesterolo con un fosfolipidesaturo (che quindi ha una elevata Tm), al di sopra dellaTm si separa una fase lo da una fase liquido-cristallina,mentre al di sotto della Tm la fase lo si separa dallafase cristallina.Poiché gli sfingolipidi hanno una maggiore saturazionee una più elevata Tm, rispetto ai fosfogliceridi, anche ilmaggior contenuto in sfingolipidi favorisce la separazione di domini lo e quindi la formazione dei rafts.In conclusione, è lo stretto impaccamento delle catene idrocarboniose la caratteristica chiave della esistenza dei rafts.
Data l'asimmetria della membrana, gli sfingolipidi si localizzano per la massima parte nel foglietto esterno deldoppio strato, per cui i rafts sono probabilmente più abbondanti in questo foglietto. Tuttavia, la formazione di raftsnel foglietto interno è favorita dai fosfolipidi contenenti etanolammina (fosfatidiletanolammina eplasmeniletanolammina), i quali grazie alla piccola testa polare hanno un'influenza favorevole sull'impaccamentodelle code idrocarboniose. Va sottolineato che la separazione di fase che occorre nei rafts favorisce la partizione diproteine provviste di ancore lipidiche sature o che comunque abbia preferenza per gli ambienti lo. Per questo motivoi rafts contengono proteine specifiche.Un'altra conseguenza dell'effetto del colesterolo sugli acidi grassi dei fosfolipidi è l'aumento di spessore dellemembrane, dovuto alla diminuizione delle isomerizzazioni trans-gauche e, quindi, alla tendenza del tratto prossimaledelle catene alifatiche ad assumere di preferenza la configurazione trans, anche se non si manifesta mai laconfigurazione all trans tipica dello stato cristallino. Tuttavia, per concentrazioni di colesterolo superiori al 25%, lalunghezza delle catene si riduce a causa dell'impaccamento delle catene dei fosfolipidi del foglietto opposto, chesono disposti di fronte alle molecole del colesterolo. Queste coppie opposte colesterolo-fosfolipidi sono più cortedelle coppie opposte fosfolipidi-fosfolipidi.
Permeabilità della Membrana CellulareLa membrana plasmatica è una barriera selettivamente permeabile tra il citoplasma e l'ambiente extracellulare.Questa caratteristica è conseguenza della composizione lipidica e proteica della membrana. Il doppio stratofosfolipidico permette il libero passaggio, dell'acqua, di gas (O2, CO2) e di piccole molecole liposolubili (prive dicarica), come ammoniaca, urea, etanolo e glicerolo, mentre specifiche proteine di trasporto assicurano il passaggio diioni e molecole idrosolubili (elettricamente cariche).Il passaggio attraverso la componente lipidica della membrana avviene per semplice diffusione passiva, secondo il gradiente di concentrazione tra i compartimenti intra- ed extracellulare e senza consumo di energia (ATP). Il movimento delle molecole è diretto dal compartimento a più alta concentrazione a quello a concentrazione più bassa ed è influenzato dalle dimensioni e dalla lipofilia della molecola. Ad esempio, la dietilurea, che è 50 volte più idrofobica dell'urea, diffonde attraverso la membrana cellulare 50 volte più velocemente di questa, nonostante le maggiori dimensioni. Secondo la teoria del mobile kink il passaggio delle molecole attraverso il doppio strato lipidico avverrebbe attraverso gli spazi tra le catene degli acidi grassi dei fosfolipidi. La formazione di questi spazi è favorita dalla mobilità, dalla isomerizzazione trans-gauche e dalla

Membrana cellulare 7
presenza di insaturazioni, che causano una piegatura o inginocchiamento (kink) dell'acido grasso. Di conseguenza, lamassima resistenza alla diffusione delle molecole lipofile corrisponde al segmento prossimale delle catene degliacidi grassi, che presentano una minore mobilità (o maggiore rigidità), mentre la resistenza minore corrisponde alsegmento terminale delle catene, che, al contrario, manifesta la massima mobilità.La maggioranza delle molecole attraversa la membrana plasmatica con l'aiuto di proteine di trasporto. Oltre allemolecole idrosolubili, anche alcune molecole liposolubili, come l'urea, si avvalgono anche del trasporto mediatodalle proteine, con lo scopo di potenziarne il passaggio, qualora siano presenti particolari necessità funzionali, comesi verifica nei tubuli renali. Si riconoscono diversi tipi di trasporto mediato da proteine: → trasporto passivo, cheavviene secondo gradiente e perciò senza dispendio di energia, e → trasporto attivo, che avviene contro gradiente eperciò con dispendio di energia. Si distinguono inoltre uniporto, simporto e antiporto. Nell'uniporto si ha il trasportodi un'unica specie di soluto. Nel simporto e nell'antiporto si ha il trasporto accoppiato di due diverse specie di soluti:nel simporto il trasporto dei due soluti avviene nella stessa direzione, mentre nell'antiporto avviene in direzioneopposta.Nel trasporto passivo il passaggio di una molecola idrosolubile (uniporto) avviene per diffusione secondo il gradientedi concentrazione e, nel caso di molecole elettricamente cariche, anche secondo il gradiente elettrico. Tuttavia, adifferenza di quanto accade nella diffusione passiva delle molecole liposolubili, in questo caso la diffusione èfacilitata dall'intervento di proteine. Due classi di proteine sono responsabili del trasporto passivo, i carriers e icanali.I carriers mediano il trasporto di glucidi, aminoacidi e nucleosidi. Una volta legato il soluto nel compartimento adalta concentrazione, il carrier va incontro ad un cambiamento conformazionale che permette il trasferimento delsoluto nel compartimento a bassa concentrazione.Nel caso dei canali, le proteine formano dei pori nella membrana plasmatica, che consentono la diffusione di ioni odi piccole molecole idrosolubili di idoneo peso molecolare e carica elettrica. Fanno parte dei canali le acquaporine,che favoriscono il passaggio di molecole di acqua.L'apertura dei canali può essere regolata da recettori (canali ROC o Receptor Operated Channels), da secondimessaggeri (canali SMOC o Second Messenger Operated Channels) o dal potenziale elettrico della membrana(canali VOC o Voltage Operated Channels), cosicché il passaggio può essere finemente modulato. Ne è un chiaroesempio la complessa famiglia dei canali del calcio, la cui complessità è in relazione con il ruolo determinante che ilcalcio intracellulare ha nel controllo di un'ampia serie di funzioni cellulari. I canali delle gap junctions permettono ilpassaggio di molecole da una cellula all'altra.Nel trasporto attivo le proteine trasportano i soluti contro il gradiente elettrochimico, utilizzando l'energia ottenutadall'idrolisi dell'ATP, per cui queste proteine sono dotate di attività enzimatica (ATPasi). Le pompe trasportano ioni,mentre i trasportatori ABC (ATP-binding cassettes) trasportano un'ampia gamma di molecole, compresi glucidi,aminoacidi e ioni. Il legame dell'ATP alla proteina di trasporto permette il cambiamento conformazionale necessarioal trasferimento del soluto.Nel trasporto attivo secondario, l'energia necessaria al trasporto di un soluto contro il suo gradiente di concentrazionenon è fornita direttamente dall'ATP, ma dall'esistenza di un gradiente elettrochimico del Na+ (o di H+) prodotto dallarispettiva pompa ionica. Il trasporto attivo secondario è quindi indirettamente accoppiato ad un sistema di trasportoattivo primario, che genera il gradiente elettrochimico.Nel trasporto attivo secondario si ha, quindi, il trasporto accoppiato di due diverse specie di soluti: il Na+ (o H+) ètrasportato passivamente dall'ambiente a concentrazione elevata al compartimento a bassa concentrazione, mentrel'altro soluto è trasportato, sempre passivamente, contro il gradiente di concentrazione dal compartimento a bassaconcentrazione verso quello ad alta concentrazione. Nel simporto il trasporto dei due soluti avviene nella stessadirezione, mentre nell'antiporto avviene in direzione opposta. Anche in questo caso il trasferimento dei soluti avvienegrazie al cambiamento conformazionale della proteina trasportatrice, che è indotto dal legame dei soluti stessi.

Membrana cellulare 8
Bibliografia• Alberts, Bruce: Molecular Biology of the Cell [1], 2002 4th ed.
Voci correlate• Cellula• Membrana interna
Altri progetti
• Wikimedia Commons contiene file multimediali su Membrana cellulare
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Note[1] http:/ / www. ncbi. nlm. nih. gov/ books/ bv. fcgi?call=bv. View. . ShowTOC& rid=mboc4. TOC& depth=10

Modello a mosaico fluido 9
Modello a mosaico fluidoIl modello a mosaico fluido è un modello della struttura della → membrana cellulare. Proposto nel 1972 da Singer eNicolson, detto anche modello Singer-Nicolson, ipotizza che la membrana cellulare sia composta da un doppiostrato lipidico nel quale sono immerse le proteine che svolgono la gran parte delle funzioni tipiche della membrana.
Essendo i lipidi costituenti della membrana dei fluidi, le proteine che vi si trovano immerse presentano un notevolegrado di mobilità. Se inizialmente il modello prevedeva una distribuzione casuale delle proteine dando loro ampialibertà di movimento, questi è stato successivamente rivisto (da Simon e Ikonen, nel 1997) in favore di un modello dimembrana in cui all'interno del doppio strato lipidico fluido esistano zone rese meno fluide dalla presenza disfingolipidi e colesterolo allo stato liquido che agirebbero come piattaforme per la genesi di segnali intracellulariconcentrandovi proteine specifiche. La mobilità delle proteine può essere inoltre ulteriormente ristretta sia dai legamiproteina-proteina o proteina-lipidi, sia dalle interazioni delle proteine con il citoscheletro, con la matriceextracellulare o con cellule adiacenti.Il modello a mosaico fluido ha sostituito quello precedente (Danielli e Davson, 1935, quindi Robertson, 1959) notocome modello di unità di membrana, ipotizzato partendo dalle immagini ottenute al microscopio elettronico cheevocavano una sorta di binario ferroviario, secondo il quale la membrana cellulare avrebbe avuto una struttura a trelamine, con due strati esterni di natura proteica con configurazione beta ed uno strato intermedio lipidico per unospessore complessivo di circa 75Å. Lo strato lipidico intermedio è composto da un doppio foglietto fosfolipidico; inciascum foglietto, i fosfolipidi sono disposti in modo tale che le code idrofobe sono rivolte all'interno del doppiofoglietto e le teste idrofile sono orientate all'esterno. La prima indicazione che i lipidi delle membrane biologichesono organizzati in un doppio strato risale al 1925, quando Garter e Grendel dimostrarono che i lipidi estratti conacetone dalla membrana plasmatica dei globuli rossi (l’unica membrana presente negli eritrociti) occupavano unasuperficie doppia rispetto a quella dell’intera cellula. Il modello di unità di membrana così ipotizzato è peròinconciliabile con i principi della termodinamica, in quanto i gruppi apolari degli amminoacidi delle proteinesarebbero esposti all'acqua, mentre le estremità polari dei lipidi non sarebbero in contatto con l'acqua.

Modello a mosaico fluido 10
La fluidità della membrana cellulare è stata dimostrata con un esperimento di Edidin e Frye (1970), in cui celluleumane e cellule di topo sono state fatte fondere (con l'utilizzo di un virus) in modo da ottenere un'unica cellulaibrida. All'inizio dell'esperimento, le proteine umane e di topo, marcate con anticorpi, erano presenti solo nellerispettive parti originarie della cellula unita ma, 40 minuti dopo, le proteine erano distribuite uniformementesull'intera membrana.Il modello a mosaico fluido, oltre che essere in accordo con i principi della termodinamica, è stato confermato contecniche sofisticate, come la diffrazione a raggi X e la microscopia elettronica con crio-decappaggio(freeze-fracturing), in cui la frattura del campione congelato percorre il doppio strato lipidico, che rappresenta ilpunto di minore resistenza. La tecnica di freeze-fracturing consente anche un’analisi particolareggiata delladistribuzione delle proteine di membrana, che appaiono come gibbosità o depressioni.
Voci correlate• cellula

Composizione della membrana cellulare 11
Composizione della membrana cellulareLa composizione della membrana cellulare consta, essenzialmente, di una grande quantità di lipidi (in particolarefosfolipidi). Nella componente lipidica si trovano numerose proteine, aventi importanti funzioni fisiologiche. Siriscontra anche una piccola percentuale di glucidi, in forma di glicoproteine e glicolipidi, e di molecole di colesteroloche stabilizzano la membrana.
Lipidi della membrana cellulareI lipidi costituiscono circa il 50% della massa della membrana plasmatica, pur essendo molto più numerosi delleproteine (circa 50 molecole lipidiche per ogni proteina). Le tre principali classi di lipidi delle membrane sono:fosfolipidi (70% del peso lipidico totale), colesterolo (20%) e glicolipidi (5%). I principali fosfolipidi di membranasono: fosfatidilcolina, fosfatidilserina, fosfatidiletanolamina e sfingomielina; complessivamente queste quattro specielipidiche costituiscono oltre il 50% dei lipidi di membrana. Altri fosfolipidi, come fosfatidilinositolo, sono presentiin piccole quantità, ma svolgono un ruolo cruciale nella genesi dei segnali intracellulari. I plasmalogeni,principalmente plasmenilcolina e plasmeniletanolammina, costituiscono circa il 18% dei fosfolipidi delle membrane,con preferenza per le cellule eccitabili: cellule miocardiche, cellule muscolari striate e cellule nervose.
Struttura dei fosfolipidi
Lipidi di membrana(eritrociti)
%(peso) Monostrato esterno Monostratointerno
Colesterolo 23% 50% 50%
Fosfatidilinositolo 1% - -
Fosfatidiletanolammina 18% 20% 80%
Fosfatidilcolina 17% 80% 20%
Fosfatidilserina 7% - 100%
Sfingomielina 18% 90% 10%
Glicolipidi 3% 100% -

Composizione della membrana cellulare 12
Altri
Plasmalogeni
Acidi grassi liberi
Colesterolo esterificato
13% - -
I lipidi di membrana sono molecole anfipatiche, cioè manifestano proprietà sia idrofobiche che idrofiliche. La naturaanfipatica è dovuta alla presenza di una estremità polare idrofila (testa), formata dall'acido ortofosforico (PO4), a cuisi aggiungono gruppi ossidrilico (OH), carbossilico (COOH), aminico (NH2) o ione ammonico quaternario(N+(CH3)3) del radicale legato all'ortofosfato, e di una estremità apolare idrofoba (coda) formata dalle catenealifatiche degli acidi grassi o dal → nucleo ciclopentanoperiidrofenantrenico del colesterolo.
La disposizione dei fosfolipidi all'interno della membrana
A causa della natura anfipatica, i fosfolipidie i glicolipidi formano lamine bimolecolari.In ciascun monostrato i lipidi sono allineatitra loro, con le teste polari dirette all'esterno,verso l'ambiente acquoso, e con le codeidrofobiche rivolte verso l'interno del doppiostrato. L'associazione tra le molecolelipidiche è sostenuta da legami elettrostatici(dipolari e idrogeno) tra le teste e dai debolilegami di Van der Waals tra le catenealifatiche (dipolo indotto-dipolo indotto).
I lipidi di membrana svolgono una funzionestrutturale, costituendo l'impalcatura fondamentale della membrana plasmatica; una funzione di barrierasemipermeabile, che si lascia attraversare liberamente dalle molecole liposolubili, ma risulta impenetrabile da quelleidrosolubili; una funzione metabolica, in quanto rappresentano una fonte di mediatori lipidici, che possono esseremobilizzati in risposta agli stimoli esterni:inositol-1,4,5-trifosfato (IP3), diacilglicerolo (DAG), acido fosfatidico(PA), liso-PAF (lyso-platelet-activating factor), ceramidi.
Sebbene la funzione dei plasmalogeni non sia del tutto chiarita, si ritiene che questi lipidi possano proteggere lemembrane dallo stress ossidativo, agendo come antiossidanti endogeni, in quanto il legame vinilico è in grado dilegare radicali liberi (effetto scavenger o spazzino). Altre funzioni che sono state attribuite ai plasmalogeni dimembrana includono la modulazione della fluidità di membrana e la partecipazione negli eventi di fusione tra lemembrane cellulari, grazie alla loro propensione a formare fasi esagonali.Un cenno particolare richiede il fosfatidilinositolo, perché è il precursore di importanti composti fosforilati dimembrana: fosfatidilinositolo-monofosfati [PI-3-P, PI-4-P (PIP), PI-5-P]; fosfatidilinositolo-bifosfati [PI-3,4-P2,PI-4,5-P2 (PIP2), PI-3,5-P2]; fosfatidilinositolo-trifosfato [PI-3,4,5-P3 (PIP3)]; PIP e PIP2 sono i più abbondanti, dalmomento che costituiscono circa il 60% del totale dei fosfatidilinositol-fosfati. PI-4,5-P2 ha una notevole importanzaperché da un lato da esso deriva l'inositol-1,4,5-trifosfato (IP3), un secondo messaggero solubile prodotto dallefosfolipasi C (PLC), dall'altro interagisce, nelle membrane, con numerose proteine, modulandone la funzione.

Composizione della membrana cellulare 13
Le proteine della membrana cellulareLe proteine sono immerse nel "mare" lipidico e svolgono una serie di importanti funzioni:1. funzione di trasporto di ioni e molecole1!!!!2. funzione recettoriale, permettendo il riconoscimento di segnali extracellulari;3. funzione enzimatica, con la generazione di segnali intracellulari, utilizzando le componenti lipidiche delle
membrana;4. funzione di collegamento, fungendo da intermediari nella interazione funzionale tra due proteine (per es. fra
recettore ed enzima);5. funzione strutturale e meccanica, costituendo punti di ancoraggio per strutture extra- e/o intra-cellulari.Dal punto di vista strutturale, le proteine, in base alle caratteristiche della loro estrazione dalla membrana, possonoessere distinte in due tipi: proteine integrali e periferiche. Le differenze nelle modalità di isolamento riflettono lecaratteristiche dell'inserimento delle proteine nella membrana.
Proteine integraliLe proteine integrali necessitano, per essere isolate, di trattamenti drastici, che scompaginano la struttura stessa dellamembrana cellulare.Le proteine integrali possono essere distinte in transmembranose, intramembranose e proteine con ancore lipidiche.Infatti, le proteine integrali possono attraversare il doppio stato lipidico completamente una o più volte (proteinetransmembranose bi- o poli-topiche), oppure possono attraversarlo parzialmente, emergendo con entrambe leestremità dallo stesso versante, citoplasmatico o extracellulare, della membrana (proteine intramembranosemonotopiche). Le proteine transmembranose possono essere indicate come tipo I o II, a seconda che la loro estremitàC-terminale sia intra- o extra-cellulare.I segmenti proteici che attraversano il doppio strato lipidico sono composti principalmente da aminoacidi non polari(idrofobici), soprattutto glicina, leucina, isoleucina, alanina e valina. Poiché i legami peptidici ( -CO-NH+) tra gliaminoacidi che costituiscono la catena proteica sono essi stessi polari, i segmenti intramembranosi assumono diregola una configurazione ad alfa elica, in modo tale che tutti i legami peptidici possono formare tra loro legamiidrogeno (O- ••••• H+) riducendo la polarità del segmento intramembranoso.Una classe importante di proteine integrali contiene catene lipidiche legate covalentemente alla catena peptidica(lipid-anchored proteins). I gruppi lipidici sono utilizzati come ancore che si inseriscono nella membrana cellulare.Questi gruppi comprendono: acidi grassi (palmitico e miristico), isoprenoidi (farnesilpirofosfato egeranilgeranilpirofosfato) o glicosilfosfatidilinositolo (GPI, molecola complessa formata da fosfatidilinositolo eoligosaccaridi). Le proteine palmitoilate e miristoilate e quelle GPI-legate si distribuiscono di preferenza nei rafts, inquanto le loro catene lipidiche sature hanno una conformazione particolarmente adatta ad essere accolta nei dominilipidici allo stato liquido-ordinato. Al contrario, le proteine isoprenilate, che hanno catene lipidiche ramificate evoluminose, non idonee per i domini allo stato liquido-ordinato, si distribuiscono di preferenza nelle regioni dellamembrana più fluide (stato liquido-cristallino). Le proteine GPI-legate sono localizzate esclusivamente nel fogliettoesterno della membrana cellulare, mentre quelle legate ad acidi grassi o isoprenoidi sono presenti unicamente nelfoglietto interno. Gli acidi grassi e gli isoprenoidi sono legati alla molecola peptidica tramite legame estere con ilgruppo tiolico della cisteina. L'idrolisi del legame estere da parte di enzimi specifici permette di regolarel'associazione di queste proteine al versante → citoplasmatico della membrana cellulare e quindi di controllarne lacompartimentazione fra citoplasma e membrana.

Composizione della membrana cellulare 14
Proteine perifericheLe proteine periferiche possono essere isolate più facilmente dalla membrana, attraverso trattamenti blandi (es.variazioni del pH o della forza ionica del mezzo).Ciò è legato al fatto che le proteine periferiche non si inseriscono nel doppio strato lipidico, ma si associano alla suasuperficie, intra- o extra-cellulare, interagendo con la la testa polare dei lipidi o con le proteine integrali. Fanno partedelle proteine periferiche associate con la faccia citoplasmatica della membrana cellulare alcuni enzimi e le proteinedel citoscheletro spectrina e actina. Le proteine che contengono domini PH (Pleckstrin Homology), come lefosfolipasi C (PLC), si legano ai derivati fosforilati dei fosfatidilinositoli. Le proteine provviste di domini C2(protein kinase C domain 2) aderiscono tramite ponti di Ca+2 a fosfolipidi anionici (fosfatidilserina efosfatidilinositolo). La presenza di domini SH (Src Homology) consente alle proteine citoplasmatiche di associarsi airesidui tirosinfosforilati di proteine di membrana, in particolare dei recettori di membrana con attivitàtirosinchinasica.Una proprietà delle proteine periferiche consiste nella possibilità che la loro associazione con la membrana possaessere transitoria e soggetta a regolazione, ad esempio dalla attivazione delle proteine stesse o dei substrati ai qualiesse aderiscono. Grazie a questa regolazione le proteine periferiche possono spostarsi fra citoplasma e membranaplasmatica a seconda delle necessità funzionali della cellula. Alcuni enzimi, come la proteinchinasi C (PKC), silegano alla membrana in risposta alla attivazione da parte del Ca2+ intracellulare.
Asimmetria della membrana cellulare
Asimmetria della membrana plasmatica
La composizione dei due foglietti, esterno einterno, della membrana cellulare presentanotevoli differenze, non solo nellacomponente proteica, ma anche nella stessacomponente lipidica, per cui la membranaplasmatica è caratterizzata da una marcataasimmetria, che riflette le differenti funzionidei due monostrati.In primo luogo i glucidi (oligosaccaridi),che sono presenti nella membranaplasmatica in forma di glico-proteine eglico-lipidi, sono situati nel solo fogliettoesterno, in contatto dell'ambienteextracellulare, dove possono svolgere unafunzione recettoriale, in particolare neiprocessi di adesione tra le cellule, oppureuna funzione protettiva, formando uno strato (glicocalice) che riveste esternamente la membrana plasmatica,proteggendola dagli insulti meccanici e chimici.
Per quanto riguarda i lipidi, oltre 80% delle molecole che nella testa polare contengono colina(-(CH3)3N+CH2CH2OH-), precisamente fosfatidilcolina (PC) e sfingomielina (SP), sono situate nel monostratoesterno della membrana, mentre circa il 90% dei lipidi con teste senza carica netta (fosfatidiletanolamina, PE) o concarica netta negativa (fosfatidilserina (PS) e fosfatidilinositolo), sono localizzati di preferenza nel monostratointerno. Ciò comporta una prevalenza di cariche negative sul versante citoplasmatico della membrana cellulare.

Composizione della membrana cellulare 15
Origine dell'asimmetriaL'asimmetria dei fosfolipidi di membrana è generata durante la sintesi della membrana nel → reticoloendoplasmatico, nel quale carriers (proteine trasportatrici) di fosfolipidi trasportano specifici fosfolipidi da unmonostrato all'altro. Una volta che le neomembrane hanno raggiunto la superficie cellulare, l'asimmetria deifosfolipidi è mantenuta dalla attività coordinata di specifici meccanismi di trasporto.Sono stati identificati almeno tre meccanismi.• La traslocasi ATP-dipendente specifica per gli aminofosfolipidi (o flippasi), trasporta rapidamente
fosfatidiletanolamina e soprattutto fosfatidilserina dal monostrato esterno a quello interno.• La floppasi ATP-dipendente non specifica trasporta lentamente e senza specificità fosfolipidi dal monostrato
interno a quello esterno. La floppasi è un membro della superfamiglia ABC di proteine trasportatrici, un gruppo diproteine specializzate nel trasporto ATP-dipendente di molecole anfipatiche. Fa parte di questa famiglia laproteina ABCA1, responsabile del trasferimento del colesterolo dalla membrana plasmatica alle HDL.
• La scramblase (dall'inglese to scramble, mescolare), una proteina Ca2+-dipendente non specifica, che consente aifosfolipidi di muoversi casualmente tra i due monostrati.
I primi due meccanismi lavorano in concerto per mantenere la distribuzione asimmetrica dei fosfolipidi, mentre ilterzo meccanismo agisce in senso antagonista ai precedenti, provocando un rapido passaggio dei fosfolipidi da unmonostrato all'altro, tanto da generare una distribuzione quasi simmetrica dei fosfolipidi di membrana.In presenza difisiologiche concentrazioni intracellulari di Ca2+, la flippasi e la floppasi sono attive e mantengono la normaleasimmetria di membrana. La loro inibizione arresta il trasporto attivo di fosfolipidi tra i foglietti della membrana, maper alcuni giorni, in vitro, non risulta nella perdita della asimmetria.Al contrario, l'elevazione della concentrazioneintracellulare di Ca2+ attiva la scramblase Ca2+-dipendente e inibisce l'attività degli altri due trasportatori, per cuirisulta una rapida e casuale ridistribuzione dei fosfolipidi, che compromette l'asimmetria della membrana.
Ruolo dell'asimmetria di membranaL'asimmetria di membrana ha un ruolo importante nella funzionalità cellulare.La prevalenza dei fosfolipidi contenenti etanolammina (fosfatidiletanolammina e plasmeniletanolammina) nelfoglietto interno della membrana e dei colino-fosfolipidi nel foglietto esterno potrebbe influenzare i processi di endo-ed eso-citosi, dal momento che gli etanolammino-fosfolipidi hanno predilezione per la fase HII (vedi vocefosfolipidi), mentre i colino-fosfolipidi per la fase lamellare.Inoltre, alcune proteine periferiche (PKC, annessina, spectrina) si fissano alla superficie citosolica della membranagrazie alla interazione con la fosfatidilserina.La perdita della asimmetria provoca un aumento degli aminofosfolipidi, in particolare della fosfatidilserina, sullasuperficie cellulare, con notevoli conseguenze per la fisiologia cellulare. La trasformazione della membranaplasmatica delle piastrine in una superficie procoagulante è causata dalla alterazione della asimmetria dei fosfolipidi,che comporta un'eccessiva presenza di fosfatidilserina sul foglietto esterno; ciò promuove la coagulazione e latrombosi, aumentando la formazione di trombina di oltre un milione di volte. L'esposizione della fosfatidilserinafornisce una superficie catalitica per l'assemblaggio dei complessi enzimatici: protrombinasi (complesso dei FattoriVa e Xa che catalizza la conversione di protrombina in trombina) e tenasi (complesso attivante il Fattore X,composto dai Fattori IXa e VIIIa).Inoltre, l'esposizione della fosfatidilserina nel monostrato esterno rende la cellula riconoscibile ed eliminabile daifagociti del sistema reticoloendoteliale.

16
TRASPORTO DI MEMBRANA
Trasporto di membranaCon il termine trasporto di membrana ci si riferisce a diversi processi attraverso i quali la cellula è in grado dipermettere l'attraversamento delle → membrane biologiche alle molecole che non sono in grado di diffonderviautonomamente.
Le membrane biologicheLa membrana cellulare è deputata allo svolgimento di almeno quattro importanti funzioni:• permettere il passaggio selettivo delle molecole destinate ad entrare all’interno della cellula (ad esempio ossigeno,
glucosio o altre sostanze coinvolte nel rifornimento energetico);• consentire l’uscita verso la matrice extracellulare delle sostanze da eliminare, che possono essere tossiche per la
cellula;• impedire che agenti esterni possano danneggiare fisicamente i componenti interni della cellula;• mantenere costante il pH del citosol.
Composizione e struttura della membranaLe membrane cellulari, sono costituite essenzialmente da un doppio strato di lipidi. I lipidi che concorrono allaformazione del doppio strato lipidico, sono: fosfolipidi, steroli, glicerofosfolipidi e sfingolipidi.• I fosfolipidi, costituiti da una coda carboniosa (apolare o idrofobica) e da una testa polare (idrofila), si
dispongono secondo uno schema coda-coda, minimizzando il contatto con le molecole polari come l’acqua. Leteste polari (possono formare un legame idrogeno) sono rivolte verso l’ambiente acquoso extracellulare edintracellulare.
• Gli steroli concorrono al controllo della fluidità delle membrane in funzione della temperatura di transizione.Nelle membrane cellulari sono presenti anche numerose proteine, in quantità notevolmente minore a quella dei lipidi.Rispetto alla porzione lipidica, tuttavia, tali molecole hanno solitamente funzioni non semplicemente strutturali. Esseinfatti possono permettere la comunicazione con l’ambiente extracellulare e consentire il passaggio di molecolespecifiche.
Comunicazione con l’ambiente extracellulare
Le cellule, necessitano di comunicare con l’ambiente extracellulare, in modo da organizzare al loro interno le attivitàmolecolari che possono regolare un determinato processo o evento biochimico. Tale comunicazione può avveniretramite segnali molecolari, che vengono trasportati da molecole segnale specifiche come ormoni o proteine. Sullafaccia esterna della membrana cellulare sono presenti numerose proteine che svolgono la funzione di recettore,affinché queste molecole segnale vengano riconosciute della cellula. Ogni recettore, ha una conformazioneparticolare e specifica, capace di accogliere e di stabilire dei legami solo con una determinata molecola segnale.

Trasporto di membrana 17
Passaggio di molecole specifiche
Le cellule, sono in grado di selezionare le molecole che devono entrare all’interno della cellula affinché possanosoddisfare le esigenze nutrizionali e mantenere l'omeostasi cellulare: il mantenimento costante del pH, ad esempio, ègarantito grazie all’entrata di ioni H+ e ioni OH-. Il passaggio di sostanze specifiche è consentito da specifici canaliproteici, o semplicemente per diffusione di sostanze lipidiche attraverso la membrana. Pertanto, è possibiledistinguere due tipi di trasporti delle sostanze differenti: trasporto passivo e trasporto attivo.
Trasporto passivoIl trasporto passivo consiste nel passaggio di molecole secondo gradiente. Per tale passaggio non è richiesto l’utilizzodi energia biochimica (come ATP). Esso può essere mediato da proteine di membrana. Questo tipo di trasporto puòessere di tre tipi differenti: diffusione semplice, diffusione facilitata, osmosi.
Diffusione sempliceLa diffusione semplice è un tipo di trasporto che non necessita di nessun sistema proteico. È definito semplice perchéle molecole che sfruttano questo trasporto sono tutte apolari, cioè capaci di diffondere attraverso il doppio stratolipidico (anch’esso apolare). Tali molecole hanno solitamente le caratteristiche dei lipidi. In questo tipo di trasporto,il gradiente di concentrazione è favorevole, ed è di segno positivo. Non c'è pertanto una spesa energetica in terminidi ATP per spingere la molecola dall’altra parte della membrana.
Diffusione facilitataLa diffusione facilitata differisce da quella semplice perché sono presenti delle proteine trasportatrici, proteine dimembrana che facilitano ed aumentano la velocità del passaggio di una determinata molecola, attraverso laformazione di legami deboli, necessari per facilitare il rilascio della molecola dall’altra parte della membrana. Inquesto tipo di trasporto, il gradiente di concentrazione è favorevole, ed è di segno positivo, pertanto non c’è unaspesa energetica (in termini di ATP) per spingere la molecola dall’altra parte della membrana.
OsmosiQuando una membrana non fa passare le molecole di soluto ma solo quelle di solvente (che nel caso delle membranebiologiche è acqua) allora la membrana si dice semipermeabile per quel soluto specifico. La membrana plasmatica,ad esempio, è semipermeabile per molti soluti. Quando esiste un gradiente di concentrazione ai lati di una membranasemipermeabile le molecole di soluto non possono diffondere dall'area a concentrazione maggiore a quella aconcentrazione minore. Si assiste, dunque, al fenomeno dell'osmosi, cioè al passaggio delle molecole di solventedall'area a minor concentrazione di soluto a quella a maggior concentrazione di soluto, in modo da diluire lasoluzione più concentrata e annullare il gradiente di concentrazione.
Trasporto attivoIl trasporto attivo permette il passaggio di soluti contro gradiente di concentrazione. Tale passaggio è mediato daproteine di membrana che richiedono l’utilizzo di energia biochimica (ATP). Questo tipo di trasporto può essereulteriormente suddiviso in diverse tipologie: trasporto attivo primario e trasporto attivo secondario.
Trasporto attivo primario

Trasporto di membrana 18
Scissione dell'ATP in ADP e fosfato inorganico
Il trasporto attivo primario è mediato da proteine di membranatrasportatrici di soluti. Si occupa di trasferire molecole contro ungradiente di concentrazione, richiedendo la presenza di ATP (siverifica quindi una spesa energetica). Il trasporto attivo primario è ingrado di generare un gradiente di concentrazione ed un gradiente elettrico a cavallo della → membrana cellulare(come avviene, ad esempio, quando vengono traspostati degli ioni). Lo spostamento di un soluto dall’altra parte dellamembrana, ad opera della proteina di membrana, è strettamente legato alla reazione esoergonica della conversionedell’ATP in ADP e fosfato inorganico..
Trasporto attivo secondarioSi parla di trasporto attivo secondario quando il trasporto di una molecola (A) contro gradiente è permesso dalgradiente di un'altra molecola (B) precedentemente creato da un trasporto attivo primario. Infatti è necessario che siverifichi prima il trasporto endoergonico (che cioè richiede energia) di B, affinché si accumuli da un lato dellamembrana. Successivamente si verifica il trasporto esoergonico di B nella direzione del gradiente, creatoprecedentemente dal trasporto attivo primario. Tale trasporto esoergonico è solitamente accoppiato al trasportocontro gradiente di A. Tale accoppiamento è definito cotrasporto ed è realizzato da proteine intrinseche dellamembrana cellulare capaci di riconoscere le molecole A e B. Solitamente B è uno ione, sodio o protone, che vienechiamato ione trainante (driver).Esistono due tipi di cotrasporto: antiporto e simporto.• L’antiporto, consente il passaggio contemporaneo ma in direzioni opposte di due ioni differenti.• Il simporto, consente il passaggio contemporaneo ma nella stessa direzione di due ioni differenti.
Esempi di trasporti attiviTra i trasporti attivi (cioè ATP dipendenti) figurano:• Na+/K+ antiporto;• Ca2+;• H+;• H+/K+ antiporto.Tra i trasporti secondari figurano:• Na+/glucosio simporto;• Na+/amminoacidi simporto;• Na+/Ca2+ antiporto;• Na+/H+ antiporto.
Voci correlate• Endocitosi• Esocitosi• Acquaporine• → Trasportatore di membrana

Trasporto di membrana 19
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Trasporto passivo
Alcune delle possibilità di movimento di molecole tra → citoplasma (1) e spazioextracellulare (2).Trasporto passivo:
- A. Diffusione- B. → Diffusione facilitata
Trasporto attivo:D. Trasporto primario (contro gradiente)
C.-E. Trasporto secondario:- C. Uniporto- E. Simporto
Esocitosi/Endocitosi:F.-G. Esocitosi
Il trasporto passivo è una modalità dimovimento di sostanze chimiche attraversomembrane biologiche tramite diffusione(molecole idrofobiche) o → diffusionefacilitata (molecole idrofile). A differenzadel → trasporto attivo, questo processo nonrichiede il rilascio di energia chimica(idrolisi di ATP) poiché, a differenza deltrasporto attivo, riduce l'energia libera eaccresce l'entropia del sistema.
Il trasporto passivo è dipendente dallapermeabilità della membrana cellulare che, asua volta, dipende dalla sua composizione inlipidi e proteine.
I quattro tipi principali di trasporto passivosono la diffusione, la → diffusione facilitata,la filtrazione e l'osmosi.
Diffusione
La diffusione è il trasporto di materiale daun'area in cui esso è presente ad altaconcentrazione verso una a più bassaconcentrazione. La differenza diconcentrazione tra le due aree è spesso

Trasporto passivo 20
chiamata gradiente di concentrazione. La diffusione continua finché questo gradiente non viene eliminato, perquesto il suo lavoro è detto "secondo il gradiente di concentrazione" (al contrario del → trasporto attivo, che spessomuove materiale da un'area a bassa concentrazione verso una a più alta concentrazione cioè contro gradiente diconcentrazione).Se e quando il gradiente di concentrazione è stato eliminato, non avviene altro scambio di materiale. Nonostantesingole molecole continuino a muoversi da un'area all'altra, i trasferimenti sono bilanciati dai movimenti di altromateriale nella direzione opposta.La diffusione è fisiologicamente importante perché permette l'abolizione dei gradienti di concentrazione nel corpo.Ad esempio, l'attività metabolica consuma ossigeno, che riduce la propria concentrazione nel sangue; la diffusione diossigeno attraverso gli alveoli polmonari ne permette però il ripristino.
Diffusione facilitataLa diffusione facilitata è il movimento di molecole attraverso la membrana cellulare tramite particolari →trasportatori di membrana, proteine integrate nella → membrana cellulare che formano dei canali. Molte molecole digrandi dimensioni, come il glucosio, sono insolubili nei lipidi e troppo grandi per passare attraverso i pori dellemembrane. Per poter attraversare la membrana queste molecole si legano con specifiche proteine di trasporto, quindiquesto complesso viene legato ad un sito recettore e trasportato attraverso la membrana cellulare. A seconda delgradiente di concentrazione, il trasporto netto di sostanza avverrà in un senso o nell'altro: la diffusione facilitata èquindi sempre un processo passivo, che non richiede cioè un dispendio di energia.
FiltrazioneLa filtrazione è il trasporto di acqua e molecole di soluto attraverso la membrana cellulare, dovuto alla pressioneidrostatica generata dal sistema cardiovascolare. A seconda del diametro dei pori delle membrane, possono esseretrasportate solo molecole di soluto di una determinata grandezza. Ad esempio, i pori di membrana della capsula diBowman (nei reni) sono molto stretti e soltanto l'albumina, la più piccola delle proteine, ha qualche possibilità difiltrare attraverso di essi. D'altra parte i pori di membrana del fegato sono molto ampi, per permettere lametabolizzazione di una grande varietà di soluti.
OsmosiL'osmosi è la diffusione di un solvente attraverso una membrana verso una regione ad alta concentrazione di soluto.Differisce dalla diffusione nel fatto che a muoversi è il solvente e non il soluto, tuttavia segue lo stesso principio percui si tende a cancellare un gradiente di concentrazione. Negli organismi viventi il solvente è l'acqua e la maggiorparte delle → membrane cellulari è permeabile all'acqua. In sistemi biologici quindi osmosi significa passaggio diacqua (diffusione di molecole d'acqua). Questo processo ha un ruolo considerevole nella fisiologia di tutti gli esseriviventi.

Trasporto passivo 21
Voci correlate• → Trasporto attivo• → Trasportatore di membrana
Collegamenti esterni• (EN) Confronto tra trasporto attivo e passivo [1]
• (EN) Modello di diffusione facilitata attraverso cambiamento conformazionale del trasportatore [2]
• (EN) Modello di diffusione facilitata del glucosio [3]
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Note[1] http:/ / www. ncbi. nlm. nih. gov/ entrez/ query. fcgi?cmd=Search& db=books& doptcmdl=GenBookHL& term=passive+ transport+ AND+
mboc4%5Bbook%5D+ AND+ 373333%5Buid%5D& rid=mboc4. figgrp. 1995[2] http:/ / www. ncbi. nlm. nih. gov/ entrez/ query. fcgi?cmd=Search& db=books& doptcmdl=GenBookHL& term=passive+ transport+ AND+
mboc4%5Bbook%5D+ AND+ 373341%5Buid%5D& rid=mboc4. figgrp. 2000[3] http:/ / www. ncbi. nlm. nih. gov/ books/ bv. fcgi?rid=mcb. figgrp. 4046

Diffusione facilitata 22
Diffusione facilitata
Alcune delle possibilità di movimento di molecole tra → citoplasma (1) e spazioextracellulare (2).Trasporto passivo:
- A. Diffusione- B. Diffusione facilitata
Trasporto attivo:D. Trasporto primario (contro gradiente)
C.-E. Trasporto secondario:- C. Uniporto- E. Simporto
Esocitosi/Endocitosi:F.-G. Esocitosi
La diffusione facilitata è un processo di →trasporto passivo cellulare, simile alladiffusione semplice in quanto non richiedeconsumo di ATP: è un trasporto da una zonaad alta concentrazione di una molecola aduna a concentrazione più bassa, cioèsecondo gradiente; differisce dalladiffusione semplice per alcuni aspetti. Inquesto caso le molecole trasportate non sonoin grado di oltrepassare la membrana inquanto non sono liposolubili e hanno quindibisogno di mezzi che colleghino l’internodella cellula con l’esterno. Questi mezzi sonodetti proteine canale o → trasportatori dimembrana e fungono da “canali” nellamembrana cellulare permettendo così unpassaggio di materiale che altrimenti nonsarebbe potuto avvenire. Il tasso didiffusione non è dato dal numero diparticelle (diffusione semplice) ma da quellodi proteine canale in quanto sono questeultime a determinare le fasi del trasporto.

Trasportatore di membrana 23
Trasportatore di membrana
Pompa del Calcio: differenza di conformazione tra stato inattivo e stato attivo
Un trasportatore di membrana è unpolipeptide transmembrana in grado dimediare il trasporto di ioni o molecole polaridi medie dimensioni (amminoacidi,zuccheri, nucleotidi) all'interno della cellula.La presenza di trasportatori di membrana èindispensabile: solamente alcuni compostisono in grado di diffondere liberamenteattraverso la membrana plasmatica; tutti glialtri hanno bisogno di metodi alternativi perentrare nel → citoplasma. Sebbene esista ungran numero di diversi trasportatori, questipossiedono alcune caratteristiche in comune:
• il trasporto è selettivo per il substrato che deve essere trasportato, e basato su interazioni steriche tra iltrasportatore e la molecola trasportata;
• la traslocazione attraverso la membrana è legata ad un cambiamento conformazionale della proteina trasportatrice,e più specificamente all'apertura/chiusura di un "canale" all'interno del polipeptide;
• il trasporto può richiedere o meno dispendio energetico, dando vita rispettivamente ad un → trasporto attivo o →passivo;
• tutte le molecole trasportatrici conosciute sono proteine transmembrana, che attraversano cioè integralmente lamembrana plasmatica.
Modalità di ingressoL'ingresso nel citoplasma può avvenire in tre modi diversi; la natura del trasporto dipende dalle caratteristichesteriche e chimiche della molecola in questione.1. Le piccole molecole polari (come acqua e etanolo), i gas e le molecole apolari (come gli idrocarburi) possono
diffondere attraverso il doppio strato fosfolipidico della membrana plasmatica. Il meccanismo, soprattutto perquanto concerne il trasporto di acqua, è ancora poco definito.
2. Le macromolecole (come le catene polipeptidiche), i virus, i batteri o frammenti di altre cellule, possono essereinternalizzate solamente tramite processi di endocitosi e fagocitosi. Con un meccanismo simile, detto pinocitosi,la cellula può immagazzinare anche grandi quantità d'acqua.
3. I trasportatori di membrana invece si occupano dell'internalizzazione di ioni, protoni e molecole polari di mediedimensioni, come zuccheri, nucleotidi e aminoacidi.

Trasportatore di membrana 24
Classi di trasportatoriI trasportatori di membrana possono essere suddivisi in quattro classi principali:• ATPasi di trasporto• Canali ionici• Permeasi• CotrasportatoriQueste differiscono per il meccanismo di azione, la localizzazione nella cellula e il tipo di molecola trasportata.
ATPasi di trasportoLe ATPasi di trasporto, dette anche pompe ioniche, sfruttano l'idrolisi di ATP per trasportare ioni o protoni contro ilgradiente di concentrazione. Si suddividono in tre classi, a seconda del meccanismo utilizzato e del substratotrasportato:• ATPasi di tipo P;• ATPasi di tipo F e ATPasi di tipo V.
ATPasi di tipo P
Le ATPasi di tipo P sono deputate principalmente al trasporto di ioni. Sono principalmente composte da un'unicacatena polipeptidica che esplica sia la funzione idrolitica che quella trasportatrice.Vengono dette di tipo P per la presenza di un sito di fosforilazione a livello dell'aspartato, che nelle due diverseforme apre e chiude il canale per lo ione (Na+/K+, H+/K+, Ca++).ATPasi di tipo P sono presenti sia sulla membrana plasmatica che sulla membrana del → reticolo endoplasmatico.
ATPasi di tipo F e di tipo V
Le ATPasi di tipo V e di tipo F sono deputate al trasporto di protoni. Questa classe di ATPasi è strutturalmente piùcomplessa, essendo formata da più subunità proteiche che si assemblano sulla membrana di molti compartimenti edorganelli cellulari. La loro complessità si evince anche dal maggiore peso molecolare, che può superare i 500 kDa. Adifferenza delle ATPasi di tipo P, quelle di tipo V e di tipo F non trasferiscono su un proprio aminoacido un residuodi fosfato.Le ATPasi di tipo F si trovano nei → mitocondri, dove sono responsabili della movimentazione di protoni per lasintesi energetica della cellula.Le ATPasi di tipo V sono presenti sui lisosomi, dove con il trasporto di protoni favorisce l'instaurazione di unambiente idrolizzante acido.
Canali ioniciI canali ionici mediano il trasporto di ioni tra l'ambiente extracellulare ed il → citoplasma o tra compartimenti diversidella cellula. Il trasporto è → passivo e segue il gradiente degli ioni interessati, con una velocità linearmenteproporzionale alla concentrazione più alta presente su uno dei due lati.Il trasporto di ioni non è saturabile, poiché questi non formano legami deboli col trasportatore. Il passaggioattraverso il canale è infatti legato alla dimensione ed alla carica dello ione, perdendo parte della specificità.Esistono due tipi di canali ionici, che differiscono per il tipo di attivazione:• canali ionici ligando dipendenti;• canali ionici voltaggio dipendenti.

Trasportatore di membrana 25
Canali ionici ligando dipendenti
Canale del Na+Acetil-colina dipendente
L'apertura del canale è dovuta all'interazione, in un altro dominio del trasportatore detto"recettoriale", con una molecola estranea al processo ti trasporto detta ligando. Questainterazione provoca un cambiamento conformazionale nella proteina trasportatrice chedetermina l'apertura del canale e l'inizio del trasporto di ioni secondo gradiente.In alcuni casi la proteina recettoriale è diversa da quella canale, ma legata ad essafunzionalmente.I canali ionici prendono il nome dal ligando che li attiva: alcuni esempi sono il canale delNa+-acetilcolina-dipendente, presente sulla membrana plasmatica, e il canale delCa++-fosfatidilinositolo-dipendente, presente sulla membrana dei calciosomi.
Canali ionici voltaggio dipendenti
I canali ionici voltaggio dipendenti sono attivati da differenze di voltaggio nel potenzialedi membrana, che modificano la geometria della proteina trasportatrice.Tra questi, il canale del Na+ e del K+ presenti nelle cellule nervose, e responsabili dellapropagazione del potenziale d'azione, nonché della successiva rigenerazione delpotenziale di membrana di riposo.
PermeasiLe permeasi sono responsabili del trasporto di piccole e medie molecole polari, come zuccheri, aminoacidi enucleotidi, all'interno della cellula.Si tratta di proteine molto specifiche, che presentano solitamente 12 regioni transmembrana, poste in posizioneconcentrica a formare un canale. Un classico esempio è la permeasi del glucosio, presente in grande quantità sullamembrana dei globuli rossi.Sebbene il trasporto sia passivo, questo è accoppiato solitamente a reazioni metaboliche in grado di modificare ilsubstrato trasportato: nel caso citato, il glucosio viene fosforilato (dall'enzima esochinasi) per evitare che, azzerata ladifferenza di concentrazione, il trasporto si interrompa o che la molecola appena internalizzata si rileghi allapermeasi, saturandola.
CotrasportatoriI cotrasportatori sono una classe di proteine in grado di mediare il trasporto simultaneo di due ioni, o di uno ione euna molecola.Le due molecole possono essere internalizzate in antiporto, quando la direzione di movimento delle due è opposto, oin simporto, quando la direzione di movimento delle due è la stessa.I cotrasportatori sono in grado di trasportare un substrato contro il suo gradiente di concentrazione, sfruttandol'energia ricavata dalla differenza di concentrazione dell'altro substrato. Ad esempio, il glucosio viene trasportatoall'interno delle cellule dell'epitelio intestinale attraverso un simporto che sfrutta il gradiente del Na+ (senza l'utilizzodiretto di ATP). Nel sistema nervoso i cotrasportatori contribuiscono al funzionamento delle sinapsi rimuovendodalla fessura sinaptica i neurotrasmettitori come ad esembio l'acido glutammico o l'acido gamma-aminobutirrico chevengono riportati all'interno dei neuroni insieme al sodio dopo che hanno svolto la loro azione eccitatoria oinibitoria. Un esempio di antiporto è invece il trasporto di sodio e potassio da parte della Na+/K+ ATPasi (che sfruttal'energia proveniente da una molecola di ATP).

Trasportatore di membrana 26
Voci correlate• → Trasporto di membrana• → Trasporto attivo• → Trasporto passivo
Trasporto attivo
Alcune delle possibilità di movimento di molecole tra → citoplasma (1) e spazioextracellulare (2).Trasporto passivo:
- A. Diffusione- B. → Diffusione facilitata
Trasporto attivo:D. Trasporto primario (contro gradiente)
C.-E. Trasporto secondario:- C. Uniporto- E. Simporto
Esocitosi/Endocitosi:F.-G. Esocitosi
Il trasporto attivo è il trasporto di molecoleattraverso la membrana plasmatica mediatoda una proteina transmembrana detta →trasportatore di membrana. A differenza diquanto avviene nel → trasporto passivo, neltrasporto attivo è richiesta una spesaenergetica ed è sempre necessaria lamediazione di un trasportatore.
In questa forma di trasporto le molecole simuovono contro un gradiente elettrico,chimico o elettrochimico. Per ottenerequesto risultato viene alterata l'affinità delsito di legame con la molecola da trasportareo la velocità di cambiamentoconformazionale del trasportatore.
Si distinguono due classi principali ditrasporto attivo: il trasporto primario, cheusa direttamente l'energia per ottenere iltrasporto e quello secondario, in cui avvienetrasporto di una sostanza resa possibile daltrasporto primario di un'altra.
Trasporto attivo primario
Nel trasporto primario il consumo dikj/mol, normalmente sotto forma di idrolisidi molecole di adenosintrifosfato (ATP), èaccoppiata direttamente al movimento della sostanza attraverso la membrana. Nella maggior parte dei casi iltrasporto primario è eseguito da ATPasi. Un tipico trasportatore primario, presente universalmente nelle cellule è lapompa sodio-potassio (o ATPasi sodio-potassio), che contribuisce nel mantenimento del → potenziale di membrana.
Trasporto secondarioNel trasporto secondario non viene speso direttamente ATP, ma viene sfruttata la differenza di potenziale elettrochimico creata dai trasportatori attivi che pompano ioni al di fuori della cellula. Questo significa che il trasporto secondario si basa comunque sul consumo di ATP, che permette di mantenere la differenza di potenziale senza la quale non ci sarebbe possibilità di trasporto secondario. Il gradiente creato tramite trasporto secondario può anche essere utilizzato da altri trasportatori; pur trattandosi dello stesso principio del trasporto secondario, in questo

Trasporto attivo 27
caso il fenomeno può prendere il nome di trasporto terziario. Un esempio di trasporto terziario è l'assunzione ditripeptidi nell'intestino tenue.Esistono due forme di trasporto secondario: uniporto e cotrasporto.
Uniporto
I tre tipi di trasporto secondario:I. UniportoII. Simporto
III. Antiporto
L'uniporto è il trasporto secondario di unasola sostanza che si muove sfruttando ladifferenza di potenziale elettrochimicocreato da trasportatori primari.
Cotrasporto
È il trasporto contemporaneo di due specieioniche o di altri soluti.• L'antiporto è il trasporto contemporaneo
di due specie ioniche o di altri soluti chesi muovono in direzioni opposteattraverso la membrana. Una delle duesostanze viene lasciata fluire secondogradiente, da un compartimento ad alta concentrazione ad uno a bassa concentrazione. Questo genera l'energiaentropica necessaria per guidare il trasporto dell'altro soluto contro gradiente, da bassa ad alta concentrazione.
Un esempio di questo tipo di trasporto è lo scambiatore sodio-calcio, che mediano l'ingresso di ioni sodio e l'uscitadel calcio. Molte cellule possiedono anche una calcio ATPasi che però opera molto più lentamente dello scambiatoree ha un diverso ruolo fisiologico.• Il simporto usa, analogamente all'antiporto, il flusso di un soluto secondo gradiente per muovere un'altra
molecola contro gradiente ma il movimento avviene in questo caso attraversando la membrana nella stessadirezione. Un esempio è il simportatore di glucosio, che cotrasporta secondo gradiente due ioni sodio per ognimolecola di glucosio importata nella cellula.
Voci correlate• → Trasporto passivo• → Trasportatore di membrana
Collegamenti esterni• (EN) Confronto tra trasporto attivo e passivo [1]
• (EN) Modello di trasportatore primario di protoni (pompa protonica) [1]
• (EN) Modello di simporto glucosio-sodio [2]

Trasporto attivo 28
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Note[1] http:/ / www. ncbi. nlm. nih. gov/ entrez/ query. fcgi?cmd=Search& db=books& doptcmdl=GenBookHL& term=active+ transport+ AND+
cooper%5Bbook%5D+ AND+ 165159%5Buid%5D& rid=cooper. figgrp. 334[2] http:/ / www. ncbi. nlm. nih. gov/ entrez/ query. fcgi?cmd=Search& db=books& doptcmdl=GenBookHL& term=active+ transport+ AND+
cooper%5Bbook%5D+ AND+ 165878%5Buid%5D& rid=cooper. figgrp. 2009

Recettore (biochimica) 29
Recettore (biochimica)In biochimica, un recettore è una proteina, transmembrana o intracellulare, che si lega con un fattore specifico,definito ligando, causando nel recettore una variazione conformazionale in seguito alla quale si ha l'insorgenza diuna risposta cellulare o un effetto biologico.
Schema di un recettore di membrana: il ligando (verde) legail recettore (arancione) determinandone una modificaconformazionale che attiva dei sistemi di trasduzione
intracellulari (rosso) del segnale
Il senso farmacologico, invece, è più lato, essendo il recettoreuna molecola qualsiasi, bersaglio del farmaco in questione.
Le due concezioni quindi sono leggermente diverse:• nel primo caso, il recettore sovente si trova inserito in una
membrana cellulare, che sia quella → plasmatica, →mitocondriale o nucleare
• nel secondo caso può anche trattarsi di un enzima o di altremolecole solute (pensiamo, per esempio, alle molecolepresenti nel sangue).
Le tipologie di recettori
I recettori possono essere suddivisi in due grandi famiglie, aseconda della loro localizzazione cellulare:• recettori transmembrana• recettori intracellulari
Recettori transmembrana
Recettore transmembrana:E=spazioextracellulare; I=spazio intracellulare;
P=membrana plasmatica
I recettori transmembrana, più semplicemente definibili anche recettoridi membrana, sono una classe di recettori che possiede dominiextracellulari, transmembrana ed intracellulari. Anche questa tipologiadi recettori è suddivisibile in due differenti classi: ionotropi emetabotropici.• recettori ionotropi definiti anche recettori-canale: sono recettori la
cui apertura causa il flusso di ioni. Tra questi:
• recettore nicotinico• recettore per la glicina• recettore GABA di tipo A e C

Recettore (biochimica) 30
• recettore del glutammato• recettore AMPA• recettore NMDA• recettore del kainato
• recettore serotoninergico del tipo 5-HT3• recettori metabotropici: classe di recettori che, in seguito all' interazione con lo specifico ligando, inducono una
cascata di reazioni cellulari. Riconducibili a 4 distinte tipologie recettoriali:• → Recettori accoppiati a proteine G: strutture recettoriali transmembrana costituiti da 7 domini transmembrana
(TM) la cui risposta è modulata da una proteina G. Tra tali tipi di recettore possiamo trovare:• recettore muscarinico che lega il ligando endogeno acetilcolina• recettore adrenergico per il legame di catecolammine come adrenalina e noradrenalina• recettore GABA di tipo B• recettore dell'angiotensina• recettore dei cannabinoidi• recettore della colecistochinina• recettore dopaminergico• recettore dei leucotrieni• recettore degli oppiodi• recettore della rodopsina• recettore della somatostatina• recettori attivati da proteasi PAR• probabilmente molti altri ancora non definiti
• recettori tirosin-chinasi, tra cui:• recettore dell'EGF (fattore di crescita epidermico• recettore dell'eritropoietina• recettore dell'IGF-1
• recettori per le citochine, definiti anche recettori accoppiati a chinasi: sono recettori la cui struttura ed ilmeccanismo d' azione è simile a quello dei recettori tirosin-chinasi. Al contrario di questi, i recettori per lecitochine non hanno attività tirosinochinasica intrinseca, ma l' attività è mediata da una chinasi cellulare.
• recettori guanilil-ciclasi: sono recettori ad attività guailato-ciclasica, poco rappresentati negli organismisuperiori. Si possono ricordare:• recettore per il peptide natriuretico• recettore per la guanilina
Recettori intracellulariSono la seconda grande famiglia di recettori, i quali sono localizzati all' interno della cellula, individuabili in duedistinti compartimenti: nel citosol e nel nucleo.• citosolici
• recettore dei glucocorticoidi• recettore dei mineralcorticoidi
• nucleari• recettore degli ormoni steroidei• recettore della vitamina D• recettore degli ormoni tiroidei• recettore dell'acido retinoico

Recettore (biochimica) 31
Caratteristiche generaliI recettori possono essere transmembrana, cioè attraversare tutta la membrana plasmatica, oppure trovarsi su di unasola superficie della stessa.I recettori di membrana contengono uno o più segmenti idrofobici strutturati a elica di tipo alfa che attraversano lamembrana più volte.
Recettori transmembrana• → Recettori accoppiati a proteine GSono conosciuti anche come metabotropici. Sono i recettori la cui struttura genica è la più altamente conservata.Son costituiti da 7 catene polipeptidiche che attraversano la membrana. Sono accoppiati a dei "secondi messaggeri"detti proteine G, che esercitano gli effetti cellulari attraverso la liberazione di ioni calcio o attraverso lafosforilazione.Appartengono a questa classe il recettore muscarinico per l'acetilcolina e i recettori adrenergici.Possiedono un'ampia regione molto variabile che forma un anello (detto "loop"), che corrisponde al sito di attaccodella proteina G. La regione responsabile del legame con l'agonista si trova in sede extracellulare per le molecoleidrofile e piccole (come i peptidi), mentre all'interno della membrana per le molecole più idrofobe come lanoradrenalina.I recettori accoppiati a proteine G possono anche essere costituzionalmente attivi, in assenza di qualsiasi agonista.Sono provvisti di attività enzimatica propria, e l'arrivo del ligando permette un'amplificazione dell'effetto.Il loro lavoro consiste nell'attivare (pGs) e nell'inibire (pGi) i secondi messaggeri, i reali effettori del messaggiotrasportato dal ligando. Questi sono l'adenilato e la fosfolipasi C, che producono rispettivamente AMP ciclico laprima, e diacilglicerolo (DAG) e inositolo trifosfato (IP3) la seconda. Inoltre agiscono sulla fosfolipasi A, che inducela formazione di acido arachidonico e anche sui → canali ionici.Questa estrema varietà nella trasduzione del messaggio, nonostante l'apparente promiscuità, mantieneincredibilmente la specificità del messaggio.• Recettori accoppiati a chinasiAppartengono a questa classe i recettori per l'insulina e per varie citochine.Posseggono una sola alfa-elica transmembrana. La zona citoplasmatica possiede una porzione chinasica con undominio intracellulare noto come SH2, che si auto-fosforila.A questa attività segue una cascata di chinasi che permette l'amplificazione del messaggio.• Recettori accoppiati alle guanilato ciclasiNon differiscono di molto dai recettori tirosin-chinasici. Anche questa classe, tramite il cGMP, possiede capacitàfosforilante.Non sono necessariamente transmembrana.

Recettore (biochimica) 32
Canali ionici regolati daligandi
→ Recettori accoppiati aproteine G
Recettori accoppiati a chinasi Recettori nucleari
Localizzazione Membrana Membrana Membrana Intracellulare
Effettore Canale Enzima o canale Enzima Trascrizione genica
Accoppiamento Diretto Proteina G Diretto Attraverso il DNA
Esempi Recettore nicotinicodell'acetilcolina, recettoredel
Recettore muscarinicodell'acetilcolina, recettoriadrenergici
Recettori dell'insulina, dei fattori dicrescita, delle citochine
Recettori degli steroidi edegli ormoni tiroidei
Struttura Assemblaggio oligomericodi subunità che circondano ilporo centrale
Strutture monomerichecomprendenti sette -eliche transmembrana
Singola elica transmembrana checollega il dominio extracellulare delrecettore al dominio chinasicointracellulare
Struttura monomerica conrecettore separato e dominiper legare il DNA
Canali ioniciDetti anche ionotropici, sono recettori transmembrana.Alcuni canali ionici possono essere direttamente collegati a un recettore, aprendosi quando questo riceve il ligando.In altri la più semplice interazione è il blocco fisico del poro del canale. Questo caso è esemplificato dall'azione deglianestetici locali sul canale del sodio.Esempi più complicati di interazione farmaco-canale comprendono la modulazione dei canali del calcio: in questocaso il processo di apertura del canale può essere inibito o attivato dalla conformazione strutturale del ligandodiidropiridina.Il canale che più spesso viene considerato è il recettore nicotinico dell'acetilcolina. Consiste di cinque diversesubunità chiamate con le lettere greche: due subunità α, una subunità β, una γ e una δ. Ogni subunità attravera lamembrana cellulare per quattro volte, quindi in tutto 20 alfa-eliche. Il canale è molto grande e può essere visto almicroscopio elettronico.Il sito recettoriale per l'aceticolina si trova sulle subunità alfa; devono essere occupati tutte e due i siti, perl'attivazione del canale.L'eterogeneità molecolare all'interno dei vari tipi di recettori ionotropici, anche rispondenti a un unico ligando, èmolto ampia, e il suo significato funzionale rimane ancora oscuro.
Legame recettore-ligandoIl legame tra recettore e ligando è una reazione definita come equilibrio dinamico. Il ligando si lega al recettorelibero, induce la risposta e di seguito vi si distacca, in accordo con la legge di azione di massa ed in accordo con laseguente formula:
dove Kd indica la costante di dissociazione che rappresenta la capacità del ligando di dissociarsi dal propriorecettore, ed è perciò un indice dell' affinità del ligando per il recettore

Recettore (biochimica) 33
Modulazione delle risposte recettorialiIl sistema ligando-recettore è un equilibrio dinamico le cui condizioni sono continuamente regolate dalle stesseinterazioni ligando-recettoriali. La carenza, l'eccesso o la sovraesposizione del recettore al ligando possonoperturbare la risposta ed il segnale generato dal recettore.La modulazione della trasduzione del segnale avviene a 4 distinti livelli di controllo:• Ricaptazione e feedback (retroazione): il ligando, una volta distaccatosi dal suo recettore, può essere ricaptato
dalla cellula che lo ha rilasciato. La quantità di ligando ricaptato regola il rilascio successivo di ligando stesso: sela quantità ricaptata è insufficiente, verrà sintetizzato altro ligando; se invece la quantità ricaptata è eccessiva,verrà diminuito il rilascio di ligando.
• Fosforilazione: questo segnale agisce a livello dell'interazione ligando-recettore. Le cellule, mediante processi difosforilazione e defosforilazione recettoriale, sono in grado di modulare l'affinità del recettore per il ligando. Disolito, la fosforilazione del recettore induce una modificazione conformazionale nel recettore stesso il quale perdeaffinità per il proprio ligando. L'interazione è più breve, più difficile o meno duratura, perciò la risposta generata èminore.
• Desensitizzazione, downregulation (sottoregolazione) e upregulation (sovraregolazione). La desensitizzazione èil passo che precede la downregulation. I recettori, ancora tutti presenti a livello della membrana, perdono lacapacità di trasdurre il segnale. A questo fa seguito la sottoregolazione: i recettori vengono legati da proteine(come la clatrina) e inglobati in specicole vescicole all'interno della membrana. Tale processo viene definitointernalizzazione e ha la funzione di diminuire il numero di recettori che possono legarsi al recettore, senzadistruggere il recttotre stesso. Poi, all'occorenza, senza che così vi sia il bisogno di sintetizzarne di nuovi, irecettori potranno essere velocemente esposti sulla membrana. All'opposto della downregulation, si definisce laupregulation: in mancanza o in difetto di ligando, la cellula espone tutti i suoi recettori nel tentativo di captaretutto il ligando possibile.
• Ultimo livello di controllo è la modulazione di secondi messaggeri. Ciò è particolarmente importante nei recettorimetabotropici. Variando l'attività di secondi messaggeri, è possibile regolare la risposta. L'adenilciclasi sintetizzacAMP, che è un secondo messaggero. L'attivazione di fosfodiesterasi porta alla degradazione di del cAMP;diminuendo il cAMP diminuisce la possibilità di trasdurre il messaggio.

Recettore transmembrana 34
Recettore transmembranaI recettori transmembrana sono proteine integrali di membrana localizzatiprincipalmnte a livello della membrana citoplasmatica ma evidenziabili anchein alcune membrane di strutture subcellulari.
Legando uno specifica molecola, definita ligando, i recettori transmembranamediano una risposta biochimica intracellulare, fungendo un ruolofondamentale nel processo di trasduzione del segnale.
Struttura
Struttura generica di un recettore transmembrana
I recettori transmembrana sono → recettori ampiamente eterogeneidal punto di vista strutturale, sia per quanto riguarda il numero disubunità costitutive, sia nel numero dei domini transmembrana.
Genericamente un recettore transmembrana è costituito da dominiiextracellulari che hanno la funzione di legare il ligando, dominiitransmembrana, di solito ad alfa elica, costituiti da amminoacidiidrofobici, e dominii intracellulari costituiti da amminoacidiidrofili. Alcuni recettori possono possedere un solo dominiotransmembrara, come i recettori per le citochine, → canali ionicialtri possono presentare sette dominii, come i → recettoriaccoppiati a proteine G.
Regolazione dell'attività recettorialeCome per la struttura, anche i meccanismi di regolazione recettoriale sono numerosi e diversi. Il meccanismo chemaggiormente si può evidenziare nel processo di regolazione è la fosforilazione e l'internalizzazione del recettore.
Tipologie di recettori transmembrana• → Recettori accoppiati a proteine G• Recettore tirosina chinasi• Recettore dell'insulina• Recettore dell'acetilcolina• Recettore NMDA• Recettore delle cellule T

Recettore transmembrana 35
• CD28
Recettori accoppiati a proteine GI recettori accoppiati alle proteine G (o GPCR) sono una famiglia di recettori biologici che comprende i recettoricolinergici muscarinici, i recettori adrenergici, dopaminergici, serotoninergici, i recettori cannabinoidi e i recettoridegli oppiacei e delle purine.
Struttura molecolareI GPCR sono costituiti da una singola catena polipeptidica formata anche da 1100 residui. La caratteristica strutturaleè rappresentata da 7 -eliche transmembrana, simili a quelle che si trovano nei canali ionici, con un dominioextracellulare N-terminale di lunghezza variabile e un dominio intracellulare C-terminale.I GPCR vengono divisi in tre distintefamiglie che condividono la stessastruttura eptaelicale ma differisconoper vari aspetti, principalmente per lalunghezza della sequenza N-terminalee la localizzazione del sito di legameper l'agonista.• La famiglia A, a cui appartiene la
rodopsina, è di gran lunga la piùnumerosa e comprende la maggiorparte dei recettori per le monoaminee i neuropeptidi.
• La famiglia B è costituita dai recettori della secretina, del glucagone e della calcitonina.• La famiglia C è costituita principalmente dai recettori metabotropici del glutammato e dai recettori sensibili al
.
Il terzo lungo loop citoplasmatico dei recettori corrisponde alla regione della molecola che si accoppia alla proteinaG. Modifiche di questa porzione della proteina determinano la formazione di recettori ancora in grado di legare ipropri ligandi, ma incapaci di accoppiarsi alle proteine G e di determinare i conseguenti effetti.
Trasduzione del segnale da parte dei GPCRAttraverso l'attivazione di vari meccanismi di trasduzione del segnale, i GPCR controllano diversi aspetti dellafunzione cellulare. Il collegamento tra il recettore e il primo stadio della trasduzione del segnale viene stabilitoattraverso le proteine G.Le proteine G rappresentano il livello intermedio nella gerarchia organizzativa di gestione della comunicazione trarecettori ed enzimi effettori o canali ionici. Le proteine G consistono di tre subunità , e . I nucleotidiguaninici si legano alla subunità , che è provvista di attività enzimatica, catalizzando la conversione del GTP inGDP. Le subunità e rimangono associate a formare un unico complesso . Tutte e tre le subunità sonoancorate alla membrana plasmatica mediante la catena di un acido grasso, legata alle proteine G per mezzo di unareazione chiamata prenilazione.

Recettori accoppiati a proteine G 36
Allo stato di riposo, la proteina G si trova libera nella forma di trimero e con il GDP legato al sito pecificodella subunità . L'occupazione di un GPCR da parte di una molecola di agonista attiva un cambiamentoconformazionale, che coinvolge il dominio citoplasmatico del recettore con l'acquisizione di uno stato di alta affinitàper il trimero . L'associazione del trimero con il recettore determina il rilascio del GDP legato e la suasostituzione con il GTP; questa modificazione, a sua volta causa la dissociazione del trimero dalla proteina G con ilrilascio di -GTP e delle subunità . Queste sono le forme attive della proteina G, che diffondono nellamembrana e possono legarsi con enzimi e canali ionici, causando, a seconda dei casi, l'attivazione o l'inattivazione. Ilprocesso termina con l'idrolisi del GTP a GDP da parte della subunità , che possiede attività GTP-asica. La -GDP che così si forma, si dissocia dall'effettore e si combina con , completando in tal modo il ciclo. Poichél'idrolisi del GTP è il passaggio che pone fine alla capacità della subunità di determinare il suo effetto, laregolazione della sua attività GTP-asica da parte dell'effettore implica che l'attivazione di quest'ultimo tende adessere autolimitante. Il meccanismo porta a un'amplificazione del segnale, in quanto un singolo complessoagonista-recettore può attivare parecchie proteine G per volta, e ognuna di queste può rimanere associata conl'enzima effettore per tempi sufficientemente lunghi da determinare la formazione di molte molecole di prodotto.Ques'ultimo è solitamente un "secondo messaggero", per cui si verifica un'ulteriore amplificazione prima che siaevidente la risposta cellulare finale.Ci sono differenze molecolari tra le varie proteine G: queste differenze danno origine a tre principali classi diproteine ( , e ), che sono selettive sia per i recettori che per gli effettori con i quali si accoppiano. Leproteine e promuovono rispettivamente la stimolazione e l'inibizione dell'enzima adenil ciclasi, e un similecontrollo bidirezionale è attivo su altri effettori, come la fosfolipasi C.

Recettori accoppiati a proteine G 37
Bersagli per le proteine GI principali bersagli delle proteine G, attraverso i quali i GPCR controllano diversi aspetti delle funzioni cellulari,sono i seguenti:• adenil ciclasi: l'enzima responsabile della formazione del cAMP;• fosfolipasi C: l'enzima responsabile della formazione dell'inositolo fosfato e del diacilglicerolo;• canali ionici: in particolare i canali del calcio e del potassio.
Sistema dell'adenil ciclasi/AMPciclicoIl cAMP è un nucleotide sintetizzato all'interno della cellula a partire da ATP e con l'intervento di un enzima legatoalla membrana, l'adenil ciclasi. Il cAMP viene prodotto continuamente e inattivato per idrolisi a 5'-AMP attraversol'azione di una famiglia di enzimi noti come fosfodiesterasi. Molti farmaci, ormoni e neurotrasmettitori agiscono suiGPCR e producono i loro effetti aumentando o diminuendo l'azione catalitica dell'adenil ciclasi, determinando in talmodo un incremento o una riduzione della concentrazione intracellulare di cAMP.Gli effetti regolatori del cAMP sulle funzioni cellulari sono molteplici e comprendono, ad esempio, enzimi coinvoltinel metabolismo energetico, nella divisione cellulare e nella differenziazione cellulare; il trasporto ionico; canaliionici e le proteine contrattili della muscolatura liscia. Tutti questi diversi effetti sono, però, provocati da un unicomeccanismo, e precisamente l'attivazione di proteine chinasi da parte del cAMP. Le proteine chinasi determinanouna regolazione funzionale di molte proteine cellulari attraverso la fosforilazione dei loro residui serinici etreoninici, utilizzando ATP come fonte di gruppi fosfato. La fosforilazione può attivare o inibire gli enzimi bersaglioo i canali ionici.Esempi di regolazione da parte della proteina chinasi dipendente dal cAMP includono l'aumento di attività dei canalidel calcio attivati dal voltaggio nelle cellule muscolari cardiache; la fosforilazione di questi canali aumenta laquantità di calcio che entra nelle cellule durante il potenziale d'azione, incrementando in tal modo la forza dicontrazione del cuore.Nella muscolatura liscia, la proteina chinasi cAMP-dipendente fosforila, inattivandola, un'altra chinasi, la chinasidella catena leggera della miosina, che è necessaria per la contrazione. Questo spiega il rilasciamento del muscololiscio indotto da molti farmaci che aumentano la produzione di cAMP in questo sito.Come è stato precedentemente detto, i recettori accoppiati a proteina G inibiscono l'adenil ciclasi e pertanto riduconola formazione di cAMP. Esempi comprendono il recettore colinergico muscarinico (ad esempio il recettore delmuscolo cardiaco), il recettore adrenergico presente nella muscolatura liscia e i recettori per gli oppiacei.Il cAMP viene idrolizzato, all'interno delle cellule, dalla fosfodiesterasi, un enzima che è inibito da farmaci come lemetilxantine (ad esempio teofillina e caffeina). La somiglianza tra alcune delle azioni di questi farmaci e quelle dellecatecolamine riflette probabilmente la loro proprietà comune di aumentare la concentrazione intracellulare di cAMP.
Il sistema fosfolipasi C/inositolo fosfatoMolti ormoni, oltre a promuovere l'aumento della concentrazione di calcio libero intracellulare (ad esempio gliagonisti muscarinici e gli agonisti -adrenergici che agiscono sulla muscolatura liscia e sulle ghiandole salivari, el'ormone antidiuretico attivo sulle cellule epatiche), aumentano anche il turnover di inositolo fosfato (PI). In questoprocesso gioca un ruolo chiave un membro della famiglia dei PI, e precisamente il fosfatidilinositolo4,5-bisfosfato (
), che possiede gruppi fosfato addizionali attaccati all'anello dell'inositolo. Il è un substratodell'enzima di membrana , che lo scinde in diacilglicerolo (DAG) e inositolo1,4,5-trisfosfato ( ):entrambi funzionano come secondi messaggeri. Dopo la scissione di , viene ripristinata la condizione basale.Il DAG viene fosforilato a formare l'acido fosfatidico, mentre l' viene progressivamente defosforilato e poiriaccoppiato con l'acido fosfatidico a riformare .

Recettori accoppiati a proteine G 38
Fosfoinositoli e calcio intracellulare
è un mediatore solubile che viene liberato nel citosol dove si lega al suo recettore specifico (recettore ),che è un canale del calcio attivato dal ligando localizzato sulla membrana del → reticolo endoplasmatico. Il ruoloprincipale di è quello di controllare il rilascio di dai siti di accumulo intracellulare.
Diacilglicerolo e protein chinasi C
Il DAG e l' vengono prodotti dall'idrolisi di PI promossa dall'attivazione del recettore. L'azione principale delDAG consiste nell'attivazione di una proteina chinasi di membrana, la protein chinasi C (PKC) che catalizza lafosforilazione di varie proteine intracellulari. Il DAG, diversamente dai fosfoinositoli, è altamente lipo filo e rimaneall'interno della membrana. Si lega a un sito specifico localizzato sulla PKC, che migra dal citosol alla membranacellulare in presenza di DAG e viene in questo modo attivata. Esistono almeno 12 sottotipi di PKC, distribuitieterogeneamente in cellule diverse e fosforilano proteine diverse. La maggior parte viene attivata da DAG e aumentai livelli intracellulari di .Le varie isoforme di PKC agiscono su varie proteine funzionali come i canali ionici, i recettori, gli enzimi (tra cuialtre chinasi) e alcune proteine del citoscheletro. Le chinasi, in generale, hanno un ruolo centrale nella trasduzionedel segnale e controllano molti aspetti della funzione cellulare.
Canali ionici come bersaglio delle proteine GI GPCR possono controllare l'attività funzionale di canali ionici direttamente, attraverso meccanismi che nonimplicano il coinvolgimento di secondi messaggeri come il cAMP e l'IP.I recettori muscarinici del muscolo cardiaco aumentano la permeabilità al potassio (K), iperpolarizzando così lecellule e inibendo l'attività elettrica. Si ritiene che simili meccanismi operino anche nei neuroni, dove gli analgesicioppiacei riducono l'eccitabilità attraverso l'apertura dei canali del . L'apertura del canale è prodottadall'interazione diretta tra le subunità della proteina G e il canale, senza il coinvolgimento del secondo messaggero.Sia la subunità libera, sia il complesso delle subunità della proteina G possono essere i mediatori checontrollano il canale.
Voci correlate• Proteina G• Recettori adrenergici• Recettori cannabinoidi• Recettore metabotropico• Recettore muscarinico• Recettori oppioidi• → Recettore transmembrana

Recettore intracellulare 39
Recettore intracellulareIl recettore intracellulare è una → struttura recettoriale di natura proteica localizzata a livello intracellulare e piùraramente a livello della membrana citoplasmatica. I recettori intracellulari interagiscono con ligandi di naturaormonale o molecole lipofile specifiche. Il complesso ligando-recettore funge da fattore di trascrizione il quale migranel nucleo cellulare e, interagendo con specifiche sequenze di DNA, regola l' espressione genica.
Tipologie di recettori intracellulariI recettori intracellulari possono essere suddivisi in due famiglie principali (recettori citosolici e recttori nucleari),ognuna delle quali contiene altre sottoclassi recettoriali. I recettori citosolici sono localizzati a livello del citosol,accoppiati a strutture proteiche che mantengono il recettore in una forma inattiva. I recettori nucleari sono presenti alivello del nucleo cellulare, anch'essi in forma inattiva.• Recettori citosolici
• Recettori dei glucocorticoidi• Recettori dei mineralcorticoidi
• Recettori nucleari• Recettori degli estrogeni• Recettori del progesterone• Recettore degli androgeni• Recettore degli ormoni tiroidei• Recettore della vitamina D• Recettori dell' acido retinoico
Struttura del recettore intracellulareTutti i recettori intracellulari si assomogiano molto sia dal punto di vista strutturale, della sequenza di amminoacidi enel meccanismo d' azione. Infatti tuttii i recettori intracellulari appartengono ad una medesima superfamiglia direcettori; è infatti probabile che tali recettori presentino un capostipite comune dal quale tutti derivano. I primirecettori ad essere stati caratterizzati sono stati il recettore dei glucocorticoidi, degli estrogeni e del progesterone.I recettori intracellulari sono costituiti da una sequenza che varia da 400 a 1000 amminoacidi. L' omologia disequenza tra le varie forme recettoriali varia da un minimo del 40% ad un massimo del 94%.Ogni recettore è costituito da 3 regioni funzionali:• porzione -NH2 terminale (amminoterminale)• porzione centrale• porzione -COOH terminale (carbossiterminale)La porzione amminoterminale è responsabile del processo di dimerizzazione che segue all' interazioneligando-recettore: 2 recettori si appaiano tramite tali estremità.La porzione centrale è quella che presenta affinità per specifiche sequenze di DNA. Una volta dimerizzato, ilrecettore entra nel nucleo e si lega a specifiche sequenze geniche favorendone o inibendone la trascrizione. Questasequenza recettoriale è costituita da circa 70 amminoacidi, in prevalenza basici i quali favoriscono il legame con ilDNA. La diversità, sebbene lieve, di tale sequenza, è la ragione della specificità di legame con le sequenze HRE(Hormone Responsive Elements, in italiano: sequenze che rispondono agli ormoni). La regione centrale presentaresidui di cisteina ed istidina le quali interagiscono tramite legami di coordinazione con un atomo di zinco: talilegami sono definiti zinc finger ed hanno la funzione di mantenere il recettore nella conformazione necessaria perl'interazione con il DNA.

Recettore intracellulare 40
La porzione carbossiterminale è quella che lega il ligando, cioè l' ormone a seguito del legame con il quale si hamodificazione conformazionale del recettore e migrazione di questo nel nucleo (solo per quelli citoplasmatici).
Meccanismo d'azioneL' attivazione dei recettori intracellulari può avvenire tramite due distinti meccanismi: interazione ligando-recettore,che è la forma principale di attivazione, e attivazione in assenza di ligando
Attivazione ligando dipendenteIl ligando dei recettori intracellulari sono ormoni, non tutti, i quali in virtù della loro lipofilia, possono attraversare ildoppio strato lipidico della membrana e diffondere all' interno della cellula. Il ligando interagisce così con il propriorecettore a livello intracellulare (se si tratta di recettori citosolici) o a livello nucleare (se si tratta di recettorinucleari).Il recettore normalmente è presente in una forma non attiva. Il recettore non attivo è legato a strutture proteiche chehanno la funzione di mantenere il recettore in forma quiescente, in modo tale che non possa essere espressa lapropria azione. Queste proteine che inibiscono il recettore sono definite HSP (dall' inglese Heat Shock Protein, cioèproteine dello shock termico) appaiate da un numero che indica il numero di amminoacidi di cui sono costituite.Normalmente il recettore inattivo è presente in una conformazione ripiegata a 90 gradi e legato alle HSPs. In seguitoal legame con l'ormone a livello della sezione carbossi-terminale, il recettore passa da 90 a 180 gradi e stacca laHSP. Si scopre così la porzione centrale del recettore, quella ad affinità per il DNA. Prima di migrare nel nucleo, ilrecettore attivato si lega con un altro recettore attivo tramite la porzione amminoterminale e, così dimerizzato, sidirige verso il nucleo, vi penetra ed interagisce con specifiche sequenze di DNA. L' azione che si può ottenere puòessere attivatoria o inibitoria sull'espressione genica.Studi dettagliati dell'ultimo decennio hanno confermato che il recettore attivo non agisce da solo. Esso, infatti, vieneaccompagnato da co-attivatori, che mostrano specificita' per un particolare tipo di recettore. Si tratta di proteine perlo più nucleari, con una massa relativamente grande (superiore a quella del recettore dimero attivo) e tutti aventi incomune un corto motivo di amminoacidi idrofobi col quale legano il loro recettore ormonale.Il primo ad essere stato clonato nel 1995 è stato SRC-1 (steroid receptor coactivator-1), seguito dal SRC-2 (chiamatoanche GRIP o TIF-2) e risultati abbastanza specifici per l'azione dei glucocorticoidi. Gruppi di ricercatoriindipendenti hanno poi identificato altri coattivatori, come pCIP, ACTR, RAC3, TRAM-1 (specifico per l'azionedegli ormoni tiroidei), AIB-1 ed AIB-3 (specifici per l'azione degli estrogeni e cosi' chiamati perché trovatiamplificati in campioni di carcinoma mammario) ed NCoA6/NRC.Recentissimi sviluppi della farmacologia hanno portato all'identificazione di sostanze capaci di interferire conl'interazione tra il recettore a ttivo ed il suo coattivatore. Si tratta di piccole molecole organiche, derivate dall'anellonaftalenico o piridinico con varie modificazioni, che sembrano bersagliare primariamente il coattivatore edimpedirne la sua interazione col recettore come meccanismo riflesso.È chiaro che lo sviluppo di tali molecole ha implicazioni non indifferenti per la terapia mirata di certi tipi di tumoreormono-dipendenti o patologie legate a disturbi della sintesi o dell'azione ormonale.
Attivazione in assenza di ligandoÈ un tipo di attivazione meno frequente che avviene per modificazioni post-traduzionali (in genere fosforilazione delsubstrato). In seguito alla stimolazione di vari recettori di membrana, si ha la produzione di secondi messaggeri chestimolano delle proteine chinasi che, mediante fosforilazione attivano il recettore intracellulare. Le principali chinasicoinvolte in questo processo sono in genere la protein chinasi calcio-lipide dipendente (PKC) e la chinasi attivata dalsecondo messaggero AMP ciclico (PKA).

Recettore intracellulare 41
Questo tipo di meccanismo è noto per recettori estrogeni, del progesterone e degli ormoni tiroidei in seguito astimolazione dei recettori dopaminergici in particolari aree cerebrali. È stato speculato che, in seguiito a questomeccanismo, gli ormoni sessuali possano "dialogare" con la dopamina a livello cerebrale e provocare il fenomenodell'attrazione tra i due sessi.
Canale ionicoUn canale ionico è una glico-proteina trans-membrana (cioè attraversa la → membrana cellulare) che permette ilpassaggio di determinati ioni dall'esterno all'interno della cellula o viceversa. I canali ionici sono selettivi per una opoche specie ioniche.La presenza di cariche fisse forti sull'imboccatura del canale rende la sua permeabilità inversamente proporzionale alraggio anidro degli ioni in quanto viene allontanato l'alone idrico di solvatazione (es: canale per il sodio). Lapresenza di cariche fisse deboli sull'imboccatura del canale rende la sua permeabilità inversamente proporzionale alraggio idrato degli ioni (es: canale del potassio). I canali la cui permeabilità (e quindi la loro specificità) non ècorrelata né al raggio anidro né a quello idrato, presentano all'interno una sequenza di specifità che consiste in unaserie di cariche e in una determinata conformazione spaziale che permette il passaggio solo a determinate specieioniche.
ClassificazioneDue tipi particolari di canali ionici sono quelli voltaggio- e chemio-dipendenti. Tali strutture sono in grado di passareda uno stato di apertura ad uno di chiusura o inattivazione in seguito a stimolazioni elettriche o chimiche. I canalichemio-dipedenti sono in grado di aprirsi dopo aver legato un certo messaggero; sono presenti nelle membranepost-sinaptiche e si aprono dopo aver legato un neurotrasmettitore. I canali voltaggio-dipendenti si aprono in seguitoad una depolarizzazione della membrana; per esempio, i canali al sodio e potassio presenti nelle membrane assonichepermettono la propagazione di impulsi elettrici nelle cellule nervose.
Canali ionici attivati da ligandoI canali ionici attivati da ligando sono anche noti come recettori recettori ionotropici. Sono costituiti da proteine dimembrana con struttura simile ad altri canali ionici ma che contengono un sito in grado di legare un ligando(recettore), solitamente nel dominio extracellulare. Questi sono i recettori su cui agiscono tipicamente ineurotrasmettitori veloci. Alcuni esempi sono il recettore colinergico nicotinico, il recettore e i recettoridel glutammato del tipo NDMA (N-metil-D-aspartato), AMPA ( -amino-3-idrossi-5-metil-4-isossazolopropionato) e kainato.

Canale ionico 42
Struttura Molecolare
Struttura molecolare di un canale ionicoregolato da ligando (le zone rosse sono le
subunità alle quali si legal'acetilcolina)
I canali ionici regolati da ligandi hanno caratteristiche strutturali in comune con gli altri canali ionici. Il recettorenicotinico dell'acetilcolina rappresenta il recettore più dettagliatamente studiato. È costituito dall'assemblaggio diquattro subunità diverse definite , ognuna con una massa molecolare di 40-58 kDa. La struttura
oligomerica ( ) possiede due siti di legame dell'acetilcolina, ognuno situato all'interfaccia fra una delle
due subunità e la subunità adiacente. Per attivare il recettore entrambi i siti devono legare una molecola diacetilcolina. Ogni subunità attraversa la membrana quattro volte: in tal modo il canale risulta rivestito da non menodi 20 -eliche che attraversano la membrana formando la parete del poro centrale.I due siti di legame dell'acetilcolina sono localizzati nella regione N-terminale delle due subunità . Una delleeliche transmembrana (M2) appartenente a ognuna delle 5 subunità, formala parete interna del canale ionico. Le 5eliche M2 che formano il poro sono piegate verso l'interno a circa metà dello spessore della membrana dando cosìorigine a una costrizione; si ritiene che quando le due molecole di acetilcolina si legano ai due siti specifici, le -eliche piegate possano raddrizzarsi aprendo così il canale.I recettori per alcuni dei trasmettitori veloci, come ad esempio il recettore , il recettore 5- e ilrecettore della glicina sono costruiti sullo stesso modello; il numero di subunità utlizzate per costituire un recettorefunzionale è variabile, anche se solitamente è di 4 o 5.

Canale ionico 43
Il meccanismo di cancelloI recettori di questo tipo controllano gli eventi sinaptici più veloci del sistema nervoso nei quali un neurotrasmettitoreagisce sulla membrana postsinaptica di una cellula nervosa o muscolare e ne aumenta transitoriamente lepermeabilità a particolari ioni. La maggior parte dei neurotrasmettitori eccitatori, come l'acetilcolina a livello dellagiunzione neuromuscolare o il glutammato nel sistema nervoso centrale, causa un aumento di permeabilità al sodio eal potassio. Questo produce essenzialmente una corrente di ioni sodio verso l'interno della cellula, che si depolarizzae aumenta le probabilità che si generino dei potenziali d'azione. L'azione del neurotrasmettitore raggiunge un piccoin una frazione di millisecondo e decade entro pochi millisecondi. L'elevata velocità di questa risposta implica chel'accoppiamento tra recettore e canale ionico sia diretto; la stessa struttura molecolare del complesso recettore/canalene è una conferma (vedi sopra).
Canali ionici come bersaglio dei farmaciI canali ionici sono costituiti da molecole proteiche disposte in modo da formare pori ripieni d'acqua cheattraversano le membrane, e sono in grado di passare da uno stato aperto a uno chiuso. L'intensità e la direzione delmovimento ionico attraverso il poro sono governate dal gradiente elettrochimico per lo ione in questione. Questofattore dipende dalla concentrazione dello ione ai due lati della membrana e dal potenziale di membrana. I canaliionici sono caratterizati:• dalla loro selettività per particolari specie ioniche, che dipende dalla dimensione del poro e dalla natura del suo
rivestimento interno• dalle loro proprietà di cancello (cioè dal meccanismo che controlla la transizione tra stato aperto e stato chiuso del
canale)• dalla loro architettura molecolare
Canali ionici come bersaglio dei farmaci
Canali ionici Bloccanti Modulatori
, voltaggio-attivato Anestetici Locali Veratridina
, tubulo renale Amiloride Aldosterone
, voltaggio-attivato Cationi bivalenti Agonisti -adrenergici
, voltaggio-attivato 4-Aminopiridina
, ATP-sensibile ATP Sulfaniluree
, GABA-attivato Picrotossina Benzodiazepine
Canali cationici, glutammato-attivati (NMDA) Ketamina Glicina

Canale ionico 44
SelettivitàI canali sono generalmente selettivi per cationi o anioni.• I canali selettivi per cationi possono essere selettivi per , o o possono essere non selettivi e
non permeabili a tutti e tre questi ioni.• I canali anionici sono principalmente permeabili a , sebbene ve ne siano altri tipi.
Regolazione dei canali
Canali regolati dal voltaggio
La maggior parte dei canali regolati dal voltaggio si aprono in seguito a depolarizzazione della → membranacellulare. Formano un gruppo molto importante perché la loro funzione è alla base del meccanismo dell'eccitabilitàdi membrana. I più importanti canali di questo gruppo sono selettivi al sodio, al potassio o al calcio. In generale,l'apertura del canale (attivazione) indotta dalla depolarizzazione di membrana è di breve durata; questo avvieneanche se la depolarizzazione viene mantenuta. In alcuni canali, l'attivazione iniziale dei canali è seguita da unprocesso più lento di inattivazione.
Canali regolati da ligandi
I canali regolati da un ligando vengono attivati dal legame di una sostanza chimica a un sito posto sulla molecoladel canale. Con questa modalità agiscono i neurotrasmettitori veloci, come il glutammato, l' acetilcolina, il GABA e l'ATP che legano siti posti sulla parte esteriore della membrana. Alcuni canali attivati da ligandi della membranaplasmatica rispondono a segnali intracellulari piuttosto che a segnali extracellulari, tra i più importanti si possonoricordare:• i canali del potassio -attivati, localizzati nella maggior parte delle cellule, si aprono quando i livelli di
intracellulare aumentano e iperpolarizzano la cellula.• i canali del potassio ATP-sensibili, che si aprono quando la concentrazione intracellulare di ATP scende a causa
della diminuita scorta energetica della cellula; questi canali, alquanto diversi da quelli che mediano gli effettieccitatori dell'ATP extracellulare, sono presenti in un numero piuttosto alto di cellule nervose e muscolari, eanche nelle cellule che secernono insulina, dove fanno parte del meccanismo che collega la secrezione di insulinaalla concentrazione di glucosio ematico.
• il recettore vanilloide, il cui sito di legame per la capsaicina è localizzato sulla parte citoplasmatica dellamolecola.
Canali che rilasciano calcio
I canali che rilasciano calcio sono presenti sul → reticolo endoplasmatico e su quello sarcoplasmatico, ma nonnella → membrana cellulare. I principali sono i recettori per per la rianodina e costituiscono una classespeciale di canali del calcio attivati da ligandi che controlla il rilascio del dai siti intracellulari di accumulo.
Canali del calcio operati dall'accumulo intracellulare di calcio
Quando i siti di accumulo intracellulari del vengono depletati, i canali della membrana plasmatica si apronopermettendo l'ingresso di . Questi canali attivati dai livelli accumulati di calcio intracellulare (Store-OperatedChannels, SOC) sono importanti per il meccanismo d'azione di molti GPCR che stimolano il rilascio di .L'apertura dei SOC permette di mantenere adeguati livelli intracellulari di anche quando i siti di accumulosono esauriti, e rappresentano un sistema di riempimento ei siti di accumulo intracellulare.

Canale ionico 45
Farmacologia dei canali ioniciIl controllo e la permeazione dei canali ionici sia voltaggio-dipendenti sia attivati da ligando vengono modulati dadiversi fattori.• I ligandi che si legano direttamente a vari siti del canale. Tra questi ci sono molti neurotrasmettitori, e anche
una varietà di farmaci e tossine che agiscono diversamente, ad esempio bloccando il canale o influenzando iprocessi di attivazione,perciò facilitando o inibendo l'apertura del canale.
• I mediatori di farmaci che agicono indirettamente, principalmente attraverso l'attivazione di GPCR. Questiultimi producono i loro effetti influenzando lo stato di fosforilazione di singoli aminoacidi localizzati nellaregione intracellulare della proteina canale. L'apertura del canale può essere facilitata o inibita a seconda di qualiresidui vengono fosforilati. Farmaci come gli oppiacei e gli agonisti -adrenergici influenzano i canali delcalcio e del potassio in questo modo, producendo una grande varietà di effetti cellulari.
• Segnali intracellulari, particolarmente e nucleotidi come ATP e GTP. Molti canali ionici possiedonositi di legame per questi mediatori intracellulari. L'aumento dei livelli intracellulari di apre certi canali delpotassio e disattiva i canali del calcio voltaggio-attivati. I livelli stessi di intracellulare vengono influenzaidalla funzione dei canali ionici e da GPCR.
Potenziale di membrana
Membrana cellulare
Introduzione
Il potenziale di membrana è unargomento che rientra nella fisiologiadei tessuti eccitabili (nervoso,muscolare). Le cellule dei tessutieccitabili presentano una determinatadifferenza di potenziale (d.d.p. o E oV) tra l’interno e l’esterno della →membrana cellulare che consente, trale altre cose, la propagazione degliimpulsi elettrici.
I segnali elettrici transitori sonoparticolarmente utili per trasmettere, velocemente e a lunga distanza, informazioni fugaci che possono essere divitale importanza per un organismo vivente. Questi segnali elettrici sono dovuti a modificazioni transitorie dei flussidi corrente che, sotto forma di ioni, entrano ed escono dalle cellule. Tali flussi di corrente sono controllati dai canaliionici della membrana plasmatica.
I canali ioniciI canali ionici sono proteine transmembranarie che consentono l'attraversamento, veloce ma selettivo, della membrana cellulare da parte delle varie specie ioniche presenti nelle cellule. Nel → citoplasma dei tessuti eccitabili sono presenti Na+, K+, Ca+, Mg++, Cl-, A- (anioni proteici organici, cioè grossi peptidi che a pH citosolico sono sottoforma anionica). La maggior parte dei canali cationici consentono il passaggio soprattutto di una sola specie ionica, sia essa Na+, K+ o Ca++, e sono quindi selettivi, ma esistono anche canali che lasciano passare tutti i cationi, quasi senza distinzione. Anche la maggior parte dei canali anionici sono altamente selettivi e permettono il passaggio di un solo ione di

Potenziale di membrana 46
importanza fisiologica, vale a dire lo ione cloruro.Ci sono canali attivi (nella cellula a riposo sono per lo più chiusi e si aprono solo in particolari condizioni) e canalipassivi che consentono il passaggio degli ioni secondo il gradiente di concentrazione.Il gradiente di concentrazione degli ioni fra interno ed esterno della cellula è consentito da un meccanismo attivo chetrasporta gli ioni contro il gradiente naturale (pompe Na+–K+).Grazie al gradiente di concentrazione e quindi al gradiente elettrico, si genera la differenza di potenziale che èmisurabile applicando due microelettrodi collegati tra loro e a un galvanometro applicabili all’interno e all’esternodella cellula.L’interno della cellula ha una prevalenza di cariche negative, mentre l’esterno ha una prevalenza di cariche positive.Per esempio, La differenza di potenziale transmembranaria della maggior parte dei neuroni, a riposo, varia tra -60 e-70 mV.
Equilibrio elettrochimico
Membrana semipermeabile
Consideriamo ora la situazione perognuno degli ioni in grado dioltrepassare i porocanali passivi.
K+
La concentrazione intracellulare di K+
è di 145 mM/l, mentre laconcentrazione extracellulare è 2,5mM/l. La membrana in condizioni diriposo ha proteine canale checonsentono il passaggio di K+
(porocanali passivi). Quindi K+ passadall’interno all’esterno della cellulaattraverso questi canali seguendo ilgradiente di concentrazione.
All’interno della cellula ci sono grossianioni proteici (A-) che per la loromole non passano attraverso i canali. Quindi ogni K+ che esce dalla cellula rimane confinato nelle immediatevicinanze della cellula attirato da A-.L+ è il lavoro chimico ed è legato alla differenza di concentrazione tra interno ed esterno, a R (costante dei gas) e T(temperatura assoluta).
Lc è il lavoro che il gradiente di concentrazione compie quando K+ passa dall’interno all’esterno.Lc = R ∙ T ∙ ln [K+]int
[K+]est
La fuoriuscita di K+ crea un gradiente elettrico dovuto allo spostamento di carica. Man mano che K+ esce si crea eaumenta una E che ostacola sempre più la fuoriuscita di K+ e che quindi compie un lavoro (lavoro elettrico): Le = Z∙ F ∙ E Il lavoro elettrico dipende da Z (la valenza dello ione, in questo caso il K+ ha valenza +1), da F (Faraday)che è la quantità di carica portata da uno ione monovalente e da E. Si raggiunge un equilibrio dinamico fra il K+ cheesce a causa del gradiente di concentrazione e il K+ che entra a causa della E causata dalla stessa fuoriuscita. Inquesto equilibrio, detto equilibrio elettrochimico, la forza chimica è uguale e contraria a quella elettrostatica e ilflusso complessivo di K+ che attraversa la membrana è pari a zero.

Potenziale di membrana 47
Lc = – Le sostituendo si ha: R ∙ T ∙ ln [K+]int = – Z ∙ F ∙ E
[K+]est
A partire da questa formula si può ricavare la Ex (potenziale transmembranario all’equilibrio elettrochimico di unoione x):
EK = _ R ∙ T ∙ ln [K+]int
Z ∙ F [K+]est
R, T, Z ed F sono costanti e quindi il rapporto fra queste costanti è una costante (che hanno calcolato essere 60 mV,non in relazione al ln, ma in relazione al Lg decimale) quindi si ha:
EK = – 60 mV ∙ Lg 140 = – 105 mV 2,5
Quest’equazione è stata formulata da Nernst (equazione di Nernst) ed è applicabile partendo dal presupposto che lamembrana sia permeabile solo ad un unico ione preso in considerazione (in questo caso i K+), ciò evidentemente noncorrisponde perfettamente alla situazione reale. Il valore della Ex di un determinato ione serve a comprendere ladirezione del flusso dello ione quando la differenza di potenziale della membrana non è all’equilibrio elettrochimicoper quel dato ione.La differenza di potenziale della membrana a riposo (Er) è – 90 mV. Questo valore è diverso da EK (che è – 105mV). Ciò significa che quando la membrana è a riposo la forza chimica prevale su quella elettrostatica e sposta il K+
dall’interno all’esterno della cellula. Per calcolare la forza che agisce su uno ione (f.e.m.) si usa la formula Er – Ex.Quindi Er – EK = – 90 mV – (– 105 mV)= 15 mV. Quindi nonostante all’interno della cellula ci siano carichenegative e all’esterno cariche positive il K+ ha una leggera tendenza a passare dall’interno all’esterno della cellulaspinto dalla forza chimica (che è maggiore di quella elettrostatica) contro il gradiente di carica.
Na+Consideriamo Na+ come l’unico in grado di attraversare la membrana. La concentrazione extracellulare di Na+ è 140mM/l, quella intracellulare è 9,2 mM/l.Applichiamo l’equazione di Nernst per calcolare la d.d.p. all’equilibrio elettrochimico di Na+ (ENa)
ENa = _ R ∙ T ∙ ln [Na+]int = – 60 mV ∙ Lg 9,2 = + 67 mV Z ∙ F [Na+]est 120
ENa è di segno opposto rispetto a EK. Nella situazione reale il potenziale di membrana a riposo (Er) è – 90 mV. Fraquesto e il potenziale di equilibrio di Na+ (ENa) c’è un’enorme differenza.Per calcolare la forza che agisce su uno ione (f.e.m.) si usa la formula Er – Ex.Quindi Er – ENa = – 90 mV – 67 mV= – 157 mV.Quindi Na+ ha una forte tendenza a passare dall’esterno all’interno della cellula, spinto sia dalla forza chimica che daquella elettrostatica (poiché segue anche il gradiente di carica). Ma nella situazione reale della membrana a riposo lecose vanno diversamente.Sebbene il numero atomico di Na+ sia inferiore di quello di K+, il diametro complessivo di Na+ è maggiore di quello di K+ perché proprio in virtù delle sue dimensioni inferiori Na+ è circondato da un alone di H2O di idratazione più grande di quello che circonda K+. Per questo motivo Na+ passa con molta più difficoltà attraverso i porocanali passivi per il K+. Quindi la forte tendenza che ha il Na+ a passare attraverso la membrana è frenata notevolmente dal ridotto diametro dei porocanali. L’effetto complessivo è che il Na+ ha una leggera tendenza a passare dall’esterno all’interno della

Potenziale di membrana 48
cellula.
Cl–[Cl–]int oscilla tra 3 e 4 mM/l, mentre [Cl–]est. ECl = – 90 mV, quindi coincide con il potenziale di membrana ariposo (Er). Quindi, in condizioni di riposo il flusso netto di Cl– è zero (c’è comunque un equilibrio dinamico).
ConsiderazioniFino ad ora si è discusso prendendo in considerazione l’attraversamento della membrana da parte di un singolo ionealla volta, in funzione dell’equazione di Nernst. Nella realtà attraverso la membrana possono passare più ionicontemporaneamente.Attraverso i porocanali passivi può passare facilmente K+, Na+ ha difficoltà 20 volte superiore a passare a causa delsuo maggiore diametro complessivo. Se la membrana fosse impermeabile al Na+ raggiungerebbe un Er uguale a EK(ciò accade nelle cellule non eccitabili).Lo scarso ingresso di Na+ fa sì che Er non sia uguale a EK. I grossi anioni proteici (A–) non passano attraverso iporocanali perché hanno diametro enorme e restano all’interno della cellula. Per ogni carica positiva che esce dallacellula si accumula un A– in prossimità della membrana, ciò che causa il caricamento della membrana di una d.d.p.(potenziale di membrana o Em).Man mano che Em aumenta, aumenta il flusso dei Na+ dall’esterno all’interno della cellula.K+ ha una leggera tendenza ad uscire dalla cellula e Na+ ha una leggera tendenza ad entrare nella cellula. Em è unamedia ponderata fra EK e ENa. Per ponderare questa media si tiene conto della permeabilità della membrana che èalta nei confronti di K+ e bassa nei confronti di Na+.Per operare con unità di misura comparabili con quelle delle equazioni, si usa la conduttanza (g) che è direttamenteproporzionale alla permeabilità (e quindi anche all’intensità del flusso) ed è la facilità che ha uno ione a passareattraverso la membrana. La conduttanza è inversamente proporzionale alla resistenza (g = 1/R). La resistenza è ladifficoltà che ha lo ione a passare attraverso la membrana. Per calcolare la Er si usa l’equazione della conduttanza dimembrana o equazione di Goldman che tiene conto della conduttanza e del fatto che la membrana è attraversata dapiù ioni contemporaneamente: Em = gK ∙ EK + gNa ∙ ENa + gCl ∙ ECl ∑g ∑g ∑g ∑g è la somma delleconduttanze di tutti gli ioni coinvolti nel calcolo cioè la conduttanza totale della membrana. Nel calcolare Er iltermine gCl ∙ ECl non lo consideriamo perché ECl = Er.
∑g
Er = gK ∙ EK + gNa ∙ ENa gK + gNa gK + gNa in condizioni di riposo gK è elevata (circa 20 volte) rispetto a gNa(che, perciò, rispetto a gK è trascurabile) quindi la somma gK + gNa è approssimabile a gK. Quindi
gK = 1 circa e gNa = 0 circagK + gNa gK + gNa
In condizioni di riposo Em è influenzato soprattutto da gK ed EK: Em = 1 ∙ EK + 0. Quando una cellulabioeccitabile raggiunge l’eccitamento, si aprono canali per il Na+ quindi aumenta gNa e quindi per lo stessoragionamento di prima Em dipende soprattutto a gNa e da ENa: Em = 0 + 1 ∙ ENa.Il potenziale di membrana (Em) corrisponde al potenziale di equilibrio (Ex) dello ione verso cui la membrana èmaggiormente permeabile. I valori considerati fino ad ora fanno riferimento al muscolo scheletrico di rana.I valori relativi ai tessuti del mammifero sono:
Ione Potenziale di equilibrio: Ex (mV) Potenziale di riposo: Er (mV)K+ – 90 – 70 nel nervo,da – 80 a – 90 nel muscoloNa+ + 60

Potenziale di membrana 49
Er e EK non coincidono perfettamente quindi K+ si sposta dall’interno all’esterno perché la forza chimica è maggioredi quella elettrostatica (all’esterno prevalgono le cariche positive e all’interno le negative): f.e.m. = Er – EK = – 70mV – (– 90 mV)= 20 mV.Na+ non è all’equilibrio e si sposta dall’esterno all’interno perché sia la forza chimica che quella elettrostatica sonoconcordi poiché segue sia il gradiente di carica che quello di concentrazione: f.e.m. = Er – ENa = – 70 mV – 60 mV= – 130 mV. Ma la permeabilità (e quindi la conduttanza) della membrana per Na+ è bassa, quindi ne passa di menodi quello che dovrebbe passare. Quindi nel complesso il flusso di K+ dall’interno verso l’esterno è uguale al flussodall’esterno verso l’interno di Na+.Il Na+ che entra riduce la carica negativa presente all’interno della cellula abbassando la forza elettrostatica epermettendo così che la forza chimica che agisce sul K+ prevalga su questa, ciò permette il lieve flusso di K+.Quindi il flusso di K+ è una conseguenza del flusso del Na+.In base alle considerazioni fatte emerge che i flussi di Na+ e K+ sono uguali ed opposti, quindi l’effetto a brevetermine sul potenziale di membrana complessivo è nullo (poiché la quantità di carica che esce sottoforma di K+ èuguale a quella che entra sottoforma di Na+).Ma a lungo termine questo flusso di Na+ e K+, ognuno in un’unica direzione, annullerebbe i gradienti diconcentrazione dei due ioni (cioè la quantità citosolica di uno ione diventerebbe uguale alla quantità extracellularedello stesso ione) e quindi porterebbe il meccanismo ad interrompersi: [X]int = [X]est quindi
Ex = _ R ∙ T ∙ ln [X]int = – 60 mV ∙ Lg 1 = – 60 mV ∙ Lg 100 = – 60 mV ∙ 0 = 0 mVZ ∙ F [X]est
Per evitare che ciò avvenga esiste la pompa Na+, K+ ATPasi che mantiene il gradiente di concentrazione pompandoattivamente Na+ fuori dalla cellula e K+ nella cellula. Inoltre la pompa Na+, K+ è elettrogenica cioè generaattivamente il 5-10% del potenziale di membrana pompando attivamente 2 K+ dentro e 3 Na+ fuori.
CitoplasmaIl citoplasma è una matrice acquosa colloidale (detta più propriamente citosol) che contiene gli organuli e alcunisistemi di membrane; è presente sia nelle cellule eucariote sia in quelle procariote.
StrutturaIl citoplasma occupa circa la metà del volume totale della cellula e vi si trovano disperse tutte le sostanze chimichevitali tra cui sali, ioni, zuccheri, una grande quantità di enzimi e proteine e la maggior parte dell'RNA. L'acquacostituisce circa il 75-85 per cento delle sostanze contenute nel citoplasma, ed è formato inoltre da sali minerali,sostanze organiche e inorganiche. La matrice citoplasmatica può essere definita plasmagel o plasmasol a secondadello stato di aggregazione delle proteine.Nelle cellule eucariote, il citoplasma contiene un'intelaiatura formata da una complessa rete di filamenti costituiti daproteine fibrose e/o globulari che costituiscono il → citoscheletro. Il citoscheletro conferisce alla cellula la sua formacaratteristica, rende possibili gli spostamenti degli organuli cellulari e coordina funzioni biologiche fondamentali,come la → divisione cellulare.

Citoplasma 50
Principali organuli del citoplasmaGli organuli cellulari principali contenuti nel citoplasma sono:• → mitocondri,• → ribosomi,• → lisosomi,• → perossisomi,• → reticolo endoplasmatico liscio e rugoso,• apparato di Golgi,• → centrioli (non presenti in tutte le cellule eucariote).
FunzioniÈ proprio nel citoplasma che si svolgono le principali attività della vita cellulare (metabolismo, respirazionecellulare, movimenti della cellula, assorbimento, glicolisi, processi di sintesi, modificazioni della forma della cellula,fagocitosi, apoptosi).Quando si parla di cellule muscolari, il citoplasma assume il nome di sarcoplasma.
Voci correlare• Cellula• → Citoscheletro
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica

51
ORGANULI NON MEMBRANOSI
Citoscheletro
La tubulina citoscheletrica di alcune cellule endoteliali marcata in verde, l'actina inrosso, osservata in microscopia confocale.
Il citoscheletro è una fondamentale strutturacellulare. Il citoscheletro costituisce, peranalogia macroscopica, la strutturamuscolare, di movimento ed ossea, o disostegno della cellula. Le sue funzioni ditipo strutturale sono indispensabili quindi inquelle cellule eucariotiche prive di parete,inoltre permette il movimento siaintercellulare (spostamento e modificazionidi forma di tutta la cellula) che intracellulare(spostamento interno dei costituenti lacellula).
Il citoscheletro è costituitofondamentalmente da tre tipi di filamentiproteici che si distinguono per funzione ecomposizione:• filamenti actinici o microfilamenti• filamenti intermedi• microtubuli
Filamenti actinici
La componente proteica di questo tipo di filamenti è l'actina. L'actina è una proteina globulare che lega ATP.Con il loro spessore di 6-7nm, sono i filamenti citoscheletrici più sottili. Hanno una polarità strutturale, ovverohanno un'estremità +, dove l'aggiunta di g-actina avviene velocemente e contribuisce quindi all'allungamento delfilamento, ed una parte - che influisce poco sull'accrescimento.La polimerizzazione inizia lentamente con 3 molecole di actina che si legano tra loro. Nella cellula la concentrazionedi actina libera è molto alta, quindi altre molecole di actina si legano a questo polimero neoformato ed il processodiventa man mano più veloce fino a che non si giunge ad un punto di equilibrio con l'actina libera nella cellula.Le proteine associate ai filamenti actinici sono numerose: ci sono proteine che inibiscono la polimerizzazione deifilamenti, altre che tagliano i filamenti e altre ancora che li incappucciano per evitare che si accrescano; ci sonoanche proteine che collegano i microfilamenti per formare un fascio, come avviene nei → microvilli, ed altreproteine che conferiscono la contrattilità ai filamenti actinici rendendoli così capaci di far cambiare forma alla cellulae di dirigere i traffici interni ad essa.

Citoscheletro 52
La miosinaÈ una proteina presente in tutte le cellule eucariotiche. È dotata di attività ATPasica, cioè è in grado di idrolizzarel'ATP (adenosintrifosfato).Esistono diverse isoforme di miosina all'interno delle cellule. Nel complesso le varie isoforme funzionano da "motoriproteici" per l'actina; in pratica accoppiano l'idrolisi della molecola di ATP con cambiamenti conformazionali checontribuiscono a generare la forza meccanica per i vari tipi di motilità cellulare e sub-cellulare (contrazione cellulare,citocinesi, traffico di vescicole).La struttura della miosina consiste in due parti principali: la testa globulare, che lega la molecola di actina ed è dotatadi attività ATPasica (cioè in grado di idrolizzare l'ATP) e da una coda, unita alla testa, che consiste in due cateneproteiche con conformazione ad elica avvolte insieme.Il complesso actina-miosina, nelle cellule muscolari scheletriche dei Vertebrati, forma una struttura caratteristicadetta sarcomero, da cui dipende la contrazione delle fibre muscolari. La contrazione muscolare è influenzataessenzialmente dalla concentrazione intracellulare dello ione calcio, ma anche da altre proteine, come latropomiosina, la troponina e la nebulina.
Filamenti intermediChiamati così per il loro spessore (circa 10nm) intermedio tra quello dei microtubuli e quello dei filamenti actinici.Le molecole che li costituiscono sono filamentose e variano a seconda del tipo di cellula. possiedono una granderesistenza alla trazione e consentono alla cellula di sopportare stress meccanici. A differenza degli altri filamenticitoscheoletrici, i filamenti intermedi non sono polarizzati e sono più stabili.La polimerizzazione dei filamenti intermedi avviene nel seguente modo: 2 molecole di gas si aggregano formandoun dimero, che va ad unirsi ad un altro dimero formando un tetramero; infine i tetrameri si aggregano a loro voltafino a che non arrivano a formare un filamento di 32 molecole base molto simile ad una corda.Una categoria di filamenti intermedi presenti in tutte le cellule è quella delle lamìne, ovvero quel particolare tipo difilamenti che va a costituire la lamina nucleare. Nel processo di divisione cellulare la lamina nucleare devescomparire, altrimenti il materiale genetico della cellula non potrebbe ripartirsi tra le due cellule figlie. È necessarioquindi che le proteine che costituiscono i filamenti intermedi della lamina nucleare vengano fosforilate, in modo darenderle instabili e portarle alla depolimerizzazione. I filamenti intermedi della lamina nucleare sono controllati neiloro processi di polimerizzazione e depolimerizzazione dalla proteina chinasi.
MicrotubuliSono tubi proteici cavi del diametro di 25nm (diametro esterno) capaci di autodemolirsi rapidamente in una sede ericostituirsi altrettanto velocemente in un'altra. le loro pareti sono formate da 13 protofilamenti. Anche i microtubulisono polari. Sono composti da eterodimeri formati da una molecola di tubulina-α e una di tubulina-β. la tubulina èuna proteina capace di legarsi a GTP, ma solo la tubulina-β può idrolizzare GTP a GDP.Il processo di polimerizzazione dei microtubuli inizia molto lentamente: più eterodimeri di tubulina-αβ, tramite unprocesso detto di nucleazione, vanno a formare un piccolo microtubulo. una volta che si è formato, il piccolomicrotubulo si accresce da entrambe le parti (ma la velocità di accrescimento è maggiore all'estremità +) e ilcompletamento è rapido.In vitro si osserva che, a bassissime concentrazioni di tubulina libera, sia l'estremità + che quella - si accorciano.Man mano che la concentrazione di tubulina libera aumenta, la depolimerizzazione rallenta fino a che non siraggiunge un punto di equilibrio, detto punto critico. l'equilibrio che si raggiunge è di tipo dinamico. In vitro si puòosservare il cosiddetto fenomeno a mulinello. Se le concentrazioni di tubulina libera sono abbastanza elevate, imicrotubuli si formano spontaneamente.

Citoscheletro 53
Nella cellula la concentrazione di tubulina libera non è sufficiente da poter permettere la formazione spontanea deimicrotubuli, i quali per formarsi hanno quindi bisogno di un punto di innesco che, nelle cellule animali è dato dallatubulina-γ, una molecola a forma di anello presente sul centrosoma. Mantenendo bassa la concentrazione di tubulinalibera, la cellula può controllare la formazione dei microtubuli, i quali presenteranno quindi un'instabilità dinamica,ovvero si depolimerizzerano e ripolimerizzerano di continuo a partire dal centrosoma. I microtubuli possonostabilizzarsi se alla loro estremità + si forma un cappuccio a GTP, che si forma se prima che la tubulina-β idrolizzi ilGTP si attacca al microtubulo un altro eterodimero. Un microtubulo che nasce dal centrosoma può nondepolimerizzarsi se alla sua estremità + (quella più lontana da centrosoma) si va ad attaccare una molecola o unastruttura cellulare. Si potrebbe paragonare il centrosoma ad un pescatore che lancia le sue lenze e, se non abboccaniente, le ritira indietro per poter effettuare un nuovo lancio.Due microtubuli possono scorrere l'uno sull'altro grazie a speciali proteine presenti sui microtubuli che trasformanol'energia derivante dall'idrolisi di ATP in energia motrice. al microtubulo possono attaccarsi anche organuli evescicole, che possono quindi scorrere per mezzo delle proteine motrici verso l'estremità + (le proteine motricisaranno chinesine) o verso l'estremità - (le proteine motrici saranno dineine) del microtubulo.
Ciglia e flagellispeciali proteine dette MAPs (microtubules associated proteins) possono stabilizzare in maniera permanente imicrotubuli che vanno così a formare ciglia e flagelli.Le ciglia servono per il movimento della cellula. Generalmente sono numerose sulla superficie cellulare. possonocreare correnti nel liquido intorno alla cellula in modo da indirizzare il cibo verso il luogo in cui verrà digerito, comesuccede per esempio nelle spugne. La parte interna di un ciglio è detta assonema ed è costituito da una membranache racchiude 9 coppie di microtubuli alla periferia più due microtubuli non accoppiati al centro. Questa struttura èdetta 9+2 e si ritrova in quasi tutte le forme di ciglia e flagelli eucariotici, dai protozoi all'uomo. l'assonema si attaccaal corpuscolo basale, anch'esso formato da microtubuli, con una struttura leggermente diversa da quelladell'assonema: ci sono 9 triplette ai lati. Nelle ciglia si trovano solo le dineine come proteine motrici.
Voci correlate• ParM
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica

Microvilli 54
MicrovilliI microvilli sono delle estroflessioni della membrana plasmatica del polo apicale di cellule appartenenti al tessutoepiteliale di rivestimento. Sono alti 1 μm e larghi 0,08 μm circa. Hanno la funzione di aumentare la superficie discambio, infatti si trovano su cellule impiegate nell'assorbimento di acqua e nutrienti, come gli enterocitinell'intestino e le cellule che rivestono il lume del tubulo contorto prossimale nel rene.
Costituzione dei microvilliLa struttura dei microvilli è mantenuta dal → citoscheletro, costituito da una trentina di microfilamenti di actinaordinati parallelamente e tenuti insieme da ponti di villina e fimbrina. La zona apicale del fascio di microfilamenti(terminazione positiva) è stabilizzata da un cappuccio proteico ed è collegata lateralmente alla membrana attraversola calmodulina e la miosina I. Alla base del microvillo, i microfilamenti sono invece ancorati ad una zona corticale,ricca in actina e spectrina.
Osservazione al microscopioI microvilli, essendo alti 1 micron non sono distinguibili al microscopio ottico (a differenza delle ciglia). La loropresenza però costituisce un ispessimento della superficie libera delle cellule epiteliali, chiamato "orletto striato".Sono invece ben identificabili e caratterizzabili con il microscopio elettronico a trasmissione.
Voci correlate• Ciglia• Flagello

Ciglia (cellule) 55
Ciglia (cellule)
Sezione trasversa di due ciglia, che mostrano la tipica struttura "9+2"
In una cellula, le ciglia sono delle appendicicellulari lunghe e sottili che si estendonodalla superficie di molte celluleeucariotiche. Queste sono perlopiù lunghe enumerose. Le ciglia si originano, insieme aiflagelli, dal corpo basale, anche questocostituito da microtubuli, il cui numero edisposizione mostrano qualche differenza.La struttura delle ciglia e del corpo basalesono dette "9+2" poiché presentano unanello di nove doppiette di microtubuli edue microtubuli al centro dell'anello. Imicrotubuli al centro dell'anello sonoseparati e completi (possiedono quindi 13protofilamenti di tubulina).
Ciglia mobili
Queste strutture mobili specializzate esercitano un movimento a frusta determinato dalla curvatura dell'assonema.Hanno un diametro di circa 0,2 μm e una lunghezza di 5 -10 μm.
Le ciglia vibratili caratterizzano la superficie apicale delle cellule epiteliali che tappezzano le vie respiratorie e le viegenitali femminili: nel primo caso esse sono incaricate di spingere continuamente verso l'esterno lo strato di mucoche ricopre l'epitelio e che contiene eventuali particelle solide, penetrate accidentalmente con l'aria inspirata; nelsecondo caso le ciglia vibratili con il loro movimento facilitano la progressione della cellula uovo dalla tuba versol'utero.Tali strutture sono presenti anche in alcuni protozoi dove con il loro battito sincrono permettono la mobilità e ilconvogliamento di particelle alimentari verso l'apparato buccale.
Voci correlate• Flagello• Chinociglio
Cellula

Ciglia (cellule) 56
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Flagello (biologia)
Alcuni rappresentanti dell'ordine dei Flagellati da unastampa antica
I flagelli sono appendici cellulari, lunghe e sottili, disposte inmodo differente in vari organismi monocellulari, tra cui iflagellati. Hanno una funzione motoria, e sono tipici soprattuttodei batteri bacillari, in quanto i cocchi preferiscono gli ambientisecchi.
Nella distribuzione polare sono localizzati ad uno o ad entrambi ipoli della cellula, in quella peritrica si originano da numerosi puntimentre in quella lofotrica un ciuffo di flagelli si origina daun'estremità della cellula. A seconda della quantità e delladistribuzione, i batteri prendono il nome di:• Monotrici (possiedono un solo flagello, ad una estremità)• Anfitrici (possiedono due flagelli, alle estremità)• Lofotrici (più flagelli ad un'estremità a formare un ciuffo)• Peritrici (più flagelli sparsi su tutta la superficie)I flagelli sono implicati nel moto cellulare, in particolare nellachemiotassi, che consente alla cellula di compiere un motosemidirezionato in base al campionamento temporale (compiuto dachemiorecettori) di attraenti e repellenti. Il movimento rotatorionon è casuale; un movimento antiorario imprime il moto albatterio, un movimento orario determina l'arresto. Solo i batterimonotrici hanno la possibilità di compiere il solo movimento antiorario. La velocità massima che può essereraggiunta da un batterio dotato di flagello varia tra i 3 e i 60 μm/s.

Flagello (biologia) 57
Costituzione del flagello
Modello di un flagello batterico
Questi hanno forma elicoidale e sono costituiti da tredomini differenti: filamento, uncino e corpo basale.Di seguito sono elencate le brevi definizioni di questeparti del flagello.
Il filamento
Il filamento è la parte che si estende dalla cellula nelmezzo circostante, è formato da numerose sub unità diuna proteina detta flagellina. A differenza degliorganismi eucarioti, i flagelli dei procarioti nonpossiedono dei microtubuli al loro interno.
L'uncino
L'uncino è invece una singola proteina con la funzionedi connettere il filamento al corpo basale, il suo nomesi riferisce alla forma arcata che imprime al filamentoun moto circolare.
Il corpo basale
Il corpo basale o cinetosoma è una struttura complessadifferente nei gram negativi e positivi, accomunatadalla presenza dell'anello MS immerso nella →membrana citoplasmatica e complessato con proteineMOT (che permettono il moto grazie ad una forzaprotone-motrice) e proteine FLI (che invertono larotazione dell'uncino).

Flagello (biologia) 58
Flagelli in cellule di Metazoi
Esempio di microrganismo flagellato
La forma del flagello si ritrova anche in alcune cellule di metazoi,come ad esempio gli spermatozoi. Le piante più evolute e i funghinon producono flagelli, anche se ciò avviene nell'alga verde e nellechitridi strettamente imparentate. Molti protisti hanno la forma diflagelli. I flagelli si trovano in molti organismi eucarioti eprobabilmente tutti gli eucarioti da cui si sono evoluti hanno avutoorigine da questi.
Loro forma e comportamento
I flagelli eucarioti sono coadiuvati da microtubuli in unadisposizione caratteristica, con nove coppie affusolate attorno aidue singoli centrali. Queste si formano da un corpo basale ochinetosoma, con le radici dei microtubuli che formano una parteimportante della struttura cellulare. In alcuni, ad esempio,coadiuvano un citostoma p una bocca dove il cibo viene ingerito. I flagelli spesso sono dotati di peli chiamatimastigonemi, o contengono cannule. La loro ultrastruttura ha un ruolo importante nella classificazione deglieucarioti.
Nei protisti e negli animali microscopici, i flagelli sono generalmente utilizzati per la propulsione. Potrebbero anchevenire usati per creare una corrente che porta nutrimento. In molti eucarioti uno o più flagelli vengono sistemativicino o sulla parte anteriore della cellula. Spesso ve n'è uno diretto in avanti e un altro che lo insegue all'indietro.Tra gli animali, i funghi e i Choanozoa, che costituiscono un gruppo denominati opistoconti, è presente un unicoflagello posteriore.
Voci correlate• Flagellata
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica

Centriolo 59
CentrioloIl centriolo è una struttura cilindrica presente nel citoplasma (in prossimità del nucleo) delle cellule animali, inalcuni funghi, alghe e in alcune piante. Un centriolo ha la forma di un cilindro cavo la cui parete è formata da novetriplette di microtubuli (ossia catene di tubulina alfa e beta che si uniscono a formare foglietti di protofilamentiripiegati su sé stessi). In ciascuna tripletta è presente il microtubulo A, B e C dove A è il più vicino al centro ed èdetto "completo" perché formato da 13 protofilamenti. B e C sono detti tubuli incompleti perché formati da 11protofilamenti ciascuno.Tale struttura è analoga a quella del corpo basale di ciglia e flagelli.I centrioli si trovano in coppia e, solitamente, sono disposti tra di loro a formare un angolo di 90°. Essi sono iresponsabili della produzione dei microtubuli che costituiscono il fuso mitotico, hanno quindi un'importante funzionenella divisione cellulare.Attorno alla coppia di centrioli è presente un materiale elettrondenso chiamato materiale pericentriolare. L'insiemedei centrioli e del materiale pericentriolare è detto centrosomaÈ stato osservato che eliminando con un piccolo raggio laser i centrioli da una cellula, la capacità di divisionecellulare non viene persa, ma le cellule figlie risultano organizzate meno ordinatamente.
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica

Ribosoma 60
Ribosoma
Ribosoma 70S di Escherichia coli. In rosso la subunità grande e in blu quellapiccola. La scala è 200 Ångstrom (20 nm). I colori più chiari (azzurro e rosa)
indicano le proteine
I ribosomi (al singolare ribosoma) sonoorganelli immersi nel → citoplasma e sonole particelle responsabili della sintesiproteica. La loro funzione è quindi quella disintetizzare le proteine leggendo leinformazioni contenute in una catena diRNA messaggero (m-RNA).
Furono messi in evidenza per la prima voltaal microscopio elettronico nel 1953 dalbiologo rumeno George Emil Palade[1] ,scoperta che gli valse il Premio Nobel. Iltermine "ribosoma" fu invece proposto nel1958 dallo scienziato Richard B. Roberts[2] .
Struttura
subunità grande del ribosoma dell'archeobatterio Haloarculamarismortui. In blu le proteine, in giallo e rosa i due RNA
I ribosomi sono formati da tre molecole di RNAribosomiale e da proteine che si associano a formare duesubunità di dimensioni differenti (una più grande dell'altra).I ribosomi dei batteri degli archea e degli eucariotidifferiscono sensibilmente tra loro sia per la struttura sia perle sequenze di RNA.
Un ribosoma batterico ha una massa di circa 2700 kDa, undiametro di circa 20nm ed un coefficiente disedimentazione di 70 S.Esso si può suddividere in due parti o subunità, una piùgrande ed una più piccola:
• una subunità grande di 50 S avente almeno 34 proteine(L1-L34) e due molecole di RNA (23 S e 5 S),
• una subunità piccola di 30 S contenente almeno 21proteine (S1-S21) ed un RNA di 16 S.
Il ribosoma della cellula eucariota (fatta eccezione perquelli contenuti nei → mitocondri e nei cloroplasti), invece, è più grande ed ha una massa molecolare di 4000 kDa,un diametro di 23 nm ed un coefficiente di sedimentazione di 80 S. Anch'esso è composto da due subunità, maggiorea 60 S e minore a 40 S:
• la subunità maggiore è costituita da tre molecole di rRNA, una a 28 S, una a 5,8 S e un'ultima a 5 S.• la minore consta di una sola catena di RNA 18 S. Nel complesso le due subunità presentano inoltre più di 80
proteine.

Ribosoma 61
subunità piccola del ribosoma dell'eubatterio Thermusthermophilus. In blu le proteine, in rosa l'RNA
Le singole molecole di rRNA (tranne la 5 S) vengonosintetizzate nei nucleoli come RNA 45 S. Il DNA contenutonel nucleolo viene trascritto dalla RNA polimerasi I apartire da più punti della catena di DNA, in strutture chevengono dette ad "albero di Natale"; il tronco verrebberappresentato dal DNA, i rami dalle molte catene di rRNAche vengono trascritte nello stesso momento. rRNA 45 Sappena trascritto è detto pre-rRNA; in seguito a tagli, essodarà origine a rRNA 18 S (per la subunità minore delribosoma) e 32 S, il quale verrà tagliato ulteriormente in 28S e 5,8 S. Nel pre-rRNA sono presenti pseudouridine e basiazotate metilate. La funzione di queste modifiche nelle basisi pensa sia di evitare il taglio enzimatico, o favorire leinterazioni dell'RNA interne alla catena o con altremolecole.
DisposizioneLa loro disposizione all'interno della cellula varia a seconda del tipo di cellula ed è collegata alla funzione diquest'ultima:• se la cellula secerne le proteine prodotte, possiede solo ribosomi attaccati al reticolo endoplasmatico (che occupa
gran parte del citosol) e alla membrana nucleare;• se la cellula immagazzina queste proteine, possiede ribosomi liberi nel citoplasma.
I ribosomi liberiSono così denominati i ribosomi che si trovano liberi nel → citoplasma cellulare o che fanno parte dei → mitocondrio dei cloroplasti. Generalmente sono deputati alla sintesi di proteine che verranno rilasciate ed utilizzate nelcitoplasma o nella parte interna della → membrana cellulare negli organelli precedentemente citati ed anche neiperossisomi. Più ribosomi sono in grado di unirsi tra loro, utilizzando come legame una stessa molecola di RNAmessaggero attraverso la quale si muovono dal codone iniziale fino a quello finale, in direzione 3', a formare unpoliribosoma (o polisoma).
I ribosomi legati alle membraneSi trovano legati alle membrane costituenti il nucleo cellulare od il reticolo endoplasmatico ruvido. Si occupano disintetizzare e rilasciare proteine all'interno delle membrane di queste strutture, dove poi saranno condotte alla lorodestinazione finale che può essere sia intra- che extracellulare (nel qual caso vengono spesso espulse per esocitosi). Èda segnalare che i ribosomi attaccati alle membrane sono una sezione dell'insieme dei ribosomi liberi, la quale vienepoi reclutata non appena iniziano a sintetizzare proteine specifiche.

Ribosoma 62
Processo di traduzioneLe due subunità del ribosoma si uniscono tra loro ed operano insieme per tradurre un RNA messaggero in una catenapolipeptidica durante la sintesi proteica. Sembra che la parte più importante del ribosoma, sotto quest'aspetto, sianole molecole di RNA ribosomiale le quali da sole sono in grado, seppur lentamente, d'operare il processo ditraduzione. Questo lascia ipotizzare che la componente proteica agisca in modo tale da potenziare e velocizzarel'azione dell'RNA ribosomiale.Prima che le subunità si uniscano insieme per incominciare a tradurre la molecola di m-RNA, c’è bisogno che ilcomplesso di pre-inizio si leghi alla subunità inferiore; a questo punto il ribosoma si può collegare alla molecoladell’RNA messaggero, ed una volta che la subunità minore riconosce la tripletta di inizio, si staccano i fattori dipre-inizio, le due subunità si collegano ed il ribosoma può incominciare a sintetizzare la proteina.La subunità superiore è composta da tre siti, in ordine E, P (peptidilico) ed A (amminoacilico). Si ricordi che lasubunità inferiore possiede solo un sito d’attacco predisposto per l’mRNA.Il primo transfert si va ad inserire nel sito P, a questo punto arriva un ulteriore transfert il quale si andrà a posizionarenel sito A, ora il ribosoma scorre di una tripletta, portando gli amminoacidi tradotti presente dal sito P, a legarsi nelsito A. La tripletta codificata da P a questo punto passa al sito E, dove verrà rilasciato. In sintesi:• Il sito A è il sito che attende l’arrivo di nuove triplette da codificare;• Il sito P tiene salda la sequenza amminica, rilasciandola solamente quando il sito A ha tradotto un’ulteriore
amminoacido;• Il sito E è il sito che raccoglie le triplette usate per la codifica.
L'ipotesi del segnaleCome si è visto i ribosomi liberi e quelli legati alle membrane sintetizzano due classi di proteine tra loro differenti.Ma come può la cellula operare una simile distinzione? L'ipotesi del segnale, sviluppata nel 1971, afferma chel'informazione che permette di operare tale processo è contenuta nella sezione N-terminale della catena polipeptidica,che è la prima ad emergere dal ribosoma. Successivamente a quest'ipotesi si sono aggiunti dei dati di supporto chepermisero di arrivare al seguente modello.Il filamento di RNA messaggero da tradurre arriva al ribosoma che in quel momento è libero e contenuto nelcitoplasma. Una volta iniziata la traduzione, nella parte N-terminale (anche se in alcuni polipeptidi è più interna) ècontenuta una sequenza di 6-20 amminoacidi non polari. Tale sequenza viene riconosciuta da una particella diriconoscimento del segnale (SRP), una struttura formata da una molecola di RNA (RNA 7SL) e 6 catenepolipetidiche, che vi si lega e blocca il suo prematuro ripiegamento e la continuazione della sintesi proteica. Ciò fa sìche il ribosoma possa arrivare alle membrane del reticolo endoplasmatico rugoso, invece di completare la traduzionedella proteina che altrimenti sarebbe rilasciata nel citoplasma. La particella di riconoscimento del segnale legataagisce come un ligando che va a legarsi ad due recettori che si trovano sulla membrana citoplasmatica del reticoloendoplasmatico, uno per la SRP e l'altro per il ribosoma. Per creare il legame tra SRP ed il suo recettore è necessarioche ad SRP si leghi una molecola di guanosina trifosfato (GTP). Successivamente l'SRP viene staccata dallasequenza segnale e poi dal ribosoma, per idrolisi del GTP in guanosina difosfato (GDP) mentre la sequenza segnaleva a legarsi ad una sezione d'un canale proteico transmembrana. Essendosi staccato l'SRP il ribosoma riprende lasintesi proteica ma la catena polipeptidica viene traslocata attraverso il canale e penetra nel reticolo endoplasmatico(traslocazione). Successivamente la sequenza segnale viene tagliata da un enzima proteolitico, la peptidasi delsegnale, ed il resto della proteina viene sottoposta ad appositi processi di ripiegamento e di formazione di legamidisolfuro.

Ribosoma 63
Bibliografia• Pasqua G., Abbate G., Forni C., Botanica generale e diversità vegetale, Ed. PICCIN, 2007
Altri progetti
• Wikimedia Commons contiene file multimediali su Ribosoma
Collegamenti esterni• (EN) Nature Structural & Molecular Biology: SRP meets the ribosome [3]
Note[1] G.E. Palade. (1955) "A small particulate component of the cytoplasm". J Biophys Biochem Cytol. 1(1):59-68[2] Roberts, R. B. "Introduction" in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc[3] http:/ / www. nature. com/ nsmb/ journal/ v11/ n11/ full/ nsmb853. html

64
ORGANULI MEMBRANOSI
Mitocondrio
Schema di un mitocondrio1 Membrana interna2 Membrana esterna
3 Cresta4 Matrice
Un mitocondrio è un organulo cellulare di forma generalmenteallungata, presente in tutti gli eucarioti (con alcune eccezioni). Imitocondri sono organuli presenti nel → citoplasma di tutte le celluleanimali e vegetali a metabolismo aerobio. Mancano solo nelle celluleprocariotiche, cioè i batteri, dove le funzioni respiratorie vengonoespletate da proteine enzimatiche contenute nella membrana cellulare enelle sue invaginazioni, dette mesosomi. I mitocondri sono gliorganelli addetti alla respirazione cellulare, costituiti da sacchettecontenenti enzimi respiratori. Sono costituiti da due membrane: lamembrana interna e la membrane esterna; lo spazio fra queste duemembrane è detto spazio intermembrana. Lo spazio delimitato dallamembrana interna è detto matrice mitocondriale; la membrana internasi estende nella matrice formando delle pieghe dette crestemitocondriali, dove si concentrano gli enzimi respiratori.
Struttura
Sezione di due mitocondri visti tramite unmicroscopio elettronico
Il mitocondrio, isolato dalla struttura cellulare che lo circonda, assumeuna forma che ricorda quella di un salsicciotto ed è lungo 1-4 μm ed haun diametro di 0,2-1 μm. Nella cellula, esso assume una forma piùcomplessa; ad esempio nelle piante (Arabidopsis thaliana) e nel lievito(Saccharomyces cerevisiae) è più opportuno parlare di una retemitocondriale in cui i mitocondri vanno incontro a fissione e fusione[1][2].
È delimitato da una doppia membrana: quella esterna permette ilpassaggio di piccole molecole, quella interna è selettivamentepermeabile e ripiegata in estroflessioni chiamate creste mitocondrialiche ne aumentano la superficie. La membrana interna si presenta sottoforma di numerosi avvolgimenti, rientranze e sporgenze, queste sono dette creste mitocondriali. La funzione diqueste strutture è quella di aumentare la superficie di membrana che permette di disporre un numero maggiore dicomplessi di ATP sintetasi e di fornire pertanto maggiore energia. Le due membrane identificano due differentiregioni: lo spazio intermembrana cioè quello interposto tra la la membrana esterna e quella interna, e la matrice,spazio circoscritto dalla membrana interna.

Mitocondrio 65
Le membrane del mitocondrioLe due membrane mitocondriali presentano differenti proprietà a causa della loro diversa composizione.La membrana esterna è composta per il 50% da lipidi e per il resto da svariati enzimi dalle molteplici attività tra cui:l'ossidazione dell'adrenalina, l'allungamento degli acidi grassi e la degradazione del triptofano. Essa, inoltre, contieneporine: canali proteici transmembrana, formati per lo più da foglietti β, non selettivi. Ciò fa sì che la membranaesterna sia assai permeabile e permetta il passaggio di molecole di massa fino a 5000 Dalton. Quest'elevatapermeabilità era già nota all'inizio del XX secolo allorché venne notato il rigonfiamento cui i mitocondri vannosoggetti a seguito della loro immersione in una soluzione ipotonica.La membrana interna ha un rapporto proteine/lipidi che si aggira intorno a 3:1 (che significa che per ogni 15 proteinevi è un fosfolipide) e contiene più di 100 molecole polipeptidiche. Un'altra caratteristica particolare, in quantopropria delle membrane batteriche, è la presenza di molecole di cardiolipina (difosfatidil-glicerolo) e l'assenza dicolesterolo. La membrana interna, contrariamente a quella esterna, è selettivamente permeabile, priva di porine, macon trasportatori transmembrana altamente selettivi per ogni molecola o ione. A seguito di ciò le due facce dellamembrana interna vengono chiamate, rispettivamente, versante della matrice e versante citosolico (in quanto vienefacilmente raggiunto dalle piccole molecole del → citosol cellulare) oppure versante N e versante P in ragione deldiverso potenziale di membrana (neutro nel versante citosolico e positivo nello spazio intermembranoso interno).
La matrice mitocondrialeLa matrice mitocondriale ha consistenza gelatinosa a causa della concentrazione elevata di proteine idrosolubili(circa 500 mg/ml). Essa contiene, infatti, numerosi enzimi, → ribosomi (70S, più piccoli di quelli presenti nel restodella cellula) e molecole di DNA circolare a doppio filamento.
Il genoma mitocondrialeIl genoma mitocondriale contiene 16569 coppie di basi e possiede 37 geni codificanti per due RNA ribosomiali(rRNA), 22 RNA di trasporto (tRNA) e 13 proteine che fanno parte dei complessi enzimatici deputati allafosforilazione ossidativa. È da notare, comunque, che il numero di geni presenti sul DNA mitocondriale è variabile aseconda delle specie. In ogni mitocondrio si trovano da due a dieci copie del genoma. Il resto delle proteine presentinel mitocondrio deriva da geni → nucleari i cui prodotti vengono appositamente trasportati. Le proteine destinate almitocondrio generalmente vengono riconosciute grazie ad una sequenza leader presente sulla loro parte N-terminale.Tale sequenza contiene da 20 a 90 amminoacidi, di cui nessuno carico negativamente, con all'interno alcuni motiviricorrenti, e sembra che abbia un'elevata possibilità di dare origine ad una α-elica anfipatica. Circa 28 dei genimitocondriali (2 rRNA, 14 tRNA e 12 proteine) sono codificati su uno dei due filamenti di DNA (detto H, da heavystrand) mentre i rimanenti geni (8 tRNA e 1 proteina) sono codificati sul filamento complementare (detto L, da lightstrand). La presenza della catena di trasporto degli elettroni con la sua capacità di produrre radicali liberi, lamancanza di istoni ed i limitati sistemi di riparo, rendono il DNA mitocondriale facilmente danneggiabile ed ineffetti il suo tasso di mutazione è circa dieci volte maggiore di quello nucleare. Ciò fa sì che si possano averesequenza mitocondriali differenti anche all'interno di uno stesso individuo.La presenza di ribosomi permette al mitocondrio di svolgere una propria sintesi proteica.Una particolarità del codice genetico mitocondriale sta nel fatto che esso è leggermente diverso da quellocomunemente noto. Il codone UGA, normalemente codone di stop, codifica per il triptofano. I vertebrati, inoltre,usano la sequenza AUA (e l'uomo anche AUU) per codificare la metionina (e non l'isoleucina) mentre AGA ed AGGfunzionano come codoni di stop. Si è visto, inoltre, che tra specie diverse vi possono essere differenze nel codicemitocondriale che, di conseguenza, non è uguale per tutti.Il DNA mitocondriale umano viene ereditato per via matrilineare (eredità non mendeliana) in quanto durante il processo di fecondazione i mitocondri dello spermatozoo sono marcati con ubiquitina, una proteina che si lega ad

Mitocondrio 66
altre proteine che devono essere degradate. In conseguenza di ciò, il genoma mitocondriale della prole sarà quasiuguale a quello materno (fatte salve eventuali mutazioni) ed, inoltre, se la madre è affetta da una malattia atrasmissione mitocondriale, la erediteranno tutti i figli, mentre se ne è affetto il padre, non la erediterà nessuno. Inletteratura sono riportati rarissimi casi in cui il DNA mitocondriale sembra derivare dal padre o da entrambi igenitori
Le funzioni del mitocondrioIl mitocondrio è in grado di svolgere molteplici funzioni. La più importante tra esse consiste nell'estrarre energia daisubstrati organici che gli arrivano per produrre un gradiente ionico che viene sfruttato per produrre adenosintrifosfato(ATP). Gli altri processi in cui il mitocondrio interviene sono:• l'apoptosi e la morte neuronale da tossicità da glutammato,• regolazione del → ciclo cellulare,• regolazione dello stato redox della cellula,• sintesi dell'eme,• sintesi del colesterolo,• produzione di calore.
La produzione di energiaÈ la funzione principale del mitocondrio e viene svolta utilizzando i principali prodotti della glicolisi: il piruvato edil NADH. Essi vengono sfruttati in due processi: il ciclo di Krebs e la fosforilazione ossidativa.
Il ciclo di Krebs
Le molecole di piruvato prodotte dalla glicolisi vengono trasportate all'interno della matrice mitocondriale dovevengono decarbossilate per formare gruppi acetili che vengono coniugati con il Coenzima A (CoA) per formareacetilCoA. Il tutto viene catalizzato dalla piruvato deidrogenasi: un grosso complesso multienzimatico.Successivamente l'acetilCoA viene immesso nel ciclo di Krebs o ciclo degli acidi tricarbossilici o ciclo dell'acidocitrico che permette di generare 3 molecole di NADH ed una di FADH2 secondo la seguente reazione generale:AcetilCoA + 2 H2O + FAD + 3 NAD+ + GDP + Pi → 2 CO2 + FADH2 + 3 NADH + 3 H+ + GTP + HS-CoATutti gli enzimi del ciclo di Krebs si trovano liberi nella matrice, fatta esclusione per il complesso della succinatodeidrogenasi che è legata alla membrana mitocondriale interna nel versante N.
Fosforilazione ossidativa: la catena di trasporto degli elettroni
Vengono utilizzati sia il NADH che il FADH2 prodotti dalla glicolisi e dal ciclo di Krebs. Attraverso un complessomultienzimatico avente le funzioni di catena di trasporto gli elettroni vengono prelevati da NADH e FADH2 e, dopouna serie di passaggi intermedi, vengono ceduti all'ossigeno molecolare (O2) che viene ridotto ad acqua. Durante iltrasferimento elettronico le varie proteine trasportatrici subiscono dei cambiamenti conformazionali che consentonodi trasferire dei protoni dalla matrice allo spazio intermembrana contro un gradiente di concentrazione.Nel mitocondrio si possono isolare ben quattro complessi poliproteici responsabili del trasporto degli elettroni:• Complesso I (NADH deidrogenasi) che contiene almeno 30 diversi polipeptidi, una flavoproteina e 9 centri
ferro-zolfo e per ogni coppia di elettroni fatta passare vengono trasferiti tre o quattro protoni,• Complesso II (Succinato deidrogenasi) che, oltre a catalizzare una reazione del ciclo di Krebs, consente il
trasferimento di elettroni al FAD ed all'ubichinone ma non permette il passaggio di protoni,• Complesso III (Citocromo c riduttasi) che contiene circa 10 polipeptidi e gruppi eme ed un centro ferro-zolfo,
permette il passaggio di elettroni dall'ubichinone ridotto al citocromo c e per ogni coppia di elettroni trasferiscequattro protoni,

Mitocondrio 67
• Complesso IV (Citocromo c ossidasi) che contiene almeno 13 polipeptidi permette il trasferimento di elettroni dalcitocromo c all'ossigeno ed anche lo spostamento dei protoni anche se non ne è ben chiaro il numero (forsequattro per ossigeno ridotto).
Successivamente i protoni vengono rifatti passare attraverso la membrana interna, in un processo di → diffusionefacilitata, tramite l'enzima ATP sintetasi che ottiene così l'energia sufficiente per produrre molecole di ATP,trasferendo un gruppo fosfato a dell'ADP. Si è visto che una coppia di elettroni, prelevati da NADH, è in grado dirilasciare un quantitativo d'energia sufficiente a produrre tre molecole di ATP mentre con una coppia elettronicaottenuta dal FADH2 se ne ottengono due.Sia la glicolisi che la fosforilazione ossidativa permettono di ottenere ben trentotto molecole di ATP per ogniglucosio utilizzato (anche se questo valore può anche variare a seconda del rapporto [ATP]/[ADP] intracellulare).L'importanza del trasferimento dei protoni attraverso la membrana mitocondriale interna nella sitesi di ATP,meccanismo definito chemioosmotico, venne individuato nel 1961 da Peter Mitchell il quale ottenne, per questo, ilpremio Nobel per la chimica nel 1978. Nel 1997 a Paul D. Boyer e John E. Walker venne consegnato le stessopremio per aver chiarito il meccanismo d'azione della ATP sintetasi
Il mitocondrio e l'apoptosiIl mitocondrio funziona da centrale d'integrazione degli stimoli apoptotici. Essi possono essere di molteplice natura(caspasi, ceramide, vari tipi di chinasi, ganglioside GD3, ecc...) e sono in grado di determinare l'apertura di uncomplesso poliproteico chiamato poro di transizione mitocondriale (Permeability Transition Pore Complex, PTPC)localizzato in alcuni punti di contatto tra le due membrane mitocondriali. Quest'evento che fa cadere la differenza dipotenziale, per uscita dei protoni, ed ingresso di molecole prima interdette all'ingresso. Come risultato finale, ilmitocondrio si riempe di liquido e la membrana esterna scoppia liberando nel citoplasma fattori stimolanti l'apoptosicome AIF, (Apoptosis Inducing Factor) che è in grado di raggiungere il nucleo ed attiva una via indipendente dallecaspasi in grado di degradare il DNA, ed il citocromo c che si lega alle proteine Apaf-1 (apoptotic proteaseactivating factor) e caspasi 9 ed una molecola di ATP formando un complesso definito apoptosoma. La caspasi 9presente diviene in grado di attivare altre caspasi che danno il via ad una cascata molecolare che si conclude con ladegradazione del DNA ad opera di fattori nucleari.Ai processi di alterazione della permeabilità del mitocondrio prendono parte anche i membri della famiglia di bcl-2,composta da almeno 16 proteine, le quali sono in grado di interagire con le membrane nucleari, mitocondrialeesterna e del reticolo endoplasmatico grazie al loro dominio C-terminale. Tale famiglia contiene elementi siaantiapoptotici, come Bcl-2 e Bcl-XL, sia proapoptotici, come Bax, Bid, Bad, Bik, Bim, Bcl-XS, DIva.Tali membri possono unirsi formando omodimeri od eterodimeri che hanno attività sia propoptotica (es:Bax/Bax) siaantiapoptotica (es:Bcl-2/Bcl-2, Bcl-XL/Bcl-2). L'evento chiave consiste nell'abbondanza dei fattori propapototicirispetti a quelli protettivi. Se questo evento avviene allora si formeranno dimeri i grado di alterare la permeabilità delmitocondrio.
Il mitocondrio e la tossicità da glutammatoL'eccessiva stimolazione del recettore per l' N-metil-D-aspartato (recettore NMDA), da parte del glutammato, è ingrado di produrre un ingresso massivo di calcio che può portare a morte il neurone tramite diverse vie apoptotiche oper necrosi a seconda dell'intensità dello sitimolo. Una di queste vie interessa anche il mitocondrio.Il calcio in eccesso che affluisce, in effetti, va a sovraccaricare il mitocondrio, penetrandovi, determinando cosìperdita del suo potenziale di membrana e diminuzione della produzione di ATP per disaccoppiamento dellafosforilazione ossidativa con la sintesi di ATP. Ciò fa sì che le pompe di membrana ATP dipendenti responsabili delmantenimento della depolarizzazione smettano di funzionare e ciò, in un circolo vizioso, aumenta l'ingresso dicalcio. Viene, inoltre, stimolata la produzione d'ossido nitrico che sembra possedere un'azione inibitoria sulla catenadi trasporto mitocondriale.

Mitocondrio 68
Il mitocondrio e lo stato ossidoriduttivo della cellulaDurante la fosforilazione ossidativa può accadere che un solo elettrone vada a ridurre una molecola di O2determinando la produzione d'un anione superossido (O2•), un radicale assai reattivo. Generalmente questofenomeno viene evitato, tuttavia non è possibile evitarlo completamente.O2• può essere protonato a formare il radicale idroperossido (HO2•) che può reagire, a sua volta, con un altro anionesuperossido per produrre perossido di idrogeno (H2O2) secondo la seguente reazione:2 HO2• → O2 + H2O2La sintesi di radicali liberi è anche un processo che, se opportunamente controllato, può essere una valida armacontro determinati microorganismi. Durante l'infiammazione, infatti, i leucociti polimorfonucleati sono soggetti aduna produzione massiva di questi radicali per attivazione dell'enzima NADPH ossidasi.Per far fronte alla presenza di radicali liberi, che potrebbero comportare dei gravi danni, la cellula deve utilizzaredegli specifici sistemi atti alla loro eliminazione:• la catalasi che è un enzima che catalizza la reazione di eliminazione del perossido di idrogeno (2 H2O2 → O2 + 2
H2O),• il glutatione (GSH) che determina l'eliminazione dei radicali liberi sfruttando il gruppo sulfidrile nella sua forma
ridotta (H2O2 + 2 GSH → GSSG (omodimero di glutatione) + 2 H2O, 2 OH• + 2 GSH → GSSG + 2 H2O),• vari antiossidanti quali l'acido ascorbico e le vitamine A ed E,• il gruppo delle superossidodismutasi.
La sintesi dell'emeLa sintesi delle porfirine è un processo enzimatico altamente conservato che nell'uomo determina la sintesi delgruppo eme mentre in altri organismi serve anche a produrre composti strutturalmente simili, come la cobalamina, leclorine e le batterioclorine. All'interno del mitocondrio avvengono parte delle reazioni che portano alla sintesidell'eme che poi viene portato fuori nel citoplasma dove viene coniugato con le catene polipeptidiche.La prima tappa di questo processo consiste nella condensazione, catalizzata dalla acido d-aminolevulinico sintetasi,della glicina con il succinilCoA che porta alla formazione di acido d-aminolevulinico che poi esce dal mitocondrio.Successivamente due molecole di acido d-aminolevulinico si condensano, per azione della acido d-aminolevulinicodeidratasi, a formare il porfobilinogeno. Quattro molecole di profobilinogeno, poi, si condensano per formare untetrapirrolo lineare, per opera della porfobilinogeno deaminasi. Il tetrapirrolo ciclizza formando uroporfirinogeno IIIche dopo viene trasformato in coproporfirinogeno III, dalla uroporfirinogeno III decarbossilasi, il quale rientra nelmitocondrio. Successivamente, ad opera della coproporfirinogeno III ossidasi, viene sintetizzata ilprotoprofirinogeno IX che, dalla protoporfirinogeno IX ossidasi viene trasformato in protoprofirina IX cui, dallaferrochelatasi viene aggiunto Fe2+ per formare il gruppo eme.
La sintesi del colesteroloLa sintesi del colesterolo è un fenomeno che avviene a livello del citoplasma cellulare e che parte con l'acetilCoA ilquale viene prodotto a livello mitocondriale durante il ciclo di Krebs.
La produzione di caloreAlcuni composti come il 2,4-dinitrofenolo od il carbonilcianuro-p-fluorometossifenildrazone sono in grado di creare un disaccoppiamento tra il gradiente protonico e la sintesi di ATP. Ciò avviene in quanto hanno la capacità di trasporatare essi stessi i protoni attraverso la membrana mitocondriale interna. Il disaccoppiamento creatosi aumenta il consumo di ossigeno e la velocità con cui il NADH si ossida. Questi composti hanno permesso di indagare meglio sulla fosforilazione ossidativa ed hanno anche permesso di capire che il fenomeno del disaccoppiamento ha la funzione di produrre calore, in diverse condizioni, al fine di mantenere costante la temperatura corporea: in animali

Mitocondrio 69
in letargo, cuccioli appena nati (tra cui anche l'uomo) ed in mammiferi che si sono adattati ai climi freddi.Il disaccoppiamento avviene in un tessuto specializzato: il tessuto adiposo bruno. Esso è, infatti, ricco di una proteinadisaccoppiante chiamata termogenina, formata da due subunità con massa complessiva di 33 Kd, che ha la capacitàdi formare una via in cui i protoni possono transitare per entrare nella matrice mitocondriale e ciò determinaproduzione di calore. Questo fenomeno è attivato dalla presenza di acidi grassi che vengono liberati, in risposta asegnali ormonali, dai trigliceridi cui si trovano attaccati.
Analisi del DNA mitocondrialeVista la matrilinearità dell'ereditarietà del genoma mitocondriale, i genetisti e gli antropologi hanno utilizzato ilDNA del mitocondrio in studi di genetica delle popolazioni e d'evoluzionistica ma esso viene anche impiegato nelcampo delle scienze forensi specie in casi in cui il materiale biologico sia molto degradato. L'analisi del DNA delmitocondrio permette di far luce sui gradi di parentela, sulle migrazioni e discendenze delle popolazioni e può venirusato anche per dirimere casi di determinazione del sesso.Le principali metodiche utilizzate nello studio del DNA mitocondriale sono:• il southern blot dopo un taglio effettuato tramite enzimi di restrizione,• la marcatura terminale, che rispetto al Southern Blot consente di visualizzare frammenti di DNA molto corti che
altrimenti sfuggirebbero,• la reazione a catena della polimerasi (PCR, Polymerase Chain Reaction), che consente di amplificare anche
pochissime sequenze di DNA.
L'origine del mitocondrio: la teoria endosimbioticaCome si è visto precedentemente, il mitocondrio presenta alcune caratteristiche tipiche dei batteri: presenza dimolecole di cardiolipina ed assenza di colesterolo nella membrana interna, la presenza di un DNA circolare a doppiaelica e la presenza di ribosomi propri e di una doppia membrana. Come i batteri, i mitocondri non hanno istoni ed iloro ribosomi sono sensibili ad alcuni antibiotici (come il cloramfenicolo). In più i mitocondri sono organellisemiautonomi in quanto replicano, per scissione binaria, autonomamente rispetto alla cellula.Stante queste similitudini, la teoria endosimbiotica afferma che i mitocondri deriverebbero da ancestrali batteri,dotati di metabolismo ossidativo, che sarebbero stati inglobati dalle cellule eucariote con conseguente mutuobeneficio. Successivamente i batteri avrebbero trasferito gran parte del loro materiale genetico a quello cellulare,divenendo così, mitocondri.
Voci correlate• Alterazione omeostasi del calcio• Miopatia mitocondriale
Altri progetti
• Wikimedia Commons contiene file multimediali su Mitocondrio
Collegamenti esterni• (ES) Società Catalana di Neurologia: Il Mitocondrio [3]

Mitocondrio 70
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Note[1] http:/ / www. pnas. org/ content/ 101/ 20/ 7805. abstract[2] http:/ / www. jcb. org/ cgi/ pmidlookup?view=long& pmid=15631992[3] http:/ / www. scn. es/ cursos/ muscular/ genmito/ mitocondria. htm
Nucleo cellulareIl nucleo cellulare è un organulo presente nella quasi totalità delle cellule eucariote, con forma e sede molto variabilie un volume proporzionale a quello di una cellula.La posizione dipende dal contenuto e dalla funzione della cellula, ad esempio in cellule polarizzate con una zonaapicale deputata alla secrezione (cellule mucipare, cellule a secrezione apocrina), o all'assorbimento (enterociti),hanno il nucleo in posizione basale, cellule molto "piene" come gli adipociti univacuolari (grasso bianco) o i miocitidei muscoli scheletrici hanno il nucleo in posizione sublemmare (cioè addossato alla → membrana cellulare).Anche la forma del nucleo cambia notevolmente, generalmente seguendo la geometria della cellula, dunque cellulecilindriche avranno nuclei oblunghi, mentre cellule cubiche avranno nuclei sferici.

Nucleo cellulare 71
Struttura del nucleo
Nucleo di cellula eucariotica. In questa figura è visibile la doppiamembrana punteggiata di → ribosomidella membrana nucleare, il
DNA (complessato in cromatina) e il nucleolo. All'interno del nucleoè presente un liquido viscoso chiamato nucleoplasma, simile al →
citoplasma che si trova al suo esterno.
Sezione trasversa di un poro nucleare sulla superficie dellamembrana nucleare (1). (2) anello esterno del poro, (3) raggi, (4)
canestro nucleare, (5) fibrille.
Il nucleo è un organulo che si trova all'interno della cellula ed è sede di importanti reazioni. Il suo scopo è quello dicontenere gli acidi nucleici, provvedere alla duplicazione del DNA, alla trascrizione e alla maturazione dell'RNA. Ilnucleo è presente solo negli eucarioti ed è delimitato da una doppia membrana fosfolipoproteica in continuità con ilRER.Nel nucleo possono essere distinti:• una doppia membrana, che lo separa dal → citoplasma della cellula• un materiale filamentoso, la cromatina, costituita da proteine ed acidi nucleici• i nucleoli, immersi nella sostanza nucleare.
Involucro nucleareL'involucro nucleare è composto da due doppie membrane fosfolipoproteiche concentriche, ciascuna di spessore di 8nm circa, che delimitano il lume della cisterna perinucleare di 15-40 nm. Tale cisterna è in continuità con il RER. Lacisterna è interrotta a livello dei pori dove le due membrane si fondono.La membrana esterna e quella interna, sebbene non contravvengano al principio di membrana unitaria hannocomposizione differente sia in fosfolipidi che in proteine. La membrana interna è rivestita sul lato interno da una fittamaglia di proteine chiamata làmina nucleare, composta da quattro tipi di lamìna nucleare o fibrosa (A, B1, B2, C)che identifica il filamento intermedio specifico per il nucleoscheletro, il cui scopo è di fornire un sostegno per ilnucleo e un ancoraggio per la cromatina.La lamìna viene trasportata qui grazie alla sequenza di indirizzamento nucleare ed, all'inizio della → mitosi, vienescomposta ad opera dell'enzima protein chinasi Cdc2, come anche alla morte cellulare (apoptosi). La lamina nuclearesepara la cromatina (DNA non spiralizzato) dalla membrana nucleare interna, ed ha un spessore che varia dai 10 ai20 nm. La struttura a maglia, con cui è disposta, si interrompe in corrispondenza dei pori nucleari ed ha una formasimile in cellule dello stesso tessuto.La membrana esterna nucleare può invece presentare ribosomi (come facilmente immaginabile, a causa dellacontinuità con il reticolo rugoso).

Nucleo cellulare 72
Pori nucleariLa membrana nucleare non è continua, ma presenta dei fori, detti pori nucleari, il cui scopo è quello di permettere ilpassaggio delle molecole dal citosol al nucleoplasma.I pori nucleari sono composti da 8 proteine canale disposte ad ottametro e da centinaia di altre proteine che formanole diverse subunità, per un totale di 120 MDa di massa. Abbiamo le subunità ad anello, subunità a colonna, subunitàlaminare, subunità anulare, fibrille e canestro nucleare.Le molecole più piccole (fino a 5.000 Da) passano per diffusione, molecole più grandi (fino a 60.000 Da) prive disegnali di localizzazione nucleare (NLS, vedi sezione Trasporti nucleo-citoplasma) passano con velocitàinversamente proporzionale alla loro massa.Dalle osservazioni di microscopia elettronica si ritiene che il poro sia formato da due anelli: 1- anello citoplasmatico(a cui sono legati filamenti citoplasmatici), sulla membrana esterna; 2- anello nucleare sulla membrana nucleareinterna; i due ottameri sono collegati tra loro grazie a una struttura a raggiera, formata da proteine che delimitano ilcanale centrale che attraversa l'involucro. All'interno del canale sono state riscontrate altre proteine e trasportatoriresponsabili del movimento delle macromolecole attraverso la membrana nucleare.Le molecole più piccole non passano attraverso il canale centrale, ma attraverso canali più piccoli (9-10 nm) ricavatitra i "raggi". Mentre quelle più grandi necessitano di un segnale che permetta loro di allargare il canale.
CromatinaIl nucleo cellulare ha una funzione essenziale nella trasmissione dei caratteri ereditari (meiosi, → mitosi) e nelcontrollo del metabolismo cellulare. Il DNA che si trova nel nucleo non è sparso ma ben organizzato in unsuperavvolgimento dato dall'associazione del DNA stesso con 5 proteine istoniche: H2A; H2B; H3; H4; H1. Leprime quattro associate al DNA formano degli ottameri ricchi di DNA superavvolto detti nucleosomi. La proteinaistonica H1 ha il compito specifico di mantenere collegati tra loro i diversi istoni. L'intera struttura è detta cromatina.La cromatina, si suddivide eucromatina ed eterocromatina (a seconda che si colori o meno), a sua volta suddivisibilein eterocromatina costitutiva (centromero e telomero) e facoltativa, ovvero quelle regioni di DNA silenziato inragione della specificità cellulare dovuta al differenziamento, oppure ad una temporanea inattività di quei particolarigeni.
Nucleolo
Foto al microscopio elettronico di un nucleo cellulare;in evidenza il nucleolo, più scuro.
Si notano facilmente, nel nucleo → interfasico, corpi circolarifortemente basofili (solitamente più scuri del resto del nucleo) acausa dell'abbondanza di RNA, ma affini anche a molti colorantiacidi (al contrario del resto del nucleo) a causa della presenza diproteine basiche. È Feulgen negativo perché contiene poco DNA.La grandezza del nucleolo va da 1 a 3 μm.
Il numero di nucleoli osservabili in un nucleo è compreso tra uno esei. Tuttavia la presenza di più nucleoli rappresenta una situazionetransitoria, infatti il nucleo uscente dalla → mitosi (dove ilnucleolo era sparito) forma piccoli nucleoli provvisori, attorno agliorganizzatori nucleolari, che poi si fondono in un unico corpo.
Il nucleolo è la sede di produzione dei ribosomi, sia per quantoriguarda la produzione del rRNA (RNA ribosomiale) sia perl'assemblaggio delle proteine (basiche) presenti nelle subunità

Nucleo cellulare 73
ribosomiali. Il genoma umano contiene centinai di copie del gene per rRNA raggruppati in 5 coppie di loci sualtrettante coppie di cromosomi. Dunque, queste 10 porzioni di DNA vengono chiamate organizzatori nucleolari.Nel nucleolo si distinguono tre regioni (dal centro alla periferia):• Centro fibrillare: sede della maggior parte dell'organizzatore nucleolare• Componente fibrillare densa: dove risiede parte dell'organizzatore e i trascritti di rRNA• Componente granulare: sede della maturazione delle sunbunità ribosomiali (granuli da 15 nm)I nucleoli sono sovente circondati da cromatina addensata che prende il nome di cromatina associata al nucleolo ocromatina perinucleolare.
Le attività del nucleo
Trasporti nucleo-citoplasma. Il ciclo delle importine
Macromolecole, come l'RNA e le proteine vengono attivamente trasportate attraverso lamembrana nucleare
Abbiamo precedentemente accennato acome le piccole molecole passinospontaneamente attraverso il poronucleare, ma come fanno le molecolepiù grandi (sopra i 60 kDa)?È infatti noto che proteine e moltedelle strutture utilizzate nel nucleo nonvengono sintetizzate in loco mavengono create nel citosol e importateall'interno. Basti pensare alla sintesidei ribosomi, in cui le proteineribosomali create nel citosol vengonoportate all'interno del nucleo,complessate con rRNA e riesportatenuovamente. Come è possibile tuttoquesto se il poro è largo al massimo 9nm? Il trucco c'è ed è stato visto almicroscopio elettronico. Le molecole più grandi, sia per entrare che per uscire dal nucleo, hanno bisogno diparticolari recettori proteici, detti Recettori di Importazione Nucleare (o Importine), e Recettori di EsportazioneNucleare (o Esportine), che indicano al poro di allargarsi ulteriormente (fino a 26 nm) per permetterne il passaggio.Il meccanismo dipende inoltre dalla piccola GTPasi monomerica Ran. Come tutte le proteine G, Ran è attiva quandolegata a GTP, e inattiva quando legata a GDP. GAP (GTPase Activator Protein) è l'enzima che "spegne" Ran,attivandone l'attività GTPasica; la stimola cioè ad idrolizzare il GTP a GDP+Pi. GEF (Guanilic nucleotide ExchangeFactor), al contrario, stimola Ran a scambiare GDP con GTP (ATTENZIONE! GEF non è una chinasi, cioè nonfosforila GDP, ma lo fa rilasciare e scambiare con un GTP). Poiché Ran-GAP si trova soprattutto nel citosol, mentreRan-GEF si trova soprattutto nel nucleoplasma, si viene a creare un gradiente delle due forme conformazionali diRan (Ran-GTP e Ran-GDP) tra interno ed esterno del nucleo. Questo gradiente spinge il trasporto nella direzioneappropriata.
1) Le proteine citosoliche di nuova sintesi destinate al nucleo contengono una sequenza segnale (NLS, nuclearlocalisation signal), che indica come destinazione il nucleo (solitamente questa sequenza consiste in residui carichipositivamente di Arg, Lys, Pro);2) Un'importina (Recettore di Importazione Nucleare) lega la NLS di una proteina, formando un complesso diimportazione;

Nucleo cellulare 74
3) I recettori di importazione si attaccano alle ripetizioni FC (cioè ricche di amminoacidi Fenilalanina e Glicina)delle fibrille del poro nucleare;4) L'intero complesso, in un modo non del tutto chiaro, indica al poro di allargarsi e la struttura entra nel nucleo;5) All'interno del nucleo, una Ran-GTP si lega all'importina, provocando il rilascio del cargo nel nucleoplasma;6) Il gradiente di concentrazione di Ran-GTP/Ran-GDP che esiste tra l'interno e l'esterno del nucleo spinge ilcomplesso Importina/Ran-GTP a fuoriuscire nuovamente attraverso il poro nucleare;7) Nel citosol, Ran-GTP viene attaccata da due proteine: una Proteina che Lega Ran e una Ran-GAP (Proteina cheAttiva la GTPasi dei Ran). La Proteina che Lega Ran sposta Ran-GTP dall'Importina, che può così riprendere il suociclo, mentre Ran-GAP stimola l'attività GTPasica di Ran;8) Ran idrolizza quindi il suo GTP e rilascia il fosfato Pi, staccandosi infine dalla Proteina che Lega Ran.
Modificazione del nucleo durante il ciclo cellulare
Immagine di una cellula di polmone di anfibio urodelo coloratacon coloranti fluorescenti durante la metafase. Il fuso mitotico,visualizzato in verde, ha attaccati due set di cromosomi (in blu).
Tutti i cromosomi tranne uno sono già allineati lungo lacosiddetta piastra metafasica.
Durante la profase i filamenti di cromatina si ripiegano e sicompattano in lunghi cromosomi che continuano adimpacchettarsi diventando più corti e spessi (i cromatidifratelli si appaiano longitudinalmente formando cromosomidicromatidici dalla tipica forma a X). In seguito icromosomi si accostano alla membrana nucleare e la partecentrale di nucleoplasma rimane relativamente vuota.Scompare il nucleolo, in risposta alla cessazione dellasintesi di rRNA.
La fine della profase è segnata dalla prometafase, quandol'involucro nucleare si dissolve. Questo disassemblaggio èdovuto alla depolimerizzazione delle lamìne nucleari, aquella dei pori, e alla frammentazione della membranafofolipidica in vescicole.
• Le vescicole di membrana vengono riassorbite e fuse nelreticolo endoplasmatico circostante (tant'é che non sidistinguono più visivamente, se non con metodi
immunoistochimici) anch'esso in via di frammentazione;• I filamenti di lamìna nucleare vengono fosforilati dalla proteina chinasi CDK1 (Ciclin Dependent Kinasi), la
fosforilazione porta alla dissociazione dei filamenti in dimeri di lamina; le lamine A e C si dissociano dallamembrana e vengono liberate come dimeri nel citosol, mentre le lamine B restano associate alle vescicole;
• Anche varie proteine del poro vengono fosforilate inducendone il disassemblaggio in subunità.Il nucleo verrà ricostituito in telofase, quando la cromatina comincerà a despiralizzarsi e numerose vescicole direticolo endoplasmatico verranno a fondersi per ricostituire l'involucro nucleare; ricompariranno quindi i nucleoliattorno agli organizzatori nucleolari. Successivamente si riformeranno anche i pori.

Nucleo cellulare 75
Nuclei multipli, nuclei assenti
Cellule con più nucleiNormalmente le cellule eucariote sono mononucleate. Nei Ciliati sono presenti più nuclei ma uno solo (ilmicronucleo) garantisce l'ininterrotta continuità del genoma, mentre i macronuclei sono delle "copie di lavoro" il cuigenoma non si replica con accuratezza.I sincizi sono cellule polinucleate derivanti dalla fusione di cellule normali: un tipico esempio sono le fibre muscolarischeletriche degli animali. Altri sincizi che si possono citare nell'organismo umano sono: il sinciziotrofoblasto(necessario all'impianto della blastocisti nella decidua uterina), gli osteoclasti, le cellule giganti da corpo estraneo(non sono altro che numerosi macrofagi fusi, in grado di fagocitare corpi molto grandi estranei o di tessuti necrotici)I plasmodi sono cellule in cui le divisioni nucleari non sono state seguite dalla divisione cellulare. Nelle ifefilamentose dei Funghi in genere la separazione tra le cellule è assente o incompleta. Nell'uomo si hanno plasmodi inalcuni epatociti e in alcune cellule degli epiteli di transizione (vescica), nonché durante la maturazione deglispermatozoi.
Cellule senza nucleo
Gli eritrociti umani, come quelli degli altrimammiferi, sono sprovvisti di nucleo.
Questo rientra nel normale sviluppo dellacellula.
Vi sono cellule che non hanno nucleo, come nel caso dei globuli rossi deimammiferi che perdono il nucleo in seguito al loro differenziamento, infattiil loro unico scopo è quello di trasportare i gas coinvolti nella respirazione.Si discute, comunque, se sia giusto chiamare l'eritrocita cellula o piuttostoderivato cellulare.
I globuli rossi degli uccelli, degli anfibi, dei rettili e dei pesci sono inveceprovvisti del nucleo.Tra le altre cellule prive di nucleo si annoverano anche le piastrine e lesquame cornee della pelle.
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • Trascrizione

Nucleo cellulare 76
Vai al Progetto Bio • Discuti alla Doppia Elica
Reticolo endoplasmatico
Schema del nucleo cellulare e del reticolo endoplasmatico annesso.
Il reticolo endoplasmatico (RE) è uncomplesso organulo, con una strutturacellulare costituita da regionicitoplasmatiche delimitate damembrane che possono avere la formadi cisterne o tubuli. Lo spazio internoche si identifica tra le pieghe delreticolo è detto lume, e vede lapresenza di una serie di enzimi checatalizzano diverse reazioni chimiche.
Il termine reticolo endoplasmaticonasce dal fatto che i primi studiosi, tra imetodi di colorazione delle cellule perla loro osservazione al microscopioottico, usavano l'impregnazioneargentica, metodica secondo cui laprecipitazione dell'argento metteva inevidenza una trama per l'appunto reticolare sita in posizione perinucleare (endoplasmatica).Vi sono due tipologie di RE differenti per morfologia e funzione, ed il cui prevalere dell'uno sull'altro dipende dallatipologia cellulare di cui fa parte: il reticolo endoplasmatico rugoso (RER) e quello liscio (REL).
Reticolo endoplasmatico rugosoIl reticolo endoplasmatico rugoso (o ruvido, o granulare) è un organello della cellula eucariote sia vegetale cheanimale; è costituito da una serie di membrane piegate una sull'altra a formare cisterne, mentre il termine rugoso (oruvido) si riferisce al fatto che il versante citoplasmatico delle sue membrane è ricco di ribosomi. Compito delribosoma è quello di sintetizzare le proteine tramite il processo della "sintesi proteica". Una volta formata la proteina,questa viene impacchettata in una membrana (gemmazione della vescicola di transizione) che, trovatasi nelcitoplasma può fuoriuscire dalla cellula (esocitosi), o sostare nel citoplasma, o andare nell'apparato di Golgi doveverrà modificata. Tutti i movimenti delle vescicole possono essere compiuti tramite il coordinamento del →citoscheletro. Il RER è erroneamente denominato in italiano "rugoso". Il termine deriva infatti da una erratatraduzione del vocabolo inglese "rough". Infatti, se il reticolo endoplasmatico fosse realmente "rugoso",presenterebbe dei ripiegamenti su se stesso.
Reticolo endoplasmatico liscioIl REL è costituito da un sistema di sacche tubolari. È il maggior responsabile della sintesi dei lipidi, degli steroidi e del metabolismo del glicogeno. Ha come compito quello di detossificare sostanze altrimenti dannose per l'organismo, come ad esempio l'etanolo contenuto nelle bevande alcoliche. Per questo motivo ritroveremo una rigogliosa presenza di Rel in cellule epatiche. Si è osservato infatti che, somministrando sostanze tossiche all'organismo, l'estensione del Rel nelle cellule epatiche aumenta notevolmente. Il Rel inoltre è sede primaria del metabolismo di fosfolipidi, acidi grassi e steroidi, serve a sintetizzare i lipidi utili per costruire e riparare tutte le

Reticolo endoplasmatico 77
membrane della cellula.Il REL ha anche la funzione di immagazzinare ioni calcio. Nel tessuto muscolare, questi ioni sono necessari per lacontrazione; quando un impulso nervoso stimola una cellula muscolare, gli ioni calcio passano dal reticolo liscio nelfluido citoplasmatico, dove innescano la contrazione della cellula. Funzione altrettanto importante svolta dal Rel èquella del metabolismo del glicogeno. Gli enzimi necessari per la glicogenosintesi sono di tipo solubile e si trovanonello ialoplasma o, in alternativa, legati alle stesse particelle di glicogeno. La glicogenolisi invece è mediata daenzimi fosforilasici che inducono la liberazione di molecole di glucoso-1-fosfato, poi trasformato inglucoso-6-fosfato dall'enzima fosfoglucomutasi, e successivamente per lo più liberato (tramite il trasportatoreinsulino-indipendente GLUT2) nella circolazione sanguigna come glucoso, a seguito dell'azione dell'enzimaglucoso-6-fosfatasi (solo le cellule epatiche però hanno l'enzima glucoso-6-fosfatasi: anche il muscolo striatopossiede riserve di glicogeno, ma anziché liberarlo in circolo, lo indirizza alla glicolisi come glucoso-6-fosfato). Iprocessi di glicogenolisi e glicogenosintesi aumentano in risposta a particolari stimoli ormonali rilasciati dalpancreas (il glucagone attiva la glicogenolisi ed inibisce la glicogenosintesi, mentre l'insulina ha effetto opposto).
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica

Apparato del Golgi 78
Apparato del Golgi
Microfotografia al microscopio elettronico dell'apparato del Golgi
L'apparato del Golgi (spesso dettosemplicemente Golgi) è un organulo dinatura lipidica scoperto nel 1898 dal medicoe microscopista italiano Camillo Golgi, chelo identificò come una delicata strutturalocalizzata nella cellula in posizioneparanucleare. Golgi diede all'organulo ilnome di apparato reticolare interno.
La struttura si evidenzia trattando le cellulecon sali d'argento. Viene detta zona diGolgi la zona di → citoplasma nella qualerisiede l'apparato.
Struttura
L'Apparato del Golgi venne evidenziatoverso la fine dell'800, precisamente nel 1898, da Camillo Golgi, attraverso un'impregnazione cromoargenticaeffettuata su cellule nervose del gatto. Notò così che una zona del reticolo endoplasmatico interno presentava unamaggiore addensazione del metallo e la descrisse come apparato reticolare interno. Con il miglioramento delletecniche di osservazione venne poi osservato più dettagliatamente e chiamato Apparato del Golgi.Esso è formato da sacche membranose impilate le une sulle altre, che modificano proteine e lipidi, sintetizzanocarboidrati e "impacchettano" le molecole che devono essere trasportate all'esterno della cellula. Anche se puòvariare leggermente a seconda delle cellule studiate, in linea di massima la sua struttura è pressoché uniforme: èformato da dittiosomi, strutture formate a loro volta da sacculi appiattiti e da piccole formazioni cave, le vescicolegolgiane. I sacculi sono impilati strettamente gli uni agli altri e possono trovarsi singolarmente nel citoplasma oassociati nei cosiddetti corpi golgiani. I sacculi presenti in prossimità del nucleo sono detti inferiori o prossimali ecostituiscono la regione cis del dittiosoma. I sacculi che invece sono presenti in prossimità della superficie cellularesono detti superiori o distali e costituiscono la regione trans dello stesso dittiosoma.
FunzioniL'apparato del Golgi ha la funzione di rielaborare, selezionare ed esportare i prodotti cellulari. Questo organulo puòinteragire con altri (come il reticolo endoplasmatico rugoso) per indirizzare ed etichettare certe vescicole contenentiprodotti cellulari verso la loro destinazione, che può essere quello di confluire in altri organi o ingranare nellamembrana plasmatica e farne uscire il contenuto.Possiamo fare un esempio con una proteina che deve raggiungere un → lisosoma. Inizialmente questa proteina vienefornita di una specifica sequenza segnale che la indirizza nel reticolo endoplasmatico rugoso. Qui, le viene rimossa lasequenza segnale, sostituita con un oligosaccaride (cioè l'indirizzo in etichetta), e la proteina ora si chiamaglicoproteina. Gli enzimi del Golgi modificano l'oligosaccaride aggiungendogli un gruppo fosfato, processochiamato fosforilazione. La proteina fosforilata si lega ad un recettore specifico; dopo viene racchiusa all'interno diuna vescicola mediante l'estroflessione della membrana plasmatica; in questo modo la proteina resta divisa dal →citoplasma quindi può raggiungere il lisosoma.Meccanismi simili regolano ed indirizzano proteine diverse verso altri componenti cellulari. L'apparato del Golgi èresponsabile dell'esportazione di queste proteine, ed è anche coinvolto nell'immagazzinamento di altre, fino a che

Apparato del Golgi 79
queste non devono essere utilizzate o espulse dalla cellula.I prodotti di questo apparato vengono secreti come piccole vescicole che migrano verso la → membrana cellulare econ quest'ultima si fondono per rinnovarne i componenti.
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Lisosoma
Schema di una tipica cellula animale con tutti i suoi componenti subcellulari. (1)nucleolo, (2) nucleo, (3) → ribosoma, (4) vescicola, (5) reticolo endoplasmatico rugoso,(6) → apparato del Golgi, (7) → citoscheletro, (8) reticolo endoplasmatico liscio, (9) →
mitocondri, (10) vescicola, (11) → citoplasma, (12) lisosoma, (13) → centrioli.
Il lisosoma (dal greco lysis,dissoluzione, e soma, corpo) è unavescicola (organello) presente innumerose copie in cellule eucariotichee rappresenta il sistema digerente dellacellula in quanto è responsabile delladegradazione e della digestione(distruzione) di molecole estranee emacromolecole ingerite dalla cellulavia endocitosi così come dimacromolecole endogene. I lisosomi sioccupano del turnover degli altriorganelli della cellula stessa.Attraverso questo stesso processo iglobuli bianchi sono in grado di"disfarsi" di microrganismi patogeni ocellule morte precedentementefagocitate.
I lisosomi furono scoperti dal citologo belga Christian de Duve nel 1949.
MeccanismoLa degradazione avviene per mezzo di enzimi idrolitici contenuti nell'organello in grado di degradare proteine, lipidi e carboidrati nei loro costituenti elementari per poi, quando possibile, venire riutilizzati in altro modo o essere

Lisosoma 80
espulsi.Questi enzimi si attivano a pH bassi (4,8), e questo è importante poiché riduce il pericolo della distruzione dellacellula ospitante qualora vi sia la liberazione accidentale di tali enzimi nel citoplasma (che ha pH 7). Per ulterioreprotezione, la membrana del lisosoma contiene, oltre a proteine di trasporto per portare nel citosol i prodotti delladigestione, grandi quantità di glucidi legati a lipidi o a proteine della faccia non citosolica. Inoltre sembra che illisosoma sia protetto dall'azione enzimatica del suo contenuto grazie alla particolare struttura tridimensionale delleproteine della sua membrana interna che riescono a proteggere i siti vulnerabili agli attacchi enzimatici.Il basso pH viene creato e mantenuto grazie a pompe protoniche che pompano ioni H + dal citoplasma nonché da →canali ionici.Poiché gli enzimi contenuti nel lisosoma sono potenzialmente pericolosi, essi non possono essere rilasciati nelcitoplasma ma debbono sempre essere confinati all'interno di strutture membranose in grado di contenerli. Ilmeccanismo con cui tali enzimi entrano in contatto con le sostanze da degradare viene definito autofagìa ofagocitosi a seconda dell'origine di tali sostanze.• Per autofagia si intende la degradazione di componenti della cellula stessa, siano essi macromolecole o organelli.
In questo caso questi vengono circondati da vescicole derivanti dalla membrana del → reticolo endoplasmatico,portando alla formazione del cosiddetto autofagosoma. Successivamente questo si fonde col lisosoma che èquindi libero di riversarvi il proprio contenuto, formano autofagolisosoma.
• Nella fagocitosi, grosse particelle (come un batterio o un virus) vengono inglobate (fagocitate) dalla cellula.Anche in questo caso la vescicola formatasi, questa volta derivante dalla → membrana cellulare (fagosoma), sifonde col lisosoma formando un cosiddetto fagolisosoma dove il suo contenuto viene digerito.
FormazioneIl lisosoma si forma per gemmazione dall'→ apparato del Golgi che provvede anche al processamento degli enzimilitici prodotti dal reticolo endoplasmatico. Questi enzimi vengono diretti nei lisosomi tramite fosforilazione a livellodel versante cis del Golgi ad opera di una fosfotransferasi che forma un residuo di mannosio-6-fosfato. Gli enzimimarcati con questo motivo vengono diretti specificamente verso i pre-lisosomi (così definiti in quanto il pH non èsufficientemente acido) tramite vescicole endosomali dotate di pH più basso. Quindi, man mano che nuove vescicoleapportanti nuovi enzimi si fondono al pre-lisosoma, il suo pH si abbassa attivando infine gli enzimi litici etrasformandosi in vero e proprio lisosoma.I lisosomi osservati al microscopio elettronico si presentano sotto 3 aspetti strutturali, Lisosomi primari, secondari eterziari.- Lisosomi Primari: si presentano sotto forma di piccole vescicole sferiche che hanno al loro interno un altocontenuto di acido idrolitico. Gli enzimi lisosomali sono sintetizzati nei libosomi attaccati al reticoloendoplasmatico, si accumulano nel lume dello stesso (RE) da dove poi passano nel complesso di golgi da dove silibera sotto forma di piccole vescicole avvolte da Clatrina, dalla faccia trans.- Lisosomi Secondari (endolisosomi): si formano tramite la fusione dei lisosomi primari con endosomi, ovvero convacuoli che contengono materiale extracellulare penetrato nella cellula tramite endocitosi. Per questo codestilisosomi vengono chiamati endolisosomi. Gli endolisosomi possono funzionare con altri lisosomi, formando, unfagolisosoma. Gli organismi cellulari alterati vengono avvolti ed isolati con una membrana dopo di ciò la rispettivaforma si fonde con un lisosoma secondario ottenendo un autofagolisosoma ovvero una formazione nella quale siautolesiona il materiale intracellulare proprio della cellula.I prodotti ottenuti dalla digestione che ha luogo a livellodegli endosomi, raggiungono il citoplasma e sono riutilizzati dalla cellula. Vengono praticamente riciclati.- Lisosomi Terziari (corpi residui): i corpi residui che resistono al processo di digestione intracellulare sotto forma diresti non digeribili costituiscono i lisosomi terziari. Alcuni vengono eliminati dalla cellula mentre altri vengonodepositati all'interno della stessa.

Lisosoma 81
Rilevanza clinicaDiverse patologie, molto spesso ereditarie, quali la malattia di Tay-Sachs o il morbo di Pompe sono state associate amalfunzionamenti dei lisosomi, dei loro enzimi o dei processi portanti alla loro formazione. Queste malattie sonodovute alla mancanza di particolari proteine litiche, che porta all'accumulo dei loro substrati all'interno della cellula,con conseguenti problemi nel metabolismo cellulare.Ad oggi si conoscono più di 40 diverse malattie genetiche causate dalla deficienza di questi enzimi. Queste malattie,generalmente note col nome di Lysosomal Storage Diseases (letteralmente malattie di immagazzinamentolisosomale) si possono classificare in gruppi a seconda del tipo di enzima che viene a mancare (e quindi del tipo diprodotto che si accumula):• mucopolisaccaridosi (MPS) di tipo I-VII, provocate da difetti nella degradazione dei mucopolisaccaridi (o
glicosaminoglicani)• sfingolipidosi (o glicolipidosi), in cui è presente un difetto di degradazione delle sfingomieline, dei cerebrosidi e
dei gangliosidi, importanti componenti delle cellule nervose: tra esse si annota la gangliosidosi GM2 (malattia diTay-Sachs)
• oligosaccaridosi, in cui è presente un difetto nella degradazione degli oligosaccaridi e delle glicoproteine• malattie dovute al trasporto lisosomiale alterato, in cui alcune sostanze non vengono trasportate correttamente nei
lisosomi per essere degradate• malattie dovute al mancato trasporto degli enzimi lisosomiali, in cui alcuni enzimi non vengono trasportati
correttamente nei lisosomi e quindi non riescono ad assolvere la loro funzione• altri tipi di malattie lisosomiali, tra cui il morbo di Pompe.
Bibliografia• Neil Campbell and Jane Reece (2002). Biology 6th ed. Benjamin Cummings. San Francisco. ISBN 0-8053-6624-5• Lubert Stryer (1996). Biochimica, 4° ed Zanichelli. ISBN 88-08-09806-0
Voci correlate• Proteasoma• → Apparato del Golgi
Collegamenti esterni• (EN) filmato Flash sul lisosoma [1]
• (EN) Strutture in 3D delle proteine associate alla membrana lisosomale [2]
• (EN) Science Primer [3]
• malattie lisosomali-Telethon [4]
• mucopolisaccaridosi.it [5]

Lisosoma 82
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Note[1] http:/ / www. maxanim. com/ physiology/ Lysosome/ Lysosome. htm[2] http:/ / opm. phar. umich. edu/ localization. php?localization=Lysosome%20membrane[3] http:/ / www. ncbi. nlm. nih. gov/ About/ Primer[4] http:/ / www. telethon. it/ informagene/ dettaglio_malattia. asp?id=26[5] http:/ / www. mucopolisaccaridosi. it
PerossisomaIl perossisoma è un organello cellulare vescicolare di circa 0,5-1 μm di diametro, ubiquitario negli eucarioti,separato dal → citoplasma da una membrana che contiene almeno 50 enzimi ossidativi. In una cellula epatica vipossono essere fino a 600 perossisomi all'interno dei quali è a volte rintracciabile un nucleo denso che contiene varienzimi come l'urato ossidasi, la catalasi, il D-amminoacido ossidasi. I perossisomi furono identificati per la primavolta come organelli cellulari dal biochimico belga Christian de Duve nel 1967 dopo che erano stati descritti nel1954 dallo svedese Johannes Rhodin. I perossisomi esercitano molte azioni che vanno dall'ossidazione degli acidigrassi a lunga catena (detta beta-ossidazione), alla sintesi del colesterolo e degli acidi biliari nelle cellule epatiche,alla produzione di plasmalogeni. Intervengono altresì nel metabolismo degli amminoacidi e delle purine e prendonoparte al processo di smaltimento dei composti metabolici tossici.I perossisomi elaborano al loro interno il perossido di idrogeno (H2O2), (da cui presero il nome) a seguito deiprocessi di ossidazione, catalizzati da vari enzimi (urato ossidasi, glicolato ossidasi, amminoacido ossidasi) che persvolgersi necessitano di ossigeno molecolare (O2). Il perossido di idrogeno è altamente reattivo ed ha azioneossidante per cui viene subito eliminato dall'enzima catalasi (uno dei più rappresentati) che catalizza la seguentereazione:2 H2O2 → O2 + 2 H2ODal catabolismo degli acidi grassi a lunga catena si formano perossido di idrogeno e acetil coenzima A (acetil CoA).L'acetil CoA viene utilizzato dalla cellula per il proprio metabolismo. Il perossido di idrogeno ha potere lesivo neiconfronti di microrganismi ed interviene in alcuni processi di detossificazione.

Perossisoma 83
La formazione del perossisomaIl perossisoma contiene una membrana che separa il citoplasma cellulare dalla matrice, la parte internadell'organello. La membrana non ha solo funzione di barriera ma contiene molte proteine, così come la matrice,necessarie per il fuzionamento complessivo del perossisoma.L'assemblaggio del perossisoma sembra avvenire in tre fasi:• all'inizio viene formata la membrana (pare che vi siano coinvolte almeno tre proteine PEX3, PEX16, PEX19.),• successivamente vengono inserite le proteine transmembrana,• infine vengono inserite le proteine della matrice.Tutte le proteine del perossisoma vengono precedentemente sintetizzate nel citoplasma e successivamente vengonocondotte alla loro destinazione finale. Al momento si conoscono due sequenze segnale (PTS1 e PTS2 da peroxisomaltargeting signal) che vengono utilizzate per indirizzare le proteine al perossisoma. Tali sequenze sono riconosciuteda recettori specifici, PEX5 per PTS1 e PEX7 per PTS2, che trasportano la proteina interessata al perossisoma dovealtre proteine vengono utilizzate per effettuare il trasporto transmembrana fino alla matrice.
Collegamenti esternihttp:/ / www. peroxisome. org/
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica

84
GIUNZIONI INTERCELLULARI
Giunzione cellulareUna giunzione cellulare altro non è se non una specializzazione del lembo di membrana che rende possibile econtrolla i processi di adesione tra cellule. Tali processi sono anche resi possibili dalla struttura di rivestimentoesterno adesa al versante extracellulare del plasmalemma detta glicocalice. Nei vertebrati, a livello funzionale sidistinguono tre tipi di giunzioni cellulari:• Giunzioni occludenti (tight junctions o zonulae occludentes)• Giunzioni comunicanti (gap junctions)• Giunzioni aderenti o di ancoraggio (anchoring junctions o zonulae adherentes, nel caso particolare dei
desmosomi è maculae adherentes)
Giunzioni cellulari principali
(piccolo errore nell'immagine a proposito dei desmosomi. I prolungamenti sono filamenti intermedi e non di actina)Negli inverterbrati, esistono molti altri tipi di giunzioni cellulari.A seconda, invece, dell'estensione sulla membrana si distinguono tra:• A fascia o 'zonulae': una zonula è una giunzione perimetrale che coinvolge una banda che circonda la cellula e
consente l'adesione completa di tutta la superficie in cui è presente• Circoscritte o 'maculae': le maculae sono dei dispositivi funzionali di forma rotonda o ovale che occupano una
porzione circoscritta della superficie del plasmalemma.
Giunzioni occludentiLe giunzioni occludenti (giunzioni strette o tight; o Zonulae occludentes) impediscono il passaggio dei fluidi tra le cellule. Si tratta di zonulae e sono particolarmente presenti nella pelle e negli epiteli intestinali. Nelle giunzioni occludenti gli spazi interstiziali sono annullati in corrispondenza dei punti nodali: punti in cui i lembi di membrana che si affrontano sono saldamente coesi. La totalità delle membrane adiacenti è percorsa da ripetute serie di tali punti, sicché i lembi di membrana appaiono anastomizzati tra loro. Due sono le principali proteine integrali di membrana coinvolte: Claudina e Occludina, che sporgono sulla faccia esterna delle membrane e sono tra loro unite da legami non covalenti. Queste due proteine formano una cintura intorno alla cellula che nemmeno le proteine di membrana possono attraversare, dividendola quindi in due o più domini. Sono formate da linee di fusione anastomizzate tra di loro ed estese a tutto il perimetro delle cellule epiteliali adiacenti. Al microscopio elettronico quindi la zonula occludens appare come una struttura a tre binari elettrondensi: i due più esterni sono rappresentati dagli strati fosfolipidici più interni delle due cellule coinvolte nella giunzione, quello più interno è dato dalla fusione dei due strati fosfolipidici esterni delle due cellule. Di conseguenza la membrana cellulare nel suo insieme, a livello della giunzione occludente, assume un aspetto pentalaminare in quanto le tre bande elettrondense sono intercalate a

Giunzione cellulare 85
bande elettrontrasparenti.Le Giunzioni occludenti svolgono una funzione sigillante, uniscono le due cellule adiacenti senza lasciare interstizi,in modo che le molecole idrosolubili non filtrino facilmente tra una cellula e l'altra. Sono localizzate generalmenteall’apice di cellule polarizzate come quelle dell’epitelio intestinale e impediscono alle molecole presenti, ad esempio,nel lume dell’intestino di valicare la lamina cellulare; se una molecola deve passare dal lume intestinale all’internodell’organismo o passare da cellula a cellula deve sottostare necessariamente all’azione di vaglio dei dispositivi dellacellula.
Giunzioni comunicantiLe giunzioni comunicanti (o serrate o nexus o gap) consentono il passaggio di determinate sostanze (ioni o molecoledi basso peso molecolare) tra le cellule, avendo dei canali, i connessori, che si aprono in risposta a determinatisegnali chimici (modificazioni piaccametriche o della concentrazione di ioni calcio) che hanno il ruolo diinterfacciare le cellule. Questi canali istituiscono dei ponti citoplasmatici (pori acquosi) tra cellule adiacenti con unlume di circa 2nm. Le giunzioni comunicanti sono formate da complessi proteici detti Connessoni, composti da seimonomeri di proteine integrali transmembranali(le connessine), di lunghezza circa 7-7,5nm. Tali istoni sporgono dallato non citosolico per 1,5nm, e sono contigui con quelli della membrana vicina, che pertanto deve avvicinarsi finoad una distanza di 3 nm. Questo crea una zona in cui le membrane si avvicinano, che è visibile al microscopioelettronico.
Giunzioni aderentiLe giunzioni aderenti (ancoranti, di ancoraggio, o zonulae adherentes) forniscono un supporto strutturale ai tessuti,come ad esempio i muscoli e le cellule dell'epidermide, andando a costituire nel tessuto un dispositivo tramite cui leforze applicate si scompongono secondo tante direttrici. Inoltre i microfilamenti che si legano alla placca di adesionetrovano proprio nella zonula adhaerens un punto di forza per poter esercitare un movimento all’interno della cellula.Questo tipo di giunzione è reso possibile grazie a proteine di adesione, le caderine E: proteine integrali chepresentano un dominio all'esterno della cellula che, tramite ioni calcio, aderisce al dominio omologo di un'altracaderina nella cellula adiacente; mentre con la loro porzione citoplasmatica si legano indirettamente aimicrofilamenti actinici (che decorrono parallelamente e al di sotto della membrana plasmatica) tramite proteineponte come la vincolina, la tolina o l'α-actinina formando la Placca di adesione. Nelle giunzioni aderenti i due lembidi membrana che si affrontano corrono parallelamente tra loro e lo spazio interstiziale ha uno spessore di 15-25 nm.
DesmosomiI desmosomi, o maculae adhaerentes, sono le giunzioni cellulari più conosciute perché al microscopio elettronicohanno una configurazione caratteristica. Immediatamente sotto la membrana plasmatica appare una zonamarcatamente elettrondensa: essa è costituita da un addensamento di materiale proteico citoplasmatico che vienedefinito placca di adesione (formata dalle desmoplachine) cui convergono i filamenti intermedi del citoscheletro(principalmente filamenti di vimentina o cheratina negli epiteli, questi ultimi detti anche tonofilamenti), che si leganolateralmente alla placca di adesione per poi ricurvare con un andamento che può essere paragonato a quello di unarco a tutto sesto. Nello spazio interstiziale, dello spessore di 20 nm, compare una linea mediana elettrondensadeterminata da proteine calcio-dipendenti (Caderine) quali desmocollina e desmogleina che si legano alla placca diadesione e alle loro omologhe in modo analogo rispetto a quanto descritto sopra per le giunzioni aderenti. Come legiunzioni aderenti, i desmosomi assolvono prevalentmente a funzioni meccaniche: grazie al decorso dei filamentiintermedi, le forze conseguenti a insulti meccanici vengono ben scaricate nel tessuto.

Giunzione cellulare 86
EmidesmosomiGli emidesmosomi, che visti al microscopio elettronico appaiono morfologicamente simili a mezzo desmosoma,sono in realtà molecolarmente, e funzionalmente, alquanto diversi da essi. Negli emidesmosomi, come neidesmosomi, le desmoplachine si legano principalmente ai filamenti intermedi, ma le proteine di membrana coinvoltenon sono caderine, bensì integrine che, mediante altre molecole-adattatore, si legano con le fibre della lamina basaleancorando e incollando il tessuto epiteliale alla lamina basale.
Bibliografia• Bruce Alberts, Dennis Bray, Karen Hopkin, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter
Walter: "Biologia Molecolare della Cellula" (ed. Zanichelli)• Don W. Fawcett: "Trattato di Istologia" (ed. McGraw-Hill)
Collegamenti esterni• NIH [1]
Note[1] http:/ / www. ncbi. nlm. nih. gov/ books/ bv. fcgi?rid=mboc4. section. 3469
Desmosoma
Diagramma di un desmosoma
Un desmosoma è una giunzione di naturaproteica tra cellule epiteliali adiacenti chesalda i rispettivi citoscheletri (in particolare ifilamenti intermedi) donando al tessuto dicui le cellule fanno parte resistenza allatrazione ed altri traumi fisici. Il desmosomasi lega ai filamenti intermedi, fatti dicheratina, tramite una placca citoplasmaticacomposta da due proteine chiamatedesmoplachina e placoglobina, che leganoanche le proteine integrali di membranadesmocollina e desmogleina, alle qualispetta il compito di legarsi a proteineanaloghe su di un desmosoma della cellulaadiacente.
Voci correlate
• E caderine

87
CICLO CELLULARE
Ciclo cellulare
Schema del ciclo cellulare. I = → Interfase, M=→Mitosi. La durata delle varie fasi non è in
proporzione
Il ciclo cellulare, o ciclo di divisione cellulare (CDC), è la serie dieventi che avvengono in una cellula eucariote tra una divisionecellulare e quella successiva. La durata del ciclo cellulare varia colvariare della specie, del tipo di cellula e delle condizioni di crescita.
Cenni generali
Il ciclo cellulare è un processo geneticamente controllato, costituito dauna serie di eventi coordinati e dipendenti tra loro, dai quali dipende lacorretta proliferazione delle cellule eucariotiche. Gli eventi molecolariche controllano il ciclo cellulare sono ordinati e direzionali: ogniprocesso è la diretta conseguenza dell'evento precedente ed è la causadi quello successivo.Molti geni coinvolti nella progressione del ciclo cellulare sono statiindividuati agli inizi degli anni settanta grazie ad uno studio condottoda Lee Hartwell e collaboratori sul lievito Saccharomyces cerevisiae, un microrganismo eucariotico unicellulare chesi presta molto bene alle analisi genetiche; grazie a questo lavoro furono isolati e caratterizzati mutanti chepresentavano alterazioni nelle diverse fasi del ciclo cellulare (Hartwell, 1974).
Nelle cellule eucariotiche la progressione attraverso le varie fasi del ciclo cellulare risulta essere finemente regolatadalle chinasi ciclina-dipendenti o CDK (Cyclin-dependent Kinases) una famiglia di protein chinasi la cui attivitàdipende dalla loro associazione con delle subunità proteiche regolative dette cicline; queste ultime sono proteineinstabili, sintetizzate e degradate periodicamente, che si accumulano in fasi del ciclo specifiche e che non soloattivano le CDK, ma ne determinano anche la specificità di substrato.Leland H. Hartwell, R. Timothy Hunt e Paul M. Nurse hanno vinto il Premio Nobel per la Fisiologia e la Medicinanel 2001 per la loro scoperta del ruolo centrale di queste molecole nel ciclo cellulare. Le scoperte sono state ottenutestudiando il ciclo cellulare rispettivamente nel lievito gemmante Saccharomyces cerevisiae, nelle uova del riccio dimare Sphaerechinus granularis ed nel lievito a fissione Schizosaccharomyces pombe
Negli eucarioti multicellulari la necessità di rispondere a una maggiore quantità di stimoli esterni ed interni hapermesso l’evoluzione di molteplici e diverse CDK: i vari complessi CDK - ciclina che si formano durante il ciclocellulare di tali organismi cambiano sia per quanto riguarda la subunità regolatoria (ciclina) sia per quanto riguardala subunità catalitica (CDK). In ogni periodo del ciclo cellulare è presente quindi un solo tipo di complesso CDK -ciclina cataliticamente attivo e, a seconda del complesso formatosi, vengono fosforilate molecole bersaglio differenti.Oltre all’azione regolatoria della ciclina, il complesso CDK - ciclina è anche soggetto all’azione di inibitori in gradodi legarsi a tale complesso e di renderne inattiva la subunità catalitica: questa classe di proteine prende il nome diCKI (CDK Inhibitors). Inoltre, determinati siti della subunità catalitica delle CDK risultano essere bersaglio di moltechinasi e fosfatasi che, determinando lo stato di fosforilazione del complesso, ne modulano più finemente la suaattività.

Ciclo cellulare 88
Fasi del ciclo cellulareIl ciclo cellulare è un evento molto importante, per questo motivo è regolato in tutte le sue dimensioni. Affinchél’informazione genetica venga correttamente trasmessa dalla cellula madre alle cellule figlie, il genoma deve essereprima duplicato durante il periodo di tempo denominato fase S e in seguito i cromosomi devono venire segregatinelle due cellule figlie durante la fase M. La fase M è a sua volta composta da due processi, strettamente collegati: la→ mitosi, durante la quale i cromosomi della cellula sono divisi tra le due cellule figlie e la citodieresi, che comportala divisione fisica del → citoplasma della cellula. Esiste una fase chiamata G0 (g zero) in cui la cellula ferma il suociclo cellulare. Le cellule nervose e quelle muscolari (striate scheletriche) rimangono in questo stadio per tutta la vitadell'organismo.
I punti di controlloIl ciclo cellulare è un processo estremamente importante; errori in questo processo potrebbero compromettere lavitalità cellulare. Per tale motivo, nel ciclo cellulare, sono presenti dei punti di controllo o checkpoints, localizzati alivello delle transizioni G1/S e G2/M. Infatti, tra le fasi S ed M ci sono normalmente due periodi di tempo detti"gap": G1 fra la fine della mitosi e l’inizio della fase S e G2 fra il termine della fase S e l’inizio della fase M. Inquesti periodi di tempo si ha la maggior parte della sintesi proteica con conseguente aumento della massa cellulare ela realizzazione dei controlli che impediscono l’inizio della fase successiva se non è stata completata quellaprecedente. Le fasi G1 e G2 sono quelle che possono subire la maggior variabilità di durata e in alcuni casiparticolari possono anche essere eliminate, contrariamente alle fasi S e M che sono essenziali e che rappresentanodue eventi chiave del ciclo cellulare. L'insieme delle fasi G1, S e G2 è collettivamente identificato come → interfase.Si dice che le cellule che hanno smesso di dividersi, in modo temporaneo o irreversibile, sono in uno stato diquiescenza (fase G0); le cellule che non vanno più incontro a divisione in modo permanente, in seguito adinvecchiamento o a danni al DNA sono chiamate senescenti. È da osservare che la mitosi produce sempre due cellulegeneticamente identiche alle cellula madre e che la maggior parte degli organuli citoplasmatici si distribuisce a casonelle cellule figlie.
Meccanismi molecolari comuniUno fra i cicli cellulari più semplice è quello del lievito Saccharomyces cerevisiae, nel quale è presente una sola chinasi ciclina dipendente (CdK) chiamata Cdc28 e due sole classi di cicline: G1 (Cln) e B (Clb). Nella fase G1 del ciclo cellulare è attiva la trascrizione del gene che codifica per una particolare ciclina di fase G1 della Cln3, che sembra agire da sensore della massa cellulare. Infatti quando la cellula raggiunge la sua massa critica, la concentrazione di questa ciclina aumenta, ed associandosi con Cdc28 attiva un complesso programma trascrizionale che comprende fra gli altri i geni codificanti per le cicline Cln1, Cln2, Clb5 e Clb6. Ciò porta alla formazione dei complessi Cln1/2-Cdc28 responsabili della formazione della gemma (la cellula figlia) e della duplicazione del corpo polare del fuso. Anche le cicline Clb5/6 si associano alla CdK formando il complesso Clb5/6-Cdc28 la cui attività chinasica è però bloccata attraversi il legame dell'inibitore Sic1. Quando la concentrazione del complesso Cln1/2-Cdc28 ha raggiunto una soglia critica, questo è in grado di fosforilare Sic1, indirizzandolo verso la degradazione e permettendo l'attivazione dei complessi Clb5/6-Cdc28 sino a quel momento accumulati che a loro volta fosforilano e degradano Sic1, mantenendone bassi i livelli. Questa attivazione è direttamente responsabile dell'inizio della replicazione del DNA a livello delle origini di replicazione, sulle quali è assemblato il complesso pre-replicativo (pre-RC). In seguito all'utilizzo dell'origine di replicazione, il complesso Clb5/6-Cdc28 converte il pre-RC nel post-RC, impedendo che quella stessa origine sia riutilizzata prima della successiva fase S. In tarda fase S si ha la trascrizione dei geni codificanti per le cicline Clb3 e Clb4 ed alla loro associazione con Cdc28, necessaria per l'entrata in → mitosi e l'allungamento del fuso mitotico, che in Saccharomyces cerevisiae avviene immediatamente al termine della fase S. In altri organismi, invece, a questo punto si ha la fosforilazione della CdK da parte della chinasi Wee1 (presente anche in lievito), la quale inattiva i complessi Clb-Cdc28 che si vanno via via

Ciclo cellulare 89
accumulando. Quando giunge il segnale di "via libera" la fosfatasi Cdc25 interviene eliminando il gruppo fosfato sulcomplesso Clb-Cdc28, il quale attivandosi porta alla fosforilazione ed inattivazione di Swe1, in un feedback positivoche produce un rapido aumento della forma attiva di Clb-Cdc28, portando all'entrata in → mitosi. Il complessoClb-Cdc28 quindi attiva il complesso promuovente l'anafase (APC) il quale, grazie all'associazione con Cdc20, va adindurre la degradazione di una serie di proteine fra cui la securina (Pds1). La degradazione di quest'ultima porta allaliberazione della separasi (Esp1) che permette il taglio delle coesine che mantengono legati i cromatidi fratelli,permettendone la migrazione ai poli opposti della cellula. L'associazione dell'APC con la proteina Cdh1 induceinoltre la degradazione di tutte le cicline di tipo B, provocando il crollo dell'attività di Cdc28, con la conseguenteuscita dalla mitosi. La perdita di attività di Cdc28, privo di cicline, porta anche al riassemblamento dei complessipre-RC sulle origini di replicazione, alla possibilità di accumulare nuovamente l'inibitore Sic1, nonché allatrascrizione delle cicline di fase G1 (Cln)... ed un altro ciclo può ricominciare
Il ciclo cellulare negli eucarioti superiori
Gateway G1/SIn questo punto, interviene il complesso cicline-CDK, il cui compito è quello di determinare la iperfosforilazione edattivazione della proteina p105RB codificata dal gene RB1 (la cui mutazione può causare un tumore dell'etàpediatrica, il retinoblastoma (RB)). Le cicline implicate in questo evento sono soprattutto le classi D1, D2, D3, dellaciclina-D, la quale viene prodotta durante la fase G1, ma nella fase S non è più possibile ritrovarla. La ciclina-D, silega alla CDK4, il complesso risultante, determina la iperfosforilazione del RB ed il rilascio del fattore ditrascrizione E2F. Successivamente alla sua attivazione, il fattore di trascrizione E2F viene rilasciato e favoriscel'entrata della cellula nel ciclo cellulare. Inoltre, alcuni fattori di crescita come il TGF-β e la p53, favorisconol'aumento delle concentrazioni di p16, la quale blocca le CDK ed il ciclo cellulare. Altri fattori di crescita come ilPDGF e l'FGF, favoriscono l'attivazione delle CDK.
Meccanismo d'azione del retinoblastoma
Il gene RB1 è un oncosoppressore localizzato sul cromosoma 13. La proteina del retinoblastoma p105RB da essocodificata, può essere o nella forma ipofosforilata (inattiva) o iperfosforilata (attiva). La forma inattiva ècaratterizzata dal fatto che p105RB mantiene complessato nella sua struttura il fattore di trascrizione E2F, pertanto, ilciclo cellulare è inibito. Mentre, la forma attiva è caratterizzata dal fatto che non mantiene complessato nella suastruttura il fattore di trascrizione E2F, pertanto, il ciclo cellulare è favorito. Nelle forme mutate del RB, il fattore ditrascrizione E2F è sempre libero, pertanto il ciclo cellulare non è controllato.
Gateway G2/MIl fattore di trascrizione E2F, precedentemente rilasciato dal RB, favorisce la formazione del complessociclina-A-CDK2 che agisce sia a livello della mitosi che della profase, nella quale il complesso ciclina-B-CDK1favorisce la degradazione dell'involucro nucleare e consente l'avvio della mitosi. Inoltre questi ultimi due complessi,comportano la separazione dei centromeri e l'addossamento dei cromosomi. Successivamente, la cellula va incontroa divisione.

Ciclo cellulare 90
Controllo della proliferazione cellulareNegli organismi pluricellulari le cellule, normalmente in uno stato quiescente, decidono di entrare in un nuovo ciclocellulare in risposta ad eventi biochimici fra i quali ci sono ad esempio, la ricezione attraverso il meccanismo ditrasduzione del segnale di fattori di crescita sintetizzati da altre cellule.
Bibliografia• Hartwell LH, Culotti J, Pringle JR, Reid BJ Genetic control of the cell division cycle in yeast. SCIENCE. 1974
JAN 11;183(120):46-51.
Voci correlate• → Fase G1• → Fase S• → Fase G2• → Mitosi
Collegamenti esterni• Pagina dell'Università di Tuscia dedicata al ciclo cellulare [1]
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Note[1] http:/ / www. unitus. it/ Scienze/ giovani/ Contadini/ Pagina%20vuota%205. htm

Interfase 91
InterfaseL'interfase è il periodo di tempo del → ciclo cellulare che intercorre tra una → mitosi e la successiva nelle celluleeucariotiche. In tale periodo avviene il processo di duplicazione del materiale genetico (DNA), degli organellicellulari, quali i centrioli ed i mitocondri ed in generale l'aumento di massa e di dimensioni della cellula, in modotale da permettere la formazione di due cellule a partire dalla prima..L'interfase si suddivide in tre fasi che, a seconda dell'organismo e del tipo di cellula possono essere più o menofacilmente distinte. Queste fasi sono:• → fase G1: nella quale la cellula produce le proteine necessarie per l'accrescimento della massa cellulare, svolge
il compito tipico del suo tipo di cellula (come la produzione di ormoni od altro)e prepara i complessi enzimaticiper la successiva fase.
• → fase S: in questa fase avviene la duplicazione del materiale genetico. Il DNA, a livello delle origini direplicazione, si despiralizza, permettendo ai due filamento nucleotidici di separarsi. In tali punti viene assemblatoil complesso di replicazione, costituito da diverse proteine fra cui la più importante è la DNA polimerasi. Questaproteina è la principale responsabile della sintesi dei due nuovi filamenti, utilizzando come stampo (detto anchetemplato) i filamenti della cellula madre in un processo detto replicazione semiconservativa.
• → fase G2: nella quale la cellula continua l'accrescimento della massa ed inizia a prepararsi alla successiva →mitosi spesso sintetizzando altre sostanze indispensabili per la divisione quali i centrioli.
Durante l'interfase, all'interno del nucleo, è impossibile osservare i cromosomi perché esso si trova sottoforma dicromatina ancora non condensata; possono essere però distinti uno o più nucleoli, le regioni dove si trovano i genicodificanti per l'RNA ribosomale, che durante le fasi G1 e G2 sono altamente trascritti per permettere la produzionedi ribosomi.Di norma nei mammiferi la → fase G1 dura circa 5 ore, la → fase S 7 ore e la → fase G2 3 ore; invece la divisionecellulare dura solamente 1 ora.
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica

Fase G1 92
Fase G1La fase G1 (G come gap, in inglese "intervallo") è in citologia la prima fase del → ciclo cellulare, che dà inizioall'→ interfase.Essa è un periodo di intensa attività biochimica che ha inizio immediatamente dopo la nascita della cellula ed èseguita dalla → fase S. Nella fase G1 la cellula, appena uscita dal processo di → mitosi e quindi avente dimensioniridotte, accresce il suo volume e costruisce le strutture necessarie per sostenerlo: vengono perciò sintetizzatenumerosi organuli ed in particolare si ha una elevata attività di sintesi di proteine e di RNA. Inoltre nelle celluleanimali i due centrioli, a differenza delle cellule vegetali, iniziano a separarsi ed a duplicarsi. Questa fase ha unadurata temporale che può oscillare ampiamente a seconda del genere di organismo di cui fa parte e del tipo di cellula,tuttavia è in genere breve rispetto alle altre fasi e talvolta può essere anche nulla.
Fonti• Pagina web dell'Universita di Tuscia dedicata al ciclo cellulare [1]
Voci correlate• → Ciclo cellulare
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica

Fase S 93
Fase SLa fase S (S come sintesi) è in citologia una fase del → ciclo cellulare, durante la quale il processo principale è lasintesi e duplicazione del codice genetico contenuto nel DNA.In questa fase, che ha inizio dopo la → fase G1 e che è seguita dalla → fase G2, i 2 filamenti appaiati checompongono la molecola di DNA progressivamente si separano facendo da stampo ognuno per un nuovo filamentocomplementare. La fase S in genere dura meno della → fase G1 che la precede, ma comunque la sua durata oscillamolto a seconda dell'organismo di cui fa parte la cellula e del tipo di cellula.
Voci correlate• → Ciclo cellulare
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica

Fase G2 94
Fase G2La fase G2 (G come gap, in inglese: intervallo) in citologia è una fase del → ciclo cellulare, l'ultima dell'→interfase.In questa parte del ciclo, che segue la → fase S nella quale viene duplicato il DNA, avvengono i preparativi finali perla → mitosi: la cellula inizia ad assemblare le strutture necessarie non solo per distribuire il corredo cromosomico aciascun → nucleo figlio, ma anche per dividere il citoplasma e separare i nuclei figli. Anche questa fase ha unadurata che è determinata dal tipo di organismo e di cellula.
Voci correlate• → Ciclo cellulare
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica

Replicazione del DNA 95
Replicazione del DNA
Nel corso della replicazione del DNA, la doppiaelica si divide in due; le basi azotate di ciascunametà consentono l'accoppiamento con la base
corrispettiva, formando così il filamento mancante
La replicazione (o duplicazione) è il meccanismo molecolareattraverso cui viene prodotta una copia del DNA cellulare. Ogni voltache una cellula si divide, infatti, l'intero genoma deve essere duplicatoper poter essere trasmesso alla progenie (tramite → mitosi o meiosi). Ilmeccanismo della replicazione è complesso e richiede l'intervento dinumerosi enzimi e di proteine iniziatrici. Il processo di replicazionedel DNA si definisce semiconservativo: il doppio filamento di DNAparentale funge da stampo per la sintesi di due filamenti figlicomplementari.
DNA polimerasi
L'enzima basilare della replicazione è la DNA polimerasi, checatalizza il legame di deossiribonucleotidi trifosfato (dNTP)
Polimerasi nei procarioti
I procarioti possiedono cinque tipi di DNA polimerasi:• DNA polimerasi I: implicata nella riparazione del DNA e nella
rimozione degli inneschi dei frammenti di Okazaki. Possiedeattività esonucleasica sia in direzione 5'->3', sia in direzione 3'->5',quest'ultima attività permette la lettura delle basi precedentementeunite (proofreading o "lettura delle bozze") e l'eventuale correzionein caso di errore. Velocità di polimerizzazione circa 14-20nucleotidi/secondo
• DNA polimerasi II: indotta da danni al DNA per riparazioneincline all'errore (error-prone). Ha attività polimerasica 5'->3' edesonucleasica 3'->5'. Velocità di polimerizzazione circa 40 nucleotidi/secondo
• DNA polimerasi III: l'enzima principale per la replicazione, con attività polimerasica 5'->3' ed esonucleasica3'->5' (proofreading). Attiva sia nella sintesi del filamento leading, sia in quella dei frammenti di Okazaki. Ha unastruttura particolarmente più complessa delle due precedenti, risulta costituito da due nuclei, a loro volta formatida subunità α ε θ (subunità alpha, epsilon e theta), i due nuclei sono uniti da una subunità τ (tao); sono inoltrepresenti strutture addizionali dette subunità χ e ψ (chi e psi), che vanno a costituire i complessi γ o di pinza, chepermettono un incremento esponenziale del processo duplicativo. Velocità di polimerizzazione circa 250-1000nucleotidi/secondo
• DNA polimerasi IV e DNA polimerasi V: anch'esse coinvolte nella riparazione incline all'errore

Replicazione del DNA 96
Polimerasi negli eucariotiLe Polimerasi degli eucarioti sono costituite invece da:• DNA polimerasi α: è associata a una primasi (enzima che sintetizza i primer di RNA) e procede all'allungamento
degli RNA-primer con alcune decine di deossiribonucleotidi (circa 20).• DNA polimerasi β: coinvolta nella riparazione del DNA• DNA polimerasi γ: replica il DNA mitocondriale• DNA polimerasi δ: l'enzima principale della replicazione eucariotica. Sintetizza sia il filamento leading, sia il
filamento lagging. Quando la polimerasi raggiunge il frammento di Okazaki precedentemente sintetizzato,continua a muoversi lungo il filamento stampo lagging, spostando il primer a RNA che verrà poi rimosso da unaendonucleasi (FEN-1). L'interruzione tra i desossiribonucleotidi è poi saldata da una ligasi.
• DNA polimerasi ε: stessa funzione della Polimerasi δ.
Il meccanismo della replicazioneVi è un singolo sito cromosomico, definito origine di replicazione da cui prende via il processo. A livellodell'origine di replicazione, la doppia elica si apre e la replicazione inizia su entrambi i filamenti. Man mano che lareplicazione procede,la forca replicativa (il sito in corrispondenza del quale avviene la replicazione) si muove lungoil DNA.
Enzimi coinvolti nella replicazione del DNA
Schema della forca replicativa del DNA
Un filamento di DNA, detto a replicazioneprogressiva (in inglese filamento leading,filamento guida), viene sintetizzato in modocontinuo; l'altro, detto a replicazioneregressiva (in inglese filamento lagging,filamento lento), è dapprima formato dacorti frammenti di DNA (i frammenti diOkazaki) di 1-3 kilobasi. In seguito iframmenti sono uniti dall'enzima DNAligasi.La sintesi di DNA non può iniziare ex novo,quindi l'enzima primasi sintetizza cortiinneschi di RNA complementari al DNAstampo. Nei procarioti gli inneschi deiframmenti di Okazaki sono rimossidall'enzima RNasi H e dalla DNApolimerasi I. Negli eucarioti altri enzimirimuovono i primer e la Polimerasi δriempie le interruzioni tra i frammenti.
Le DNA polimerasi, affinché il processo direplicazione sia efficace, necessitano diproteine che aumentino la loro attività e lestabilizzino sul filamento. Le clamp-loadinglegano il DNA alla giunzione tra l'innesco elo stampo, le sliding-clamp si congiungonoa queste ultime, caricano la Polimerasi sulDNA e garantiscono la sua stabilità.

Replicazione del DNA 97
Lo svolgimento del DNA parentale è catalizzato dall'enzima elicasi, che denatura il filamento sfruttando l'idrolisidell'ATP. Proteine che si legano al DNA a singolo filamento stabilizzano il DNA denaturato in modo che laPolimerasi possa scorrervi.Per evitare che i filamenti si attorciglino le topoisomerasi introducono tagli singoli (nel caso delle Topoisomerasi I) odoppi (nel caso delle Topoisomerasi II). Queste rotture reversibili fungono da perni, che consentono al DNA diruotare liberamente.La replicazione inizia in corrispondenza di una specifica sequenza chiamata origine di replicazione, che costituisceun sito di legame per proteine iniziatrici. Una proteina si lega all'origine e inizia a svolgere il DNA; recluta in seguitoaltre proteine e, insieme a esse e all'elicasi, continua la denaturazione. Le primasi inizia la sintesi dei primer. Laregione in cui i filamenti parentali si separano e i due nuovi filamenti si allungano è denominata forca replicativa.Nei procarioti, il cui DNA è generalmente circolare, sono presenti due forche replicative che dipartono dallamedesima origine. Quando le due forche si incontrano la replicazione è terminata.I genomi eucariotici sono spesso assai più grandi di quelli procariotici e necessitano di origini multiple. Da ogniorigine di replicazione nasce una bolla replicativa che si espande in direzioni opposte. Due bolle replicative entratein contatto si fondono formandone una sola.
Collegamenti esterni• Animazione: replicazione del DNA [1]
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Note[1] http:/ / strangepaths. com/ replicazione-del-dna/ 2007/ 07/ 03/ it/

Mitosi 98
Mitosi
Le fasi della duplicazione cellulare.
La mitòsi è la riproduzione perdivisione equazionale della cellulaeucariote. Il termine viene spessoutilizzato anche per la riproduzionedelle cellule procariote, un processomolto più semplice e più correttamentechiamato scissione binaria o amitosi. Iltermine mitosi deriva dal greco mìtos,"filo"; nome dovuto all'aspettofiliforme dei cromosomi durante lametafase.
La mitosi, nell'uomo, riguarda le cellule somatiche dell'organismo (ossia tutte le cellule fuorché quelle che hannofunzione riproduttiva: i gametociti primari, i quali vanno incontro alla meiosi) e le cellule germinali ancoraindifferenziate.
La mitosi nel ciclo cellulareIl → ciclo cellulare si suddivide in tre fasi: l'→ interfase, in cui la cellula si prepara alla divisione; la mitosi, periododi gran lunga più breve in cui la cellula si divide; il periodo G2 - più o meno definitivo -, nel quale la cellula sispecializza nella sua funzione. In quest'ultimo periodo, la cellula non è in grado o non è stimolata a riprodursi.Il processo inizia con la condensazione della cromatina, che avviene grazie alla presenza di proteine istoniche chefungono da centri primari di organizzazione del riavvolgimento del DNA - primo ordine di spiralizzazione - e dellatopoisomerasi II, che, oltre alla sua funzione catalitica, agisce come centro di organizzazione del secondo ordine dispiralizzazione. Segue un terzo ordine di cui non si conoscono le proteine implicate; forse è conseguenza dellatensione accumulata dalle precedenti spiralizzazioni. Questo grosso superfilamento viene prima impaccato formandodelle anse che poi si riuniscono formando il cromosoma visibile. La durata media di questo meccanismo diriproduzione cellulare varia in media, negli organismi superiori, tra le 15 e le 30 ore.
Eventi precedenti la mitosiPrima della mitosi avviene l'→ interfase, momento molto importante nella vita della cellula. Difatti proprio in questafase gli organelli della cellula aumentano e ne permettono la duplicazione. L'interfase si suddivide in tre sottofasi: lafase G1, in cui la cellula si accresce; la fase S, nella quale la cellula replica il materiale nucleare e il DNA; la fase G2,durante la quale la cellula si prepara a dividersi.
ProfaseDurante la prima fase della mitosi, nel caso della specie umana, i cromosomi si condensano e sono visibili anche almicroscopio ottico sotto forma di doppi bastoncelli basofili: i cromatidi gemelli (o fratelli). Questi sono agganciatitra loro in un punto centrale, detto centromero, grazie ad un complesso sistema di interazioni tra il DNA e numeroseproteine chiamato fuso acromatico.Viene sintetizzato un secondo centrosoma, ed entrambi appaiono circondati da una coltre di microtubuli: è il fuso mitotico, formato da dimeri di sub-unità proteiche tubulina alfa e beta. Il ciclo si potrebbe interrompere in questo punto se alla coltura si aggiungesse la tossina falloidina, che impedisce la formazione dei filamenti di microtubuli; ciò si fa quando si vogliono visualizzare al microscopio i cromosomi per studiarne le caratteristiche. L'→ apparato del Golgi e il → reticolo endoplasmatico in questa fase si scompongono in piccole vescicolette che si distribuiscono

Mitosi 99
uniformemente in tutto il → citoplasma; anche la membrana nucleare, grazie alla sua doppia struttura, si scomponesimilmente ai suddetti organelli.
MetafaseQuesta fase inizia attraverso una sub-fase, la prometafase, in cui avviene l'improvvisa dissoluzione della membrananucleare, che si frammenta in tante vescicolette. Tale processo viene innescato dalla fosforilazione, attraverso dellechinasi, dell proteine delle lamine (filamenti intermedi) che costituiscono la lamina nucleare; in conseguenza dellafosforilazione i filamenti si dissociano negli elementi costitutivi.I due centrosomi si portano ai poli opposti della cellula ed agiscono come centri di organizzazione microtubulare,catalizzando l'allungamento ed assicurando il corretto orientamento dei microtubuli che andranno a breve a legarsi alcentromero di uno dei due cromatidi gemelli. In questa fase si possono verificare degli errori e due microtubuli sipossono agganciare allo stesso cromatidio dando poi una cellula figlia mutilata e non vitale.Le ventitré coppie di cromatidi vengono portate nella parte mediana della cellula, formando la piastra equatoriale, incui un piano immaginario, passante per i centromeri, divide le coppie di DNA. È questo il momento più favorevoleper lo studio dei cromosomi, che sono ora al massimo della loro spiralizzazione e affiancati ordinatamente lungo lapiastra equatoriale posta al centro della cellula.
AnafaseDurante l'anafase, i cromatidi migrano verso i due centrosomi ai poli opposti della cellula. Si riconoscono duemomenti, detti anafase A e anafase B. Nella prima si assiste alla separazione dei due cromatidi fratelli ad opera di unenzima, detto separasi, con relativa migrazione degli stessi grazie a proteine motore (tipo dineine citoplasmatiche)presenti a livello del cinetocore. Nell'anafase B si assiste al reciproco scorrimento dei microtubuli polari del fusomitotico con conseguente allontanamento dei due centrosomi verso direzioni opposte. Pertanto si ottiene il ripristino,per ogni polo, del numero originario di cromosomi.
TelofaseNell'ultima fase della mitosi, i cromosomi si despiralizzano. Intorno ai due nuovi complessi cromosomiciricompaiono le membrane nucleari e gli organelli si ricompongono. La telofase si conclude con una sottofase: lacitodieresi, in cui si separa il → citoplasma in modo equivalente in entrambe le nuove cellule. La cellula si divide alcentro formando due cellule figlie, esattamente identiche alla cellula madre ma più piccole. Questo avviene grazie adun anello di actina creatosi al centro della cellula madre che, contraendosi, stringe la cellula al centro. A tal punto leproteine specializzate operano la fusione e la separazione della membrana in punti specifici e le due cellule siseparano.In alcune cellule la telofase non avviene e si accumulano all'interno di uno stesso nucleo di una stessa cellula da duead alcune decine di corredi cromosomici. Questo tipo di cellule si chiama plasmodio. L'esempio principale sono iprotozoi del genere plasmodium come il P. malariae. Anche cellule umane vanno incontro a questo processo opatologicamente, come le cellule tumorali, o fisiologicamente come nel megacariocita.

Mitosi 100
Collegamenti esterni• (IT) Video che mostra il processo di divisione cellulare. [1]
Voci correlate• Meiosi• Cellula• → Ciclo cellulare
Cellula
Organuli e strutture cellulari
→ Apparato del Golgi • Apparato mitotico • → Centriolo • → Ciglia • → Citoplasma • Cloroplasto • → Citoscheletro • →Flagello • Leucoplasto • → Lisosoma • → Membrana cellulare • → Mitocondrio • Membrana nucleare • → Nucleo • Nucleolo
• → Perossisoma
Processi cellulari
Apoptosi • → Ciclo cellulare • Divisione cellulare • Endocitosi • Esocitosi • Fagocitosi • → Interfase • Meiosi • → Mitosi •Necrosi • Pinocitosi • Respirazione cellulare • → Trasporto di membrana (→ Trasporto attivo • → Trasporto passivo)
Metabolismo delle macromolecole
Folding • → Replicazione del DNA • Riparazione del DNA • Sintesi proteica • TrascrizioneVai al Progetto Bio • Discuti alla Doppia Elica
Note[1] http:/ / fisica. decapoa. altervista. org/ fisica/ index. php?w0=mitosi_e_meiosi& & id=898

Fonti e autori delle voci 101
Fonti e autori delle vociMembrana cellulare Fonte: http://it.wikipedia.org/w/index.php?oldid=28246688 Autori:: .snoopy., 212.141.187.xxx, Al Pereira, Alexxxx, Alfio, Anassagora, Andrea.gf, Archenzo, Ary29,Davide, Dread83, Drosophil4, Esculapio, Frieda, Ft1, Gac, Ggonnell, Ghazi85, Giac83, GiòGiò, Ic4ns33, Jalo, Joana, Jotar, Kiado, Maluv, Marcel Bergeret, Metis, Mitchan, Nijeko, Oks, Osk,Phantomas, Pirandello63, Red devil 666, Retaggio, Ricce, Riccioli72, Sbisolo, Simone, SkY`, Snowdog, Template namespace initialisation script, Tuttigiu, VincenzoX, 130 Modifiche anonime
Modello a mosaico fluido Fonte: http://it.wikipedia.org/w/index.php?oldid=18825154 Autori:: Alexxxx, Frieda, Ggonnell, Giac83, Hellis, Oks, Paginazero, Sbisolo, 17 Modifiche anonime
Composizione della membrana cellulare Fonte: http://it.wikipedia.org/w/index.php?oldid=27239520 Autori:: Ggonnell, Giac83, MaEr, Ronkas, Senpai, 9 Modifiche anonime
Trasporto di membrana Fonte: http://it.wikipedia.org/w/index.php?oldid=27177590 Autori:: .jhc., Barbaking, Gabbiere, Ggonnell, Giac83, Tizianok, Toxicologytoday, Yuma, 11 Modificheanonime
Trasporto passivo Fonte: http://it.wikipedia.org/w/index.php?oldid=27893756 Autori:: .jhc., Barbaking, Colom, Elisa C., Gabbiere, Ggonnell, Giac83, Leptictidium, Luckyz, Marcol-it,Tizianok, 7 Modifiche anonime
Diffusione facilitata Fonte: http://it.wikipedia.org/w/index.php?oldid=25122770 Autori:: Ariel, Barbaking, Elisa C., Kintaro Oe, Lillolollo, Marcol-it, No2, Sbisolo, 1 Modifiche anonime
Trasportatore di membrana Fonte: http://it.wikipedia.org/w/index.php?oldid=27118760 Autori:: .jhc., Alec, Aytrus, Barbaking, Cisco79, Franca.Sacchi, Gabbiere, Giac83, ZioNicco
Trasporto attivo Fonte: http://it.wikipedia.org/w/index.php?oldid=28140136 Autori:: Barbaking, Colom, Davide21, Gabbiere, Ggonnell, Giac83, Iacopo.lea, Marcol-it, Moos, Remulazz,Sbisolo, Tizianok, Tomfox, Waglione, 15 Modifiche anonime
Recettore (biochimica) Fonte: http://it.wikipedia.org/w/index.php?oldid=26496392 Autori:: Alessio Facchin, Fafabifiofo, Gliu, Orisemi, Perkele, Remulazz, Sky, Waglione, 7 Modificheanonime
Recettore transmembrana Fonte: http://it.wikipedia.org/w/index.php?oldid=27449756 Autori:: Gliu, Perkele, Waglione
Recettori accoppiati a proteine G Fonte: http://it.wikipedia.org/w/index.php?oldid=27118845 Autori:: Alessio Facchin, Bultro, Esculapio, Fafabifiofo, Gabriele85, Ghazi85, 4 Modificheanonime
Recettore intracellulare Fonte: http://it.wikipedia.org/w/index.php?oldid=26851850 Autori:: Bbruno, Brownout, Perkele, Sunflower, 8 Modifiche anonime
Canale ionico Fonte: http://it.wikipedia.org/w/index.php?oldid=27118754 Autori:: AttoRenato, Eremdaviq, Ghazi85, Giac83, Ines, Irondelvif83, Laura8510, Lilja, Maloc8, Perkele, The Doc,TierrayLibertad, 5 Modifiche anonime
Potenziale di membrana Fonte: http://it.wikipedia.org/w/index.php?oldid=26390257 Autori:: Al Pereira, Amarvudol, Fabio.gastone, Giac83, Iakopo, Littoria, MaEr, Madrepora, Phantomas,Snowdog, 15 Modifiche anonime
Citoplasma Fonte: http://it.wikipedia.org/w/index.php?oldid=27341665 Autori:: .jhc., Alleborgo, Anassagora, Ares, DarkAp, Gazal Cotre, Ggonnell, Giac83, Hellis, Lorikholmes, Maquesta,Oks, Paphlagon, Robenci, Sannita, Senpai, Snowdog, TierrayLibertad, Zorinik, 11 Modifiche anonime
Citoscheletro Fonte: http://it.wikipedia.org/w/index.php?oldid=28138876 Autori:: Anassagora, AnjaManix, Aytrus, Chiaraalb, Francesco86, Frieda, Ggonnell, Giac83, Guidomac, Henrykus,Immunio, Maxcip, No2, Princessary93, Sbazzone, Semolo75, Supergiuggiola, 24 Modifiche anonime
Microvilli Fonte: http://it.wikipedia.org/w/index.php?oldid=20636897 Autori:: FagoLambda, Gliu, Trixt
Ciglia (cellule) Fonte: http://it.wikipedia.org/w/index.php?oldid=27994029 Autori:: DanGarb, Fafabifiofo, Ggonnell, Giac83, Gliu, Jacopo, Phantomas, Ricce, Trixt, 4 Modifiche anonime
Flagello (biologia) Fonte: http://it.wikipedia.org/w/index.php?oldid=27567638 Autori:: Al Pereira, BlackMew9z, Bultro, Enea29, Esculapio, Fafabifiofo, Flavio.brandani, Ggonnell, Giac83,Henrykus, Jacopo Werther, Mattia Luigi Nappi, Nijeko, Quindicidodici, Salvatore Ingala, Supergiuggiola, Way, 7 Modifiche anonime
Centriolo Fonte: http://it.wikipedia.org/w/index.php?oldid=27801819 Autori:: DanGarb, Ggonnell, Giac83, Malaussene, Mtt, Pietrodn, Qandal, 7 Modifiche anonime
Ribosoma Fonte: http://it.wikipedia.org/w/index.php?oldid=27566015 Autori:: .jhc., Anassagora, Ary29, Brískelly, Bultro, Clematis, Cryptex, Crypto, Diablo, Elen Skywalker, Frack, Gacio,Ggonnell, Mattia Luigi Nappi, Maxcip, Murtasa, Nicksoft, Oks, Paobac, Pumilio, Romanm, Rosco, Vituzzu, Walter Tizzano, 27 Modifiche anonime
Mitocondrio Fonte: http://it.wikipedia.org/w/index.php?oldid=28284387 Autori:: Alchimico, Alfio, Anassagora, Andrea.gf, Ares, Ary29, Aytrus, Cenerentolainnamorata, Clematis, Danilo,Derfel74, Fabio.gastone, Ggonnell, Giac83, Gioland71, Hashar, Hellis, Iron Bishop, KaeZar, Klaudio, M7, MaEr, Marcok, Memoria, Muthafxcka, Nase, Oks, Paginazero, Phantomas, Pietrodn,Pumilio, Romanm, Senpai, Sergio N. Carlini, SkY`, Snowdog, The Doc, Toxicologytoday, Zarathustra, 57 Modifiche anonime
Nucleo cellulare Fonte: http://it.wikipedia.org/w/index.php?oldid=28139446 Autori:: Anassagora, Andraaide, AttoRenato, Codeberry, Danilo, Davide, EdoM, Fljll Flòi, Frieda, Gerlo, Gggg81,Ggonnell, Giac83, Gianluigi, Guglielmo Vacirca, Hill, Luckyz, M7, Maurice Carbonaro, Oks, PaoloCampanella, Piemmea, Rael, Renato Caniatti, Rob-ot, RockScorpion, ThePaladin89, Tux,Vipera, Wilson22, host4-21.pool80180.interbusiness.it, 59 Modifiche anonime
Reticolo endoplasmatico Fonte: http://it.wikipedia.org/w/index.php?oldid=27331902 Autori:: Anassagora, Aytrus, Despertos, Fra74, Ggonnell, Giammy Fuser, Gozzi, Hashar, Lombardelli,Marcok, Nickname, Nijeko, Oks, Phantomas, Romanm, RoyFokker, Sebold, Stef Mec, Veneziano, Zarathustra, 28 Modifiche anonime
Apparato del Golgi Fonte: http://it.wikipedia.org/w/index.php?oldid=28256936 Autori:: Alessia85, Amux, Anassagora, Civvì, DarkAp, Darknymph, Dread83, Frazzone, Ft1, Ggonnell, Giac83,Gliu, Henrykus, KaeZar, Lorenzius, Megalexandros, Metis, Paginazero, Rael, Red devil 666, Renato Caniatti, Robenci, Sbazzone, Snowdog, Tizianok, Xaura, 22 Modifiche anonime
Lisosoma Fonte: http://it.wikipedia.org/w/index.php?oldid=28307914 Autori:: Antoninon, Beta16, Dread83, Enea29, Evildevil, Ft1, Ggonnell, Giac83, Jacopo Werther, Lukius, M.violante, M7,MaEr, Mar san man, Mitchan, Nijeko, Oks, Piemmea, Sbazzone, Simocame, To011, Triph, Zarathustra, 19 Modifiche anonime
Perossisoma Fonte: http://it.wikipedia.org/w/index.php?oldid=27264423 Autori:: .jhc., Anassagora, Gac, Ggonnell, Giac83, Manutius, Oks, Senpai, Superzen, 10 Modifiche anonime
Giunzione cellulare Fonte: http://it.wikipedia.org/w/index.php?oldid=27429755 Autori:: Alletto, Barbaking, Blakwolf, Br4d1p0, Daniele Chignoli, Dread83, Ecodop, Fabio.gastone, Giac83,Inviaggio, Phantomas, Sim.0161, The Rain Keeper, Trixt, 25 Modifiche anonime
Desmosoma Fonte: http://it.wikipedia.org/w/index.php?oldid=27738517 Autori:: Al Pereira, Daniele Chignoli, Giac83, Morgandy, Trixt, 2 Modifiche anonime
Ciclo cellulare Fonte: http://it.wikipedia.org/w/index.php?oldid=28002190 Autori:: A.massaro, Barbaking, Behemot, Cisco79, Daniele Chignoli, Ggonnell, Giac83, Incola, Kibira, Lived, MattiaLuigi Nappi, Osk, Pfabio, Phantomas, Septem, TierrayLibertad, Tizianok, Toxicologytoday, Triph, Twice25, White wolf, Yoruno, 39 Modifiche anonime
Interfase Fonte: http://it.wikipedia.org/w/index.php?oldid=28060533 Autori:: Buggia, Ggonnell, Giac83, Luisa, Marius, Mattia Luigi Nappi, Pfabio, Snowdog, Supermary, Tizianok, 10Modifiche anonime
Fase G1 Fonte: http://it.wikipedia.org/w/index.php?oldid=27575934 Autori:: Caio Cesare, Mattia Luigi Nappi, Starwars, Triquetra, 10 Modifiche anonime
Fase S Fonte: http://it.wikipedia.org/w/index.php?oldid=26757313 Autori:: Cotton, Francescaaaa, Mattia Luigi Nappi, 3 Modifiche anonime
Fase G2 Fonte: http://it.wikipedia.org/w/index.php?oldid=23354441 Autori:: Mattia Luigi Nappi, Triquetra, 1 Modifiche anonime
Replicazione del DNA Fonte: http://it.wikipedia.org/w/index.php?oldid=27916336 Autori:: *Raphael*, Andmari, Casso89, ChemicalBit, Danilo, Elborgo, Gabriele85, Ggonnell, Giac83, Hellis,Henrykus, Leptictidium, Lohe, Lp, MapiVanPelt, Mess, Richzena, Snowdog, Trixt, Valepert, 22 Modifiche anonime

Fonti e autori delle voci 102
Mitosi Fonte: http://it.wikipedia.org/w/index.php?oldid=27701923 Autori:: Albetro La Vigna, Anassagora, AttoRenato, Bukkia, Daddolino, Davide21, Elwood, Filnik, Giac83, Gianreali,Giovannigobbin, Guidomac, Henrykus, Iacopo.lea, KaeZar, Leoman3000, MSilvestro, MapiVanPelt, Maquesta, Mattia Luigi Nappi, Number55, Osk, Phantomas, Rampa4, Restu20,Riotparamore, Roby69m, Rosario9, Rudigaspardo, Sbazzone, Semolo75, Senpai, Simo82, Sirabder87, Starwars, Tizianok, Vituzzu, Waglione, Yerul, Ylebru, 95 Modifiche anonime

Fonti, licenze e autori delle immagini 103
Fonti, licenze e autori delle immaginiFile:Cell membrane detailed diagram 4 it.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:Cell_membrane_detailed_diagram_4_it.svg Licenza: Creative CommonsAttribution-Sharealike 3.0 Autori:: User:Dhatfield, user:LadyofHatsImmagine:Plasmamembrana.png Fonte: http://it.wikipedia.org/w/index.php?title=File:Plasmamembrana.png Licenza: sconosciuto Autori:: Alexxxx, SnowdogImmagine:Fluidità membrana.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Fluidità_membrana.jpg Licenza: sconosciuto Autori:: Alexxxx, SnowdogImmagine:Movimenti lipidi nella membrana.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Movimenti_lipidi_nella_membrana.jpg Licenza: sconosciuto Autori:: Alexxxx,SnowdogImmagine:Raft.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Raft.jpg Licenza: sconosciuto Autori:: Alexxxx, SnowdogImmagine:Commons-logo.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:Commons-logo.svg Licenza: logo Autori:: User:3247, User:GruntImage:Nuvola_apps_katomic.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:Nuvola_apps_katomic.svg Licenza: GNU Lesser General Public License Autori:: User:StanneredImmagine:Diapositiva2.JPG Fonte: http://it.wikipedia.org/w/index.php?title=File:Diapositiva2.JPG Licenza: sconosciuto Autori:: Alexxxx, Aushulz, SnowdogImmagine:Membrana cellulare -Danielli.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Membrana_cellulare_-Danielli.jpg Licenza: sconosciuto Autori:: Alexxxx, SnowdogImmagine:Diacil-fosfogliceridi.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Diacil-fosfogliceridi.jpg Licenza: sconosciuto Autori:: Alexxxx, SnowdogImmagine:Membrana cellulare3.JPG Fonte: http://it.wikipedia.org/w/index.php?title=File:Membrana_cellulare3.JPG Licenza: sconosciuto Autori:: Alexxxx, SnowdogImmagine:Asimmetria membrana.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Asimmetria_membrana.jpg Licenza: sconosciuto Autori:: Alexxxx, SnowdogImmagine:Reazione_ATP.gif Fonte: http://it.wikipedia.org/w/index.php?title=File:Reazione_ATP.gif Licenza: Public Domain Autori:: User:ToxicologytodayImmagine:TrasportoMembrana.png Fonte: http://it.wikipedia.org/w/index.php?title=File:TrasportoMembrana.png Licenza: GNU Free Documentation License Autori:: Uploader's edit onoriginal 's workImmagine:Calcium_pump_inactive_vs_active_form_.png Fonte: http://it.wikipedia.org/w/index.php?title=File:Calcium_pump_inactive_vs_active_form_.png Licenza: Public Domain Autori:: Illustration by David S. Goodsell of The Scripps Research Institute (see this site)Immagine:Acethylcholine_receptor.png Fonte: http://it.wikipedia.org/w/index.php?title=File:Acethylcholine_receptor.png Licenza: Public Domain Autori:: Illustration by David S. Goodsellof The Scripps Research Institute (see this site)Immagine:TransportProteine.png Fonte: http://it.wikipedia.org/w/index.php?title=File:TransportProteine.png Licenza: GNU Free Documentation License Autori:: (originally uploaded on20th May 2005)Immagine:Recettoredimembrana.gif Fonte: http://it.wikipedia.org/w/index.php?title=File:Recettoredimembrana.gif Licenza: sconosciuto Autori:: User:Waglioneimmagine:transmembrane_receptor.png Fonte: http://it.wikipedia.org/w/index.php?title=File:Transmembrane_receptor.png Licenza: GNU Free Documentation License Autori::User:Magnus ManskeImmagine:transmembrane receptor.png Fonte: http://it.wikipedia.org/w/index.php?title=File:Transmembrane_receptor.png Licenza: GNU Free Documentation License Autori::User:Magnus ManskeImmagine:GPCR.png Fonte: http://it.wikipedia.org/w/index.php?title=File:GPCR.png Licenza: GNU Free Documentation License Autori:: RetamaImmagine:G_Protein_Cycle.png Fonte: http://it.wikipedia.org/w/index.php?title=File:G_Protein_Cycle.png Licenza: GNU Free Documentation License Autori:: RetamaImmagine:Cell1.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Cell1.jpg Licenza: GNU Free Documentation License Autori:: Tony29Immagine:Semipermeable membrane.png Fonte: http://it.wikipedia.org/w/index.php?title=File:Semipermeable_membrane.png Licenza: Public Domain Autori:: Guillom, Mike.lifeguard,Pidalka44, Smooth OImmagine:FluorescentCells.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:FluorescentCells.jpg Licenza: Public Domain Autori:: DO11.10, Emijrp, Hannes Röst, NEON ja,Origamiemensch, Splette, Tolanor, 5 Modifiche anonimeFile:Cilia.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Cilia.jpg Licenza: Public Domain Autori:: User Magnus Manske on en.wikipediaImmagine:Haeckel Flagellata.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Haeckel_Flagellata.jpg Licenza: Public Domain Autori:: Ernst HaeckelImmagine:Flagellum_base_diagram_en.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:Flagellum_base_diagram_en.svg Licenza: Public Domain Autori:: User:LadyofHatsImmagine:Physical model of a bacterial flagellum.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Physical_model_of_a_bacterial_flagellum.jpg Licenza: Creative CommonsAttribution-Sharealike 2.0 Autori:: Alan WolfImmagine:Chlamydomonas (10000x).jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Chlamydomonas_(10000x).jpg Licenza: Public Domain Autori:: Luis Fernández García, NEONja, Neil916, ThuressonImmagine:Ribosome shape.png Fonte: http://it.wikipedia.org/w/index.php?title=File:Ribosome_shape.png Licenza: sconosciuto Autori:: User:VossmanImmagine:10 large subunit.gif Fonte: http://it.wikipedia.org/w/index.php?title=File:10_large_subunit.gif Licenza: Public Domain Autori:: Original uploader was TimVickers at en.wikipediaImmagine:10 small subunit.gif Fonte: http://it.wikipedia.org/w/index.php?title=File:10_small_subunit.gif Licenza: Public Domain Autori:: Original uploader was TimVickers at en.wikipediaFile:Mitochondrie.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:Mitochondrie.svg Licenza: sconosciuto Autori:: GunnerPoulsen, Ies, MetalGearLiquid, Oxam Hartog, Tatoute,TimVickers, WarX, 6 Modifiche anonimeFile:Mitochondria, mammalian lung - TEM.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Mitochondria,_mammalian_lung_-_TEM.jpg Licenza: Public Domain Autori:: LouisaHowardImmagine:Diagram human cell nucleus.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:Diagram_human_cell_nucleus.svg Licenza: Public Domain Autori:: user:LadyofHatsImmagine:NuclearPore crop.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:NuclearPore_crop.svg Licenza: Creative Commons Attribution-Sharealike 2.5 Autori:: User:Adenosine,User:LadyofHatsImmagine:Micrograph of a cell nucleus.png Fonte: http://it.wikipedia.org/w/index.php?title=File:Micrograph_of_a_cell_nucleus.png Licenza: Public Domain Autori:: User:Opabinia regalis,User:PNG crusade bot, User:Remember the dotImmagine:RanGTPcycle.png Fonte: http://it.wikipedia.org/w/index.php?title=File:RanGTPcycle.png Licenza: GNU Free Documentation License Autori:: Original uploader was Shao atuk.wikipediaImmagine:Mitosis-flourescent.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Mitosis-flourescent.jpg Licenza: sconosciuto Autori:: -Immagine:redbloodcells.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Redbloodcells.jpg Licenza: sconosciuto Autori:: Habj, Ranveig, Shizhao, Simon Shek, Solon, Sundar,ThuressonFile:schema_nucleo_cellulare.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Schema_nucleo_cellulare.jpg Licenza: sconosciuto Autori:: TuxImmagine:Human leukocyte, showing golgi - TEM.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Human_leukocyte,_showing_golgi_-_TEM.jpg Licenza: Public Domain Autori::Louisa HowardImmagine:Biological_cell.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:Biological_cell.svg Licenza: sconosciuto Autori:: user:MesserWoland, user:Szczepan1990Immagine:Cell_junction_simplified_it.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:Cell_junction_simplified_it.svg Licenza: Public Domain Autori:: user:Gia.cossa,user:LadyofHatsFile:Desmosome_cell_junction_it.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:Desmosome_cell_junction_it.svg Licenza: Public Domain Autori:: user:LadyofHats, user:gia.cossaImmagine:cell_cycle.png Fonte: http://it.wikipedia.org/w/index.php?title=File:Cell_cycle.png Licenza: GNU Free Documentation License Autori:: Pamri, Snek01, TimVickers, 9 ModificheanonimeImmagine:DNA replication split.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:DNA_replication_split.svg Licenza: sconosciuto Autori:: User:MadprimeImmagine:DNA replication it.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:DNA_replication_it.svg Licenza: Public Domain Autori:: User:Elborgo, user:LadyofHatsImmagine:Forca replicativa.jpg Fonte: http://it.wikipedia.org/w/index.php?title=File:Forca_replicativa.jpg Licenza: sconosciuto Autori:: Original uploader was Danilo at it.wikipediaImmagine:Eventi principali della mitosi.svg Fonte: http://it.wikipedia.org/w/index.php?title=File:Eventi_principali_della_mitosi.svg Licenza: Public Domain Autori:: User:Bukkia

Licenza 104
LicenzaCreative Commons Attribution-Share Alike 3.0 Unportedhttp:/ / creativecommons. org/ licenses/ by-sa/ 3. 0/