Corso Di Citologia
-
Upload
michele-visciano -
Category
Documents
-
view
253 -
download
2
description
Transcript of Corso Di Citologia
CORSO DI CITOLOGIAprof.ssa Parolini
1. le tecniche di indagine istologica
a. gli strumenti di indagine
Per lo studio strutturale ed ultrastrutturale de tessuti e delle cellule sono necessari strumenti che permettono di osservare la forma e la composizione degli elementi che li componga.
L’occhio umano ha una risoluzione troppo bassa per poter osservare una cellula (0,2 mm).
La nascita dello studio della cellula è strettamente connessa agli strumenti che permettano di indagarne la struttura:
- Galileo Galilei da l’impulso a questa nuova scienza con la costruzione del primo sistema di lenti detto microscopio
- Il microscopio ottico permette di arrivare a circa 0,2 micron, quindi di osservare la struttura delle cellule.
- Per vedere internamente la cellula e considerarla d un punto di vista ultrastrutturale (organuli e acromolecole), è necessario l’utilizzo del microscopio elettronico, che ha un potere di risoluzione pari a 0,2 nm.
b. Le dimensioni delle cellule
Le cellule dei vari tessuti possono essere lunghe:- qualche centimetro (neuroni e cellule muscolari)- mediamente dai 6,7 micron ai 300 micron
I batteri hanno generalmente grandezze comprese tra 1 e 2 micron.
I virus giungono invece a dimensioni ben inferiori(10 – 300 nm).
c. Osservazione a fresco dei campioni (cellule vive)
In istologia è parecchio difficile riuscire a osservare ciò che si vuole mentre le cellule sono in vita, poiché sono necessari dei procedimenti fisico-chimici per la preparazione e l’osservazione del campione che uccidono la cellula.
Tuttavia esistono due modi per osservare la cellula in vita:- osservazione al microscopio a contrasto di fase,- con colorazioni vitali, ovvero colorazioni che non ucidono la
cellula
Alcune colorazioni vitali:- alizarina: composto altamente specifico che si incorpora nella
sostanza fondamentale dell’osso e lo colora di rosso- verde Janus: colora selettivamente i mitocondri sfruttando una
red-ox che avviene solamente a livello del citoplasma, mentre nei mitocondri rimane allo stato ossidato.
- Blu di metilene: sfrutta l’affinità chimico-fisica ad alcune strutture. Si lega all’assone delle cellule nervose e le colora vitalmente
- Sospensioni colorate: in alcuni casi, sospensioni colorate assorbite dalla cellula per fagocitosi vengono chiuse nei vacuoli e danno informazioni circa la presenza di queste strutture.
d. La preparazione del tessuto
L’osservazione delle cellule in vita pone limitazioni consistenti:- sopravvivenza fuori dall’organismo- spessore eccessivo- mancanza di contrasto cromatico
Si rende necessario fissare le cellule e i tessuti per impedire le denaturazioni post-mortem delle cellule, e colorarle secondo la necessità per distinguere i vari componenti.
Per la preparazione del campione si seguono le seguenti tappe:1. fissazione2. disidratazione3. diafanizzazione
4. inclusione5. sezionamento o taglio6. montaggio7. colorazione
Si osservano ora nel dettaglio
1. fissazione
La fissazione è un procedimento che si propone di salvare al meglio dalle alterazioni conseguenti alla morte la struttura protoplasmatica della cellula.
Può essere fatta sia con agenti chimici che con agenti fisici, e nel modo più veloce possibile, in modo che la struttura rimanga inalterata rispetto all’azione degli enzimi.
Inoltre, questo processo permette ai coloranti di fissarsi in particolari strutture.
La fissazione, può tuttavia portare ad artefatti, dati dalla denaturazione delle proteine:
- i migliori fissativi sono quelli in cui le proteine precipitano nel modo più fine possibile.
Fissativi chimici:
si possono suddividere in due gruppi in base alla loro azione sulle proteine:
- fissativi che precipitano le proteine- fissativi che non precipitano le proteine
tra i fissativi che precipitano le proteine vi sono l’acido acetico, l’alcol etilico, le soluzioni di bicloruro di mercurio, ecc…
Nei fissativi acidi, nonostante si abbia un potere di penetrazione elevato, le proteine si ingrossano e si addensano in grosse zolle.
I fissativi che non precipitano le proteine sono principalmente:- formaldeide- acido osmico
L’acido osmico è uno dei migliori fissativi, ma il basso potere di penetrazione richiede campioni molto sottili
Fissazione fisica.
La fissazione fisica prevede il congelamento repentino del campione di tessuto.
La velocità di congelamento è importante per un duplice motivo:- più il congelamento è veloce, meglio si conservano le strutture- più è veloce, più piccoli sono i cristalli di ghiaccio.
Per congelare, si usano quasi sempre:- isopentano- azoto liquido.
La preferenza della fissazione fisica è data da molteplici vantaggi:- le sostanze solubili non vengono estratte dai tessuti, lasciandoli
nel loro stato originale- la localizzazione intracellulare delle strutture rimane la medesima
della cellula viva
Questi metodi, sono preferenziali nelle ricerche istochimiche.
2. Disidratazione e diafanizzazione
Per essere imbevuto in paraffina (idrofoba) deve essere svuotato di acqua:
- si immerge in vaschette contenenti alcol via via più concentrato fino all’alcol puro
- viene successivamente immerso in xilolo, o solventi simili, che lo lberano dall’alcol e lo rendono solubile nella paraffina
3. inclusione
il preparato viene imbevuto nella paraffina e scaldato in stufe a 50-60°C in modo che il solvente della paraffina liquida evapori e questa si solidifichi.
Il risultato è un blocchetto che può essere posizionato sul porta-pezzo del microtomon, lo strumento che lo taglia.
4. sezionamento o taglio
il taglio avviene con un apposito strumento chiamato microtomon, che riduce in lamine sottili il blocchetto di paraffina con il tessuto immerso.
Lo spessore va 1 a 10 micron, poiché deve essere attraversato dalla luce.
Per la visione al microscopio elettronico le lamine devono essere ulteriormente sottili:
- si usa uno strumento chiamato ultramicrotomon, che lo taglia in lamine di 50-80 nanometri.
Per indagini d tipo istochimico, con pezzi congelati, si usano due tipi di strumento:
- microtomon congelatore: il pezzo viene irrigidito da un getto di ghiaccio secco (CO2) e tagliato
- criostato: il pezzo è tagliato in una cella frigorifera a -20/30°C
5. montaggio
Il processo di distensione è il posizionamento del preparato su un vetrino:
- effettuato a caldo ad una t inferiore a quella di fusione della paraffina
- il preparato galleggia su uno strato di acqua
6. colorazione
A fresco un campione non è riconoscibile nelle sue varie strutture, poiché è attraversato dalla luce in maniera omogenea:
- ci si avvale i sostanz coloranti specifiche che in a contatto con determinate molecole si comportino come “inner filter”, non lasciando passare la luce di una determinata lunghezza d’onda.
La colorazione comporta la rimozione del materiale d’inclusione:- si fa passare il composto in vaschette contenenti alcol in serie
discendente, poi li si reidrata con acqua distillata- si applica la colorazione (di norma a base acquosa)- lo si lava più volte per rimuovere il colorante da dove non si è
legato
Vi sono differenti tipi di colorazione:
a. colorazioni dirette: le sezioni prendono il colorante direttamente dalla soluzione
b. indirette o per mordenzatura: il preparato viene sottoposto a processi preparatori con sostanze a contenuto metallico dette mordenti.
I coloranti più comuni sono- ematossilina-eosina: colorante acido-base, che colora i
nuclei di blu e le rimanenti zone della cellula in rosa- blu di toluidina: colorante blu di carattere basico- Azan Mallory: colorante tricromico, con una base (giallo),
un acido (rosso) e un reagente con le fibre extracellulari.- Acido periodico di Schiff: utilizzato per trattare gli
epiteli. Colora gli elementi contenenti glucosio (glicogeno e carboidrati)
- Orceina di Weigert: colorante per strutture elastiche- Sali d’argento: colorano le fibre reticolari, ad esempio i
neuroni e le strutture nervose.- Ematossilina ferrica: colora il nucleo delle cellule, i
muscoli, eritrociti.- Giemsa-Wright: per colorazioni differenziate delle cellule
del sangue
Per le osservazioni al microscopio elettronico:- si ricorre a coloranti elettronici, fatti di metalli pesanti
impermeabili agli elettroni (acetato di uranile, citrato di piombo, ecc…) che si addensano selettivamente su determinate strutture
- il montaggio consiste nell’applicazione di un sovravetrino sopra al vetrino
- il preparato va immerso nell’olio di cedro, ma occorre che sia eliminata tutta l’acqua, quindi lo si fa passare prima nell’alcol poi nello xilolo
Le sezioni ottenute all’ultramcrotomo invece vanno distese su una pellicola applicata su un retino metallico.
Per puntualizzare, si precisa che la forma del campione dipende dal tipo di prelievo e di sezione che è sono stati effettuati.
e. Colorazione immunoistochimica
Serve per marcare una determinata proteina. Questa si lega ad un anticorpo ricavato da una cavia immunizzata.
Per localizzare una proteina si lega una sostanza fluorescente all’anticorpo, il quale viene poi immesso nel campione.
Procedimento indiretto: si inserisce direttamente l’anticorpo (es. immunoglobulina G) nel campione, il quale si lega all’antigene e rende possibile la localizzazione con microscopi:
- ottico convenzionale- a fluorescenza
Procedimento indiretto: si inserisce inizialmente solo l’anticorpo primario, ovvero quello senza sostanza fluorescente. In seguito si immette l’anticorpo secondario che si lega al complesso antigene-anticorpo primario, rendendolo visibile. Il passaggio indiretto è conveniente perché rende possibile un maggior numero di legami di anticorpi secondari su un primario.
I marker possono essere anche di altri tipi:- sostanze fluorescenti (fluorescina o rodamina)- enzimi- ferritina (x micro elettr.)- enzimi- sostanze radioattive.
f. Citometria a flusso
È un esame statistico (non visivo), per cui le cellule contenute in una soluzione tampone vengono fatte passare una ad una in un raggio laser, che rileva informazioni riguardo la fluorescenza di alcune cellule.
Tramite un computer le informazioni possono essere rielaborate e organizzate in istogrammi.
Le cellule possono essere vive, ed è possibile inbiberle di traccianti fluorescenti, che amplificano la presenza di determinati antigeni, dna, rna, ecc..
È un sistema molto veloce, che consente di analizzare un gran numero di cellule e dividerle in sottopopolazioni grazie a 2 piastre elettriche che deviano le gocce d’acqua contenenti una cellula in base alla carica elettrica.
g. I microscopi
i. Ottico convenzionaleii. Ottico a contrasto di fase
iii. Ottico a interferenzaiv. Ottico a fluorescenzav. Elettronico a trasmissione
vi. Elettronico a scansione
2. Livelli di organizzazione della materia vivente
a. Generalità
È definita materia vivente tutto ciò che ha la capacità di:- prodursi e replicarsi in organismi molto simili al
progenitore- evolversi
In natura sono presenti vari tipi di organizzazione della materia:- atomi: unità fondamentale della materia, studiata dalla
fisica- molecole: unità formate da più atomi. Studiate dalla
Chimica- molecole organiche e biomolecole: molecole contenenti
carbonio, proteine, ecc. che sono funzionali agli esseri viventi
- cellula: unità funzionale degli esseri viventi. Più piccola unità che ha proprietà vitali e presenta un’organizzazione interna. Ha dimensioni che possono variare da 10 cm, a 3 micron.
Nella teoria cellulare, sono tuttavia esclusi determinati agenti che possono essere considerati viventi, anche se mancano di alcune caratteristiche e di parte dell’autonomia:
- virus- viroidi- prioni
b. Eccezioni alla teoria cellulare: virus, tiroidi, prioni
I virus:- particelle di varie forme e dimensioni formati da un
involucro proteico (capside)- forme di vita parassitarie (per svolgere i propri
meccanismi biologici necessitano una cellula a cui legarsi)
- contengono uno dei due acidi nucleici (o DNA o RNA)- vengono assemblati dopo la sintesi dei loro componenti
I viroidi:- piccole molecole circolari di RNA in grado di replicarsi- i viroidi non possiedono alcun involucro esterno- sono agenti eziologici (che causano malattie) di
numerose patologie delle piante
il prione:- è una molecola proteica presente nei soggetti sani che ha
cambiato l’orientamento spaziale- le cause sono ignote- può trasferire la propria anomalia alle molecole sane dello
stesso tipo.
Si stima che il morbo della mucca pazza abbia origine prionica.
c. Le cellule
Le cellule sono le più piccole unità vitali: - possiedono in sé tutti i meccanismi necessari alla sintesi
e digestione di macromolecole- rispecchiano tutte uno scema di base, con organuli e
materiale simile. - Possiedono un corredo genetico (DNA)- Si riproducono
Nonostante ciò vi sono notevoli differenze nella complessità delle cellule. Queste si differenziano in prima analisi in:
- procarioti- eucarioti
d. Cellule procariote
Sono cellule estremamente più semplici rispetto alle cellule eucariote. Si distinguono da queste per una serie di differenze specifiche:
- dimensioni ridotte
- mancanza di una compartimentazione citoplasmatica- mancanza di un nucleo ben definito- il DNA è immerso nel citoplasma ed è costituito da un
unico filamento.
Tuttavia, possiedono tutte le caratteristiche e le funzioni di sintesi per macromolecole e biomolecole, e altri meccanismi biochimici in grado di dargli vita autonoma.
I Procarioti sono costituiti da una massa di citoplasma in cui è immerso il nucleoide, il filamento anulare di DNA ammassato (genoforo).
Il genoforo è fissato ad uno strato della membrana (mesosoma) plasmatici da un perno.
In altri mesosomi sono presenti gli enzimi respiratori, molto simili a quelli dei mitocondri.
I batteri si riproducono per scissione trasversale, dopo aver duplicato il materiale genetico.
Il citoplasma batterico contiene:- ribosomi (sintesi proteica)- mesosomi
Sono delimitati dall’esterno da una doppia membrana:- parete cellulare (esterna)- membrana cellulare.
particolari tipi di batteri detti cellule cianofite hanno degli organismi che attuano la fotosintesi clorofilliana, tilacoidi.
e. Cellule eucariote
Oltre ai batteri e alle cianofite, tutti gli altri organismo sono formati da cellule eucariote.
Gli organismi pluricellulari sono strutturati con tessuti in cui le cellule eucariote si differenziano addirittura. L’organizzazione dei tessuti forma gli organi, gruppi di tessuti con una precisa funzione.
Sincizi: unione di due o più cellule inizialmente autonome, in cui rimane un duplice nucleo.
Plasmodi: cellule plurinucleate a causa della non completa divisione dopo la duplicazione del DNA.
Le cellule dei metazoi si dividono a seconda della durata della loro vita:- cellule perenni- cellule stabili- cellule labili (prodotte da cellule indifferenziate dette
cellule staminali)
l’ultrastruttura di una cellula eucariote:
- membrana plasmatica: sottile strato lipidico, permeabile solo a determinate sostanze. Segue ogni introflessione per formare i microvilli, quando necessario.
- nucleo: delimitato da una doppia membrana detta involucro nucleare, ricoperta sulla zona citoplasmatica da ribosomi. All’interno vi è il corredo genetico della cellula, il DNA.
- citoplasma: è in comunicazione con l’esterno e con il nucleo. Formato da una sostanza gelatinosa (citosol o ialoplasma) in cui sono immersi numerosi organuli. Presenta un sistema compartimentato: vi sono vari settori suddivisi per funzionalità.
gli organuli:- reticolo endoplasmatico: è una formazione
membranosa estesa, formata di citarne appiattite o tubuli. Vi è un reticolo liscio (REL) e uno rugoso (RER), poiché ricco di ribosomi.
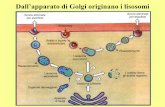
- apparato di Golgi: Composto da una serie di sacche appiattite delimitate da una membrana parallele tra di loro e da piccole vescicole, situate in periferia.
- Lisosomi: sono vescicole che hanno differenti formule e sono funzionali allo smaltimento di molecole (digestione cellulare).
- Ribosomi: partilcelle dense di eletroni, adibite alla sintesi proteica a partire da RNA.
- Mitocondri: Organuli delimitati da una doppia membrana. Quella esterna è liscia, quella interna è ripiegata su sé stessa, formando varie creste.
- Citosol: contiene elementi non racchiusi da membrana (es. glicogeno, gocciole lipidiche, ecc…). Nonostante sembrasse disorganizzato, si è scoperto essere formato da un citoscheletro, un insieme di tubuli e filamenti di tre tipi (microfilamenti, microtubuli, filamenti intermedi), che servono ad ordinare la cellula sostenendo ribosomi o altre simili particelle.
- Perossisomi: sono strutture vescicolari che contengono enzimi particolari (es. uricasi), hanno una funzione simile ai lisosomi.
- Altri organuli: si formano dei tubuli ed un fuso durante la divisione cellulare.
3. Biomolecole
a. Generalità
Sono circa una quarantina gli elementi chimici che entrano a far parte del protoplasma (materia vivente).
I più importanti sono:- ossigeno - carbonio- idrogeno- azoto
A seguire:- zolfo
- fosforo
I primi 4 costituiscono oltre il 97% della materia vivente.
Alcuni sali inorganici, presenti in forma di ioni dissociati svolgono delle funzioni molto importanti, tra cui quella di attivazione.
Altri attivanti per funzioni enzimatiche sono elementi inorganici (in maggior parte metalli), sono presenti in piccole quantità: sono detti oligoelementi.
La materia si divide in:- elementi organici- elementi inorganici
Nel nostro corpo, oltre a lipidi, glucidi, proteine ed acidi nucleoco, vi sono altri importanti molecole, gli ormoni e le vitamine:
- questi sono in pigole quantità, ma hanno funzioni molto rilevanti
b. Carboidrati o zuccheri
I carboidrati sono composti formati da C, H, O e sono la principale riserva energetica di vegetali e animali.
Nelle cellule vegetali, possono anche costituire la parete celulare ed avere dunque una funzione di sostegno.
Sono sostanzialmente di tre tipi:- monosaccaridi- oligosaccaridi- polisaccaridi
Monosaccaridi.
Comprendono i glucidi che non possono essere idrolizzati in composti più semplici.
Sono catene di 3-7 carboni, ai quali sono anche legati un gruppo ossidrile e un idrogeno.
Oltre a questi due legami all’interno della catena, possiedono anche un gruppo aldeidico o un gruppo chetonico.
I più importanti hanno 5 o 6 atomi di carbonio:- pentosi (ribosio, desossiribosio)- esosi (glucosio, fruttosio, lattosio)
Questi possono anche assumere una forma ciclica, formando un gruppo ossidrile semiacetalico o semichetalico.
oligosaccaridi.
Sono molecole formate dall’unione di 2-10 monosaccaridi.
Il sottogruppo più importante è quello dei disaccaridi, formato da 2 monosaccaridi. I più comuni sono:
- maltosio (2 a-glucosio) derivato dall’idrolisi parziale dell’amido
- saccarosio (fruttosio e glucosio) è solitamente usato con funzioni energetiche
- lattosio (galattosio-glucosio)
Polisaccaridi.
Sono lunghe catene di monosaccaridi legati tra loro con un legame O-glucosidico (C1-C4).
Si distinguono in due classi:- eterosaccaridi: Sono formati da monomeri differenti. - omosaccaridi: costituiti tutti da identici monosaccaridi.
Sono ad esempio il glicogeno, l’amido, la cellulosa.
Il glicogeno è la principale forma di immagazzinamento di energia nelle cellule. Costituito da catene ramificate formate da molecole di glucosio.
Una molecola di glicogeno può contenere 5000-500000 molecole di glucosio, a seconda dello stato in cui il tessuto si trova e che vi siano o meno delle patologie.Glicoproteine
Sono una componente essenziale delle membrane plasmatiche e del glicocalice.
Sono glicoproteine determinati antigeni/recettori:- gruppi sanguigni- istocompatibilità (quelli che determinano il rigetto di un
organo trapiantato)
La fibronectina è una glicoproteine che promuove l’adesione cellulare
c. Lipidi
Sono composti organici presenti negli organismi caratterizzati da:- elevata solubilità in composti organici- non miscibilità in acqua (per motivi fisici)
Lo schema più corretto per dividere i lipidi li distingue tra:- lipidi non idrolizzabili: derivati dalla condensazione di
molecole più semplici. Composti di solo lipidi o al massimo alcoli dal basso peso molecolare
- lipidi idrolizzabili: sono detti anche complessi, presentano anche derivati di molecole non lipidiche a carattere polare, ad esempio alcoli, amminoacidi, acido fosforico, oligosaccaridi, ecc.. Questo duplice carattere di una sola molecola (anfipatico e idrofobico) è di estrema importanza a livello biologico.
Lipidi non idrolizzabili
Sono un gruppo estremamente eterogeneo che svolgono le proprie unzioni all’interno della cellula per formare composti più complessi.
Di questo gruppo fanno parte gli acidi carbossilici e gli alcoli:
- sono lunghe catene con un numero pari di atomi di carbonio perché derivate dall’unione dell’acetil coA
- sono denominati acidi grassi perché fanno parte del grasso.
La lunga catena è la parte idrofoba mentre il gruppo carbossilico sulla testa della molecola è la parte polare (idrofila):
- ciò è da attribuire alla nube elettronica che si forma in prossimità dell’ossigeno e la rarefazione degli elettroni in prossimità di carbonio ed idrogeno
Gli acidi grassi si suddividono in:- saturi: che possiedono solo legami –C – C - singoli - insaturi: che possiedono almeno un doppio legame
carbonio-carbonio sulla coda apolare.
La particolarità dei grassi insaturi è quella di possedere un doppio legame planare in prossimità del quale la molecola compie una curva:
- ciò permette l’affievolimento delle interazioni idrofobe nelle membrane biologiche, quindi la maggiore fluidità delle stesse.
I terpeni costituiscono la principale componente degli oli essenziali.
Le vitamine liposolubili (A, D, E, K) sono derivati dall’unione di più residui dell’isoprene.
Il colesterolo, formato da quattro anelli carbonici con 17 atomi di carbonio è un derivato degli steroli:
- le funzioni biologiche di questi composti è particolare- il colesterolo all’interno delle membrane cellulari ne limita
la fluidità- i suoi derivati sono anche gli ormoni steroidei.
Lipidi semplici
Gran parte dei lipidi semplici deriva dall’esterificazione di acidi grassi con alcoli:
- con gli alcoli monovalenti si ottengono le cere- con il glicerolo (alcol trivalente) si ottengono i gliceridi- con gli steroli (es. colesterolo) si ottengono gli esteri degli
steroli.
I gliceridi sono la classe principale dei lipidi semplici e si suddividono in base al numero di funzioni alcoliche esterificate:
- monogliceridi- digliceridi- trigliceridi
I trigliceridi rivestono una importante funzione biologica:- deposito energetico- isolamento termico
Lipidi complessi
Sono lipidi complessi quei lipidi caratterizzati dalla presenza di residui idrofili. Hanno dunque un carattere anfipatico (zone polari e zone apolari nella stessa molecola).
L’anfipaticità dei lipidi complessi trova ampie rappresentazioni a livello biologico:
- sono molecole in grado id interagire sia con mezzi acquosi che con mezzi idrofobi
Si distinguono in:- fosfolipidi: una delle funzioni alcoliche viene esterificata
con acido fosforico- glicolipidi: grassi complessati con monosaccaridi e
oligosaccaridi
nonostante le diversità strutturali, i grassi sono comunque composti da una testa polare e delle code apolari idrofobe:
- in acqua queste molecole tendono a disporsi circolarmente con le code idrofobe all’interno formando le micelle, che sono un efficace meccanismo di trasporto nelle membrane
d. proteine
Una proteina è un polimero i cui monomeri sono costituiti da amminoacidi.
Le funzioni delle proteine sono svariate:- enzimi- trasporto- recettori- ecc…
Gli amminoacidi sono solo una ventina ma possono combinarsi in modo infinitamente diverso:
- una proteina comprende da poche decine a qualche migliaia di amminoacidi
Le proteine si distinguono in:- semplici: costituite di soli aminoacidi- complesse: che comprendono anche un gruppo
prostetico, che possiede molecole di natura diversa.
I gruppi prostetici possono essere:- ioni metallici- vitamine- oligosaccaridi (glicoproteine)
amminoacidi
Sono i costituenti delle proteine. È una molecola asimmetrica formata da un atomo di carbonio a cui sono legati:
- idrogeno- gruppo carbossilico- gruppo amminico- radicale (i circa 20 tipi, caratterizza l’amminoacido)
In natura è sempre presente l’isomero L, nelle proteine. Gli isomeri D sono riscontrabili solo in piccoli polipeptidi che hanno funzioni antibioticha.
Nelle cellule sono presenti in natura anche amminoacidi liberi, che formano il pool degli amminoacidi:
- derivano dalla distruzione di proteine- sono immessi con la dieta
protidi
Tutti gli amminoacidi presenti nelle proteine sono del tipo alfa:- il legame peptidico si forma tra il carbonio alfa del gruppo
carbossilico e l’azoto- i radicali si dispongono verso l’esterno e non entrano nei
legami
La disposizione, la sequenza e la presenza delle cariche nei gruppi dei vari amminoacidi determinano la struttura di una proteina (disposizione spaziale e struttura secondaria).
La struttura delle proteine
La struttura di una proteina e la sua organizzazione conferiscono ad essa la specificità:
1. struttura primaria: sequenza degli amminoacidi2. secondaria: ad alfa-elica o a foglietto-beta. Data dai vari legami
con ponti idrogeno tra gli amminoacidi.3. Terziaria: globulare, orientamento spaziale. Dipende dai legami
di solfuro (legami forti) o dalle interazioni deboli dei gruppi amminoacidici.
4. Quaternaria: la composizione di più subunità proteiche. Queste sono unite ordinariamente da legami deboli (ponti idrogeno) e saltuariamente da ponti – S – S – .
Enzimi e metabolismo cellulare
Gli enzimi sono dei catalizzatori biologici, che hanno ovvero il compito di favorire l’attivazione e lo svolgimento di una reazione con minore energia.
Questi hanno una grossa componente proteica: - presentano gruppi prostetici detti coenzimi (ioni metallici,
glucidi, ecc..) che sono spesso locati in presenza de sito attivo.
Un enzima è caratterizzato da un sito attivo specifico per un solo legame da scindere o da formare, che si lega ad uno specifico substrato.
Tuttavia, possono esservi più enzimi che svolgono la medesima funzione.
La velocità di catalizzazione di un enzima dipende da tre fattori principali:
- specificità- temperatura- pH
La specificità per un determinato substrato è data soprattutto da:- specifici gruppi prostetici- struttura proteica dell’enzima
e. acidi nucleici
Gli acidi nucleici sono le molecole più grosse e più interessanti degli organismi viventi:
- contengono tutte le informazioni necessarie per lo sviluppo e la sopravvivenza di un organismo
- codificano per le proteine
Gli acidi nucleici sono detti polinucleotidi perché format da sequenze di nucleotidi semplici, composti da:
- zucchero pentoso- base azotata
- radicale fosforico
Questi possono essere di due tipi:- DNA (acido nucleico)- RNA (acido ribonucleico)
Le basi azotate appartengono a due classi:- pirimidine: timida (T), citosina (C), uracile (U)- puriniche: adenina (A), guanina (G).
Nel DNA si trovano:- adenina-timina- citosina-guanina
Nell’RNA:- adenina-uracile- citosina-guanina
I due polinucleotidi si differenziano perché:- nel DNA si trova il desossiribosio, mentre nell’RNA il
ribosio- Nell’Rna l’uracile sostituisce la timida- Il DNA ha una struttura a filamento doppio che si avvolge
a doppia elica grazie a ponti idrogeno, mentre l’RNA è sempre a filamento singolo
L’unione tra due nucleotidi avviene sempre per mezzo di legami fosfodiesterici (si legano i gruppi OH dello zucchero e del fosfato).
Sono molecole acide, perché il radicale fosforico ha ancora un gruppo OH spendibile, che da carattere acido.
Nella cellula il DNA si trova solo nel nucleo, se si a eccezione di un singolo filamento all’interno del mitocondrio che serve ad esso per la sintesi dell’ATP.
Il Dna ha forma a doppia catena, in cui le basi azotate sono complementari. I due filamenti si avvolgono in una catena a doppia elica.
Le basi sono unite da ponti idrogeno:- la catena può essere aperta e servire da stampo per la
duplicazione, attuata ad opera di un gruppo di enzimi specifici.
- la molecola di DNA è semiconservativa.
Sintesi proteica e RNA.
La sintesi proteica vede interagire tutti i tre principali tipi di RNA:- mRNA (messagero) entra nel nucleo e trascrive un
gene, poi esce nel citoplasma e si inserisce tra le due subunità dei mitocondri (organuli piccolissimi presenti in enormi quantità nel citoplasma)
- tRNA(transfer): questo è una molecola altamente specifica, con la forma caratteristica a trifoglio. Dal gambo più lungo trasporta uno specifico amminoacido, che è codificato dall’anticodone posto su uno dei lembi del trifoglio. L’anticodone si lega all’mRNA in prossimità del mitocondrio e tramite enzimi vengono sintetizzate le proteine
- rRNA(ribosomial): è l’RNA presente nei mitocondri.
È importante sottolineare che nei mitocondri vi sono due siti (A e P) in cui possono essere presenti due amminoacidi. Quando si trovano in quei siti, sono uniti tra loro.
Sul DNA (quindi sull’RNA) non sono solo presenti le triplette che codificano gli amminoacidi, ma anche altre informazioni:
- codoni di stop- codoni di avvio- di riconoscimento- ecc…
un codone è una tripletta di basi azotate che sintetizza un amminoacido.
4. Introduzione alla citologia
a. la membrana plasmatica
La membrana plasmatica è un sottile involucro che separa la cellula dall’esterno.
Ha anche una funzione regolatrice:- regola la composizione del citoplasma attraverso un
meccanismo di permeabilità selettiva- numerose attività della cellula (antigeniche, ormonali,
divisione cellulare, ecc..) sono strettamente connesse alla membrana plasmatica
Struttura
Con metodologie differenti si è giunti a scoprire la conformazione del plasmalemma:
- margine organizzato di spessore 7-10 nm
Secondo il modello a mosaico fluido elaborato da Singer e Nicholson la membrana plasmatica è composta da un bilayer fosfolipidico:
- due strati di fosfolipidi insaturi si fronteggiano in prossimità delle code apolari, formando legami idrofobico
- la parte polare è rivolta verso l’interno della cellula e verso l’esterno
- nel mosaico fosfolipidico sono presenti delle proteine, di natura globulare, che sono libere di muoversi.
Questa struttura è riscontrabile in tutti gli altri tipi di membrana.
Le proteine sono di due tipi:- proteine estrinseche: sono associate alla superficie
esterna della membrana plasmatica. Possono effettuare spostamenti rotatori e laterali perché sono legate alla
membrana attraverso legami polari con le teste dei fosfolipidi
- proteine intrinseche: sono immerse totalmente o in parte nel doppio strato fosfolipidico. Queste hanno natura polare all’esterno e apolare idrofobica all’interno. Quelle che attraversano lo strato fosfolipidico da parte a parte sono dette proteine transmembranali. Il movimento di queste proteine è possibile, in quanto scorrono nel mosaico fluido.
Le principali funzioni
Le principali funzioni della membrana plasmatica sono:- separare l’ambiente extracellulare da quello intracellulare- attuare scambi selettivi con l’esterno- controllare la moltiplicazione cellulare- controllare le interazioni con altre cellule e la matrice
extracellulare- modulare, trasmettere e ricevere i messaggi.
Composizione chimica
La membrana cellulare è composta essenzialmente da:- fosfolipidi (60%)- proteine (40%)- componente glucidica (glicolipidi e glicoproteine)
Le proporzioni sono essenzialmente differenti per ogni tipo di cellula, per la funzione che riveste. Possono esservi anche differenze in vari settori della cellula.
Componente lipidica
Nonostante i lipidi varino a seconda delle membrane, è abbastanza comune la struttura che li caratterizza:
- sono molecole anfipatiche (testa idrofila-polare e una coda idrofobica)
Sono costituiti da:- fosfolipidi, - glicolipidi- colesterolo
La maggioranza è rappresentata dai fosfolipidi in due categorie principali:
- glcerofosfolipidi: esteri del glicerolo (acidi grassi) alla cui testa vi è un groppo fosfato legato a molecole differenti
- sfingomieline: composto dell’amminoalcol insaturo sfingosina, con un acido grasso e una testa polare di fosforilcolina.
I glicolipidi sono dei lipidi formati da acidi grassi (glicerolo esterificato con due acidi grassi o un complesso formato da sfingosina con un acido grasso) a cui sono legati delle porzioni glucidiche:
- residui monosaccaridici (cerebrosidi)- catene oligosaccaridiche (gangliosidi)
Ciò che caratterizza la componente lipidica della membrana cellulare è la caratteristica dell’anfipaticità, ovvero la duplice componente polare e apolare:
- spiega perché i fosfolipidi e nn i trigliceridi- perché il colesterolo e nn altri steroli
Questa composizione chimica permette alla membrana di essere a contatto con soluzioni acquose (matrice extracellulare e citoplasma) e di essere relativamente impermeabili all’acqua:
- il passaggio di sostanze attraverso la membrana avviene attraverso apposite proteine immerse nel mosaico lipidico.
La componente apolare instaura interazioni irofobiche (a ivello delle code):
- spessore di 7-10 nm della membrana- le code di acidi grassi insaturi permettono una maggiore
mobilità dei fosfolipidi, poiché hanno un maggiore ingombro sterico e un minor numero di interazioni
- il colesterolo limita la mobilità
Tuttavia si possono anche presentare dei grassi saturi, che ad una determinata temperatura possono diventare insaturi:
- quanto più sono sature le catene degli acidi grassi, tanto più sarà rigida la membrana plasmatica
è interessante puntualizzare che talvolta la composizione della membrana a livello lipidico dipende dal tipo di dieta:
- l’alimentazione di un individuo può cambiare nel’arco di tre mesi la componente lipidica degli eritrociti
- è probabile che ciò possa avvenire anche a livello di altre membrane
Componente carboidratica
La componente proteica all’interno della membrana è molto eterogenea e differenziata.
Vi sono proteine sempllici che possono avere funzioni differenti:- funzione strutturale- di trasporto- enzimatica
Sono presenti anche in grande quantità delle proteine complesse, che hanno soprattutto delle attività in relazione all’esterno della cellula. Sono per lo più glicoproteine:
- recettori per ormoni o fattori di crescita- espressione antigenica- attive nelle interazioni intercellulari
Le proteine del plasmalemma si possono distinguere in:- proteine periferiche o di membrana, che sono cioè
esterne o interne alla membrana plasmatica- proteine intrinseche o integrali, che sono immerse
parzialmente o totalmente (transmembrana) nel mosaico fosfolipidico
le proteine intrinseche necessitano, per essere estratte della distruzione della membrana stessa, mentre quelle periferiche possono essere separate con metodi più blandi, senza danneggiare la membrana.
Le proteine intrinseche possono cambiare il loro strato di immersione nella membrana in relazione al loro momento funzionale:
- sono globulari- una determinata sequenza amminoacidica può
determinare alcune differenti configurazioni spaziali- ogni configurazione spaziale è determinata da un certo
livello energetico- l’ambiente interagisce e riconosce solamente le parti della
proteina (alcuni amminoacidi) che sono esposti all’esterno.
Il movimento all’interno del film fosfolipidico è dato dal cambiamento conformazionale della proteine:
- ricevendo una certa energia la struttura della proteina cambia
- se espone amminoacidi maggiormente idrofobici allora si immerge nel bilayer, se ne espone di idrofili allora si dirige verso la componente polare del plasmalemma.
Un esempio di questo meccanismo è dato dalla rodopsina, che cambia la propria conformazione in funzione dell’illuminazione che riceve.
La mobilità di queste proteine è influenzato da differenti fattori:- fluidità della membrana- legami con elementi extracellulari o citoplasmatici
Nel proprio cammino, una molecola proteica può avere destini differenti:- con buona probabilità si scontrerà con un’altra proteina,
andando ad integrarsi - può cadere nel citosol o venirne inglobata- difficilmente ritorna al punto di partenza
Il movimento di una proteina è molto spesso circoscritto in un’area delimitata dalle tight junctions (giunzioni strette), particolari giunzioni cellulari.
La disposizione di alcune proteine o glicoproteine che interagiscono con il citoscheletro non è casuale:
- vi possono essere fenomeni di clustering, ovvero la disposizione di specifiche proteine in ristrette zone della membrana (es. particolari recettori)
- l’interazione con il citoscheletro potrebbe essere la causa di alcuni fenomeni del processo di differenziamento cellulare
Componente proteica
La componente saccaridica della membrana è formata in gran parte da oligosaccaridi associati a proteine (glicoproteine) o ai lipidi (glicolipidi).
Si trovano inoltre i proteoglicani di membrana:- sono costituiti da un asse proteico transmembrana al
quale sono legate catene polisaccaridiche a resitui di serina o treonina con legame O-glucosidico
le glicoproteine sono costituite da una o più catene di oligosaccaridi legate a residui di asparagina.
Le glicoproteine e gli elementi affini prendono parte a molte atività della cellula:
- riconoscimento cellulare- adesione tra cellule e alla matrice extracellulare- fusione cellulare- regolazione di crescita (recettori) e divisione della cellula
La presenza percentuale dei carboidrati è abbastanza costante in tutti i tipi di cellule, ad eccezione dei globuli rossi:
- probabilmente questi glucidi contribuiscono a creare un potenziale negativo all’esterno della cellula, in modo da impedire il coagulo (che si avvicinino e si blocchino)
Nonostante i glucidi che compongono i polisaccaridi siano soltanto sette, questi possono formare una infinità di legami e combinazioni differenti:
- contribuiscono all’alta specificità della membrana plasmatica
- aumentano le possibilità di riconoscimento di sostanze specifiche
La specificità delle glicoproteine le permette di agire come recettori peri più svariati substrati:
- ormoni proteici- virus- fattori di crescita- come antigeni di istocompatibilità
fisiologia della membrana
La membrana esercita una permeabilità selettiva, poiché è in grado di selezionare gli agenti che entrano e quelli che escono, e di essere attiva nell’attuare gli scambi con l’esterno.
Attraversano la membrana:- ioni (Ca2+, Na+, K+, Cl-, Mg2+, ecc…)- acqua- piccole molecole (glucosio, amminoacidi, glicerolo,
nucleotidi, ecc…)- prodotti del catabolismo cellulare.
1) trasporto di sostanze attraverso il plasmalemma
Il passaggio di sistanze attraverso la membrana plasmatica avviene con diverse modalità.
- Se le sostanze da immettere o espellere si dirigono secondo gradiente di concentrazione o secondo potenziale eettrico si tratta di diffusione (trasporto passivo), meccanismo tale per cui non è necesario dispendio di enrgia.
- Se le sostanze da immettere o espellere necessitano di proseguuire contro gradiente o contro potenziale si tratta di trasporto attivo, che avviene con un dispendio energetico
Per l’immissione o l’espulsione di componenti particolari quali macromolecole o particolari fluidi si hanno meccanismi quali:
- endocitosi- esocitosi
a. trasporto passivo
Il trasporto passivo tende ad eguagliare le differenze di concentrazione (o potenziale) che vi sono sui due versanti della membrana:
- avviene per diffusione ovvero il quando la sostanza disciolta si sposta per agiazione termica verso il lato meno denso di quella sostanza.
Esistono due diversi tipi di membrana rispetto ad una soluzione:- permeabile: tutte le sostanze disciolte nella membrana si
diffondono dall’altra parte secondo gradiente- semipermeabile: solamente le sostanze del solvente
eguagliano le molecole che sono presenti dall’altro lato della membrana (osmosi)
Per alcune sostanze la membrana plasmatica si comporta come semipermeabile, ma va ben oltre:
- solo alcune delle sostanze disciolte possono permeare attraverso la membrana assieme al solvente
- queste immissioni ed espulsioni sono regolate da sistemi proteici
Secondo gradiente possono entrare:- gas disciolti- acqua (attraverso i pori acquosi)- piccole molecole lipidiche - ormoni steroidei (passano tranquillamente perché nn
sono carichi)
La membrana non è permeabile a:- molecole polari (glucosio, nucleotidi, ecc…)- ioni perché sono carichi(Na+, Cl-, K+, Mg2+, ecc)
b. diffusione facilitata
La diffusione facilitata è un mecanismo che si avvale di speifiche proteine per attuare scambi allinterno della cellula:
- avviene sempre per gradiente di concentrazione- aumenta la velocità maggiore è la concentrazione del
soluto nel mezzo esterno- ad un certo punto giunge ad un livello di saturazione, al
quale le proteine chiudono i propri passaggi
Le proteine che svolgono il lavoro di diffusione facilitata sono altamente specifiche per il substrato che devono accoliere:
- quando la concentrazione di substrato giunge a livello di saturazione, queste smettono di funzionare.
Vi sono due tipi di proteine che attuano la diffusione facilitata (dette carrier):
- Proteine canale- Proteine vettrici
Vengono trasportate all’interno da specifiche proteine di membrana quelle sostanze che non si immetterebbero nella membrana per dimensioni o per carica.
Le proteine canale trasportano per lo più ioni:- ogni canale è altamente specific per uno ione- hanno una cavità polare che permette agli ioni di passare
attraverso il bilayer fosfolipidico di natura idrofila- gli ioni nn si devono legare alla proteina (alta velocità ed
efficienza)
Normalmente questi canali sono chiusi. Si aprono solo in relazione a precisi stimoli:
- controllo di ligando : legame di specifiche molecole a recettori di membrana
- controllo di voltaggio : variazione di ddp- controllo meccanico : si aprono in risposta a precisi stimoli
meccanici
Le proteine vetrici invece assicurano il passaggio di molecole di dimensioni maggiori di natura polare, quali zuccheri, amminoacidi, nucleotidi, ecc..
Quando il substrato si lega alla proteina specifica, questa assume una modifica della propria conformazione, in modo da rilasciare la molecola dall’altra parte della membrana, sempre secondo gradiente di concentrazione.
c. trasporto attivo
Le proteine carrier che attuano il trasporto attivo sono sempre dirette contro gradiente:
- necessitano di energia metabolica (molto spesso sotto forma di ATP)
Queste sono proteine transmembrana, che si presentano sotto forma di poro, che normalmente è chiuso:
- quando il substrato si lega al sito di legame e la proteina è stata energizzata mediante ATP il poro si apre
- la proteina cambia la propria conformazione spaziale e forza il passaggio dello ione o della molecola all’interno del citosol
Le principali proteine carrier sono:1) la pompa sodio-potassio: espelle 2 Na+ e ingloba 3 K+. Questo
sito possiede in sé un’attività enzimatica in grado di idrolizzare l’ATP, ed è quind un complesso ATPasi
2) pompa calcio: mantiene la concentrazione del calcio nel citoplasma bassa
3) pompe protoniche: trasportano gli ioni H+ contro gradiente
Quete pompe ioniche, in cui l’energia è spesa in situ sono dette di trasporto attivo primario.
Esistono anche dei sistemi di trasporto attivo secondario, in cui l’ATP viene idrolizzata per fonire energia prima del trasporto:
- esempio delle cellule dell’intestino per il trasporto degli zuccheri. L’energia serve per greare un gradiente di ioni Na+ esterno alla cellula, che poi rientreranno secondo gradiente
- l’energia potenziale del gradiente di ioni Na+ sarà utile a trasportare le molecole glucidiche insieme allo ione con un sistema di cotrasporto.
Una proteina puòavere siti di legame per più molecole:- sinporto: trasporto simultaneo di due o più molecole nella
stessa direzione- antiporto: trasporto simultaneo di due molecole in
direzione opposta (una entra l’altra esce)- uniporto: trasporto di un solo tipo di molecole
I sistemi di sinporto e antiporto sono deti di cotrasporto.
Possono esservi questi tipi di trasporto specifici in determinae zone de citoplasma:
- nei microvilli intestinali la pompa Na/glucosio è presente solo nella zona prospciente il lume, mentre in zone più interne sono presenti sisetmi di trasporto attivo
2) potenziale di membrana
La differente composizione ionica ai due lati della membrana permtte alla cellula di svolgere varie attività funzionali:
- pilotare determinati processi di trasporto- conduzione e trasmissione dell’impulso nelle cellule
nervose
La principale differenza a livello di carica è data dalla maggiore presenza di piccoli cationi all’interno della cellula.
Questo fatto è dovuto alla presenza di cellule non diffusibili all’interno della cellula, ad esempio le proteine, che si dissociano in anioni:
- per bilanciare le cariche anioniche entra il potassio, che si trova in maggior concentrazione nel citoplasma
L’unica eccezione è fatta dal sodio:- ha una concentrazione simile a quella del Cl-, che non
viene immesso nel citplasma, vista la presenza di polianioni
- la concentrazione è mantenuta stabile dalle pompe attive sodio-potassio e altre
Sono presenti vari canali di fuga sempre aperti per il K+, che esce senza bisogno di ATP:
- il meccanismo si arresta quando la concentrazione di ioni K+ è identica da entrambi i lati
- si determina un potenziale di -75 mV, detto potenziale di membrana
3) trasduzione del segnale
Anche nel caso di organismi semplici, le cellule sono in grado di riconoscersi tra loro, anche se non hanno la facoltà di legarsi.
Sono due e famiglie di molecole che supportano questo tipo di attività non giunzionale (riconoscimento):
- proteine CAM: proteine di membrana strutturalmente simili alle immunoglobuline
- caderine: gruppo di molecole calcio-dipendenti
Il segnale può diffondersi in diversi modi, su diverse scale:- segnale a lungo raggio( endocrino ): comunicazione
attraverso ormoni segnale che passano nel sangue- paracrina: il ligando passa tra le cellule senza necessità
di entrare nel flusso circolatorio- autocrina: la cellua produce sostanze che riconosce egli
stessa
Per le ricezioni che devono raggiungere lo spazio cellulare vi è la necessità che il sito di ricezione abbia all’interno della cellula un trasduttore che comunichi in zona citoplasmatica il segnale:
- vi sono i cosiddetti metodi di trasduzione
I ligandi di natura proteica necessitano dei metodi di trasduzione del segnale, poiché non attraversano le membrane.
I ligandi liposolubili (ormoni di tipo steroideo) passano direttamente la membrana:
- non necessitano di meccanismi di trasduzione del segnale
4) tipi di segnale
I tipi di segnale tradotto all’interno della cellula sono differenti.
1) inversione di potenziale
Il recettore è una proteina canale normalmente chiusa.
Quando il ligando si lega al recettore, la proteina-canale si apre e determina l’immisione di ioni che determinano una variazione di potenziale (da -75 a +30/110 mV) che induce determinati meccanismi cellulari.
È il caso di neurotrasmettitori come l’acetilcolina che aprono i canali di Na+.
2) proteine chinasiche
Il ligando, legandosi al recettore, determina l’attivazione di un complesso enzimatico di tipo chinasico.
Il complesso enzimatico può indurre egli stesso l’attivazione di 8-10 proteine di tipo chinasico.
3) proteina-G
L’attivazione di proteine-G, una volta formato il complesso ligando/recettore, può stimolare l’attivazione (solitamente con dispendio energetico) di atre molecole dette secondi messaggeri, che andranno poi ad attivare la riposta cellulare.
È da tenere in considerazione che un singolo segnale a lungo raggio può stimolare in un organismo una differente risposta in tessuti differenti:
- l’adrenalina stimola sia vasocostrizione che la dilatazione dei bronchi.
4) fosforilazione
Può anche darsi che la riposta cellulare sia dovuta alla fosforilazione di una proteina legata al recettore:
- viene attivata la coda della proteina transmembrana che idrolizza un fosfolipidi di membrana (fosfolipasi C) che innesca la produzione di altri enzimi proteici e altri tipi di risposte
Glicocalice
Le cellule animali non presentano un rivestimento rigido all’esterno della membrana plasmatica:
- coltre morbida e flessibile detta glicocalice, con proprietà adesive
- ha spessore variabile e aspetto lanuginoso
Gran parte delle interazioni tra cellule sono mediate da questo mantello, in cui sono distribuite in maniera ordinata una serie i molecole che svolgono importanti attività funzionali:
- riconoscimento dei ligandi extrscellulari- riconoscimento del “sé” e “non sé” da parte della cellula- mutua adesione tra cellule
- controllo della proliferazione cellulare
Il glicocalice è costituito prevalentemente da un rivestimento glicoproteico, che è riscontrabile immediatamente all’esterno della membrana, con la quale opera delle interazioni molto strette.
Il glicocalice è strettamente connesso alla membrana, mediante alcune porzioni glucidiche che sono legate alla struttura del plasmalemma, ma anche con materiale della matrice extracellulare.
È composto da:
- oligosaccaridi dei glicolipidi- oligosaccaridi delle glicoproteine- catene saccaridiche dei proteoglicani di membrana
le funzioni
1) protettiva
Le strutture carboidratiche sono associate al citoscheletro, con cui interagiscono strettamente.
Il glicocalice svolge la propria funzione protettiva in due modalità:- filtro/barriera , protegge dagli agenti esterni e seleziona
quelli che possono immettersi- carica elettrica negativa all’esterno: ad esempio per gli
eritrociti, viene mantenuta una carica negativa in modo che questi si respingano, impedendo il coagulo.
2) di assorbimento
Il glicocalice aiuta a fare da filtro per le sostanze che devono essere assorbite:
- nell’intestino le porzioni glucidiche aiutano i microvilli ad assorbire sostanze
3) adesione
è una funzione calcio-dipedente in alcuni casi.
Il glicocalice si lega ad altre cellule o alla matrice extracellulare in vari modi che si vedranno in seguito.
4) Recettoriale
Sono presenti nel glicocalice specifici recettori per ogni tipo di cellula o molecola.
Ad esempio, l’epitelio della vescicola urinaria ha un glicocalice particolarmente sviluppato, poiché non può fare passare l’urina.
5) sistemi di adesione intracellulare
La membrana plasmatica presenta notevoli tipi di specializzazione:- gli epiteli di rivestimento possono avere diversi sistemi a
livello della membrana laterale, apicale o basale
Queste specializzazioni possono essere:- sistemi di giunzione tra le cellule- specializzazioni della superficie libera- specializzazioni della superficie basale delle cellule
Le cellule si organizzano morfologicamente a formare i tessuti, i quali si organizzano a loro volta in organi.
I tessuti sono costituiti da:- cellule - materiale interposto tra le cellule (matrice intracellulare),
secreto ed elaborato dalle cellule stesse.
Differenti tipi di tessuto sono caratterizzati da una differente quantità di cellule o matrice intracellulare.
Nel costituire tessuti compatti le cellule si posizionano in rapporti stretti ma non intaccano mai la loro individualità.
Si posizionano ad una distanza circa di 10-20 nm tra di loro.
Dopo anni di ricerche, con l’avvento del microscopio elettronico si è scoperto che le cellule sono specializzate nell’operare sistemi di giunzione tra loro o tra la matrice extracellulare.
Nelle cellule epiteliali, nello spazio intracellulare (10-20 nm), si trova materiale di natura glicoproteica che per aderire necessita di ioni calcio:
- sotto una determinata concentrazione di questi ioni, le cellule tendono a dissociarsi
Nello spazio tra le cellule circolano i liquidi interstiziali e il sangue proveniente dai capillari, che permettono lo scambio di:
- gas, - metaboliti
Le giunzioni cellulari vengono classificate secondo criteri funzionali in tre tipi principali:
- giunzioni occludenti: sono talmente unite da sigillare lo spazio in modo completo o quasi
- giunzioni aderenti (ancorate): realizzano la salda adesione tra le cellule
- giunzioni comunicanti: consentono il passaggio di piccole molecole da una cellula ad un’altra
Bisogna precisare la differenza tra zonula e macula:- zonula: si estendono su tutto il perimetro cellulare come
una cintura- macula: è limitata ad una piccola regione circoscritta
(placca)
Giunzioni occludenti- tight junctions (giunzioni strette)
Giunzioni ancoranti:- desmosomi- emidesmosomi- fasce aderenti
- placche di adesione
Sono giunzioni comunicanti le gap junctions (ginuzioni serrate).
I meccanismi di giunzione possono trovarsi isolati o raccolti in specifici complessi di giunzione, come nel caso degli epiteli.
i. giunzioni occludenti
Nella zonula occludens che si trova al di sotto della superficie libera delle cellule, le membrane sono adese una all’altra fino a chiudere completamente il passaggio.
Gli strati più esterni si fondono in più punti andando a formare delle giunzioni strette.
Nelle fasce di giunzione stretta, sono presenti anche dei punti di contatto tra le due membrane dette connessioni focali, che si organizzano in una struttura reticolare che circonda tutto il perimetro della cellula:
- si intravvede un reticolo di filamenti sigillanti.
La funzione principale di queste giunzioni è:- isolare il lume dalle cavità intracellulare e viceversa- limitare la migrazione di specifiche proteine atte
all’assorbimento e all’espulsione delle varie sostanze
Thight junctions sono ad esempio presenti:- nell’epitelio intestinale, per consentire alla struttura
microvillare di restare all’esterno- nelle cellule endoteliali, per impedire la fuoriuscita di
sostanze dal flusso sanguigno
L’aspetto di queste zone sigillanti varia a seconda del tipo di epitelio:- thight junctions: 8-10 bande lineari di connessione. Il
tessuto è impermeabile totalmente- leaky junctions: solamente 1-2 bande di connessioni
focali. La membrana è detta semipermeabile o lassa.
ii. fasce aderenti
Al di sotto della zonula occludens, vi è quella aderens, in cui le mmbrane plasmatiche delle cellule adiacenti sono separate da uno spazio di 15-20 nm:
- fasci di microfilamenti aderiscono alla faccia citoplasmatica delle due membrane adiacenti
Con il termine giunzione aderente si intende delle proteine transmembrana della famiglia delle caderine che:
- dal lato citoplasmatico sono presenti filamenti di astina legati al citoscheletro
- dal lato extracellulare sono connese con componenti esterne alla cellula o con un’altra caderina
I fasci di actina si legano alla proteina transmembrana attraverso altre proteine di attacco intracellulare (vincoline, catenine, alfa-actinina). I filamenti di actina si legano all’intreccio soprastante (verso la zona apicale) formando la trama terminale.
Queste differiscono dai desmosomi perché:- sono disposte a cintura laterale su tutta la cellula- ispessimento della membrana molto inferiore- manca una vera e propria linea densa intermedia alle
membrane plasmatiche giunte.
L’insieme di fasce occludenti e fasce aderenti forma la “terminal bar” (quadro di chiusura).
iii. Desmosomi
I desmosomi o maculae adhaerens sono tra i più complessi sistemi i giunzione intracellulare, ma anche tra i più diffusi.
Sono osservabili al microscopio elettronico, dove paiono come inspessimenti della membrana, che possono arrivare anche a 0,2 micron, con anche un micron di diametro.
L’ispessimento è dato dalla presenza di placche citoplasmatiche:- forma ellittica, - diametro di 0,3-0,7 micron- spessore di circa 10 nm
Il desmosoma è formato da:1- tonofilamenti : sono dei fasci che si legano alle placche
citoplasmatiche, che legano con materiale nel citoplasma. Sono di cheratina nelle cellule epiteliali, di altre molecole in altri tipi di cellula
2- placche di attacco: sono placche di natura proteica che hanno la funzione di fungere da aderente tra i filamenti intermedi del citocsheletro con il plasmalemma. I tipi di molecole sono desmoplachine I e II oppure delle placoglobine
3- Membrana plasmatica distanziata: nel desmosoma la membrana plasmatica è distanziata di circa 30 nm
4- Linea intermedia: materiale filamentoso di adesione di natura proteica. Sono famiglie delle caderine, quindi calciodipendenti.
Proprio in virtù della dipendenza dal calcio la cellula può inattivare il desmosoma creando una forte carenza di calcio nella zona intracellulare:
- i demorsomi infatti sono anche permeabili, a differenza delle giunzioni occludenti
La funzione principale dei desmosomi è meccanica:- senza la loro presenza anche piccole sollecitazioni le
cellule potrebbero distruggere la superficie di continuità
I desmosomi si trovano principalmente nelle cellule soggette a stress meccanico:
- cellule epiteliali della superficie esterna del corpo- superfici interne delle vie respiratorie- apparato gastro-intestinale- apparato genito-urinario
Una malattia come il pemfigo dimostra l’importanza dei desmosomi:
- una malattia che provoca la comparsa di bolle sull’epidermide e la perdita delle connessioni tra le cellule epiteliali
- è autoimmune: produce anticorpi contro differenti tipi di desmogleine
iv. emidesmosomi
Sono dispositivi di giunzione che stabiliscono l’ancoraggio con la superficie basale della cellula e la lamina basale (o membrana basale).
Appaiono morfologicamente come una delle metà simmetriche di un desmosoma, ma presentano rilevanti differenze:
- anche se nel versante citoplasmatico le particolari proteine si legano ad elementi del citoscheletro, nel versante extracellulare, i filamenti si legano a molecole della membrana basale;
- le proteine transmembrana ce svolgono questa funzione sono le integrine, che per la loro natura glicoproteica si legano a specifici recettori presenti in molecole della matrice quali laminina, fibronectina, collagene.
- La porzione citoplasmatica dell’integrina si lega direttamente con porzioni di citosceletro intermedio.
- I filamenti citoplasmatici del citoscheletro interagiscono direttamente con una placca tipo desmoplachine.
v. placche di adesione
Le placche di adesione sono specifiche regioni specializzate per l’adesione modulabile (attacco/sgancio) alla matrice extracellulare, particolarmente studiate nei fibroblasti in coltura.
Sono molecole stellate, che modificano temporaneamente la propria forma citoplasmatica emanando delle estensioni dette pseudopodi che si legano al substrato sottostante mediante placche di adesione (o contatti focali, o adesioni focali).
La loro locomozione dipende proprio da questo tipo di giunzioni.
In tali zone, sembra che nel citoplasma vi siano delle emanazioni di filamenti di actina che si legano al substrato extracellulare:
- in questi punti vi è un complesso proteico che è la vera e propria pacca di adesione
La placca di adesione è particolarmente complessa, poiché i filamenti di actina non si legano direttamente ad una proteina transmembrna della famiglia delle integrine:
- i filamenti di actina vengono riuniti grazie ad una proteina capace di creare ponti tra differenti filamenti, l’actina.
- I filamenti di actina si legano a proteine tipo tensina o HA1.
- Questa si lega ad una specifica proteina “ponte”, la vincolina, che lega la talina
- la talina è in grado di legare una proteina filiforme della famiglia delle integrine, che è la vera proteina transmembrana che si lega al substrato
- la proteina di legame (integrina) si lega a specifiche proteine fibrose della matrice extracellulare quali collagene, fironectina o laminina.
Strutture come queste sono anche i podosomi, presenti negli osteocasti in zone del plasmalemma in cui questi aderiscono al tessuto oseo da distruggere.
vi. giunzioni serrate
Le cellule orgnizzate in tessuti, si dimostrano strettamente interconnesse e comunicanti:
- se una cellula viene disgiunta cessa il poprio processo di replicazione e in parte anche la sintesi proteica.
Si è osservato al microscopio elettronico un’area della membrana in cui le cellule sono strettamente adiacenti (2-4 nm) di diversa conformazione rispetto al bilayer fosfolipidico:
- si ipotizza una macchia proteica che facilita la diffusione di ioni e piccole molecole tra le membrane di due cellule
- queste sono le giunzioni serate o gap junctions
Le proteine globulari che formano i canali sono molto ravvicinate tra di loro e immerse nella membrana fosfolipidica. Hanno un diametro di circa 7-8 nm, mentre il canal che formano è di circa 1,5 nm.
Sono di forma esagonali, e la struttura prevede:- formate da subunità proteiche (connessine) che formano
connessioni che collegano una cellula all’altra mediante un canale
- Entrambe le cellule adiacenti possiedono la porzione costitutiva (connessone) del canale, che si incastra perfettamente a livello delle subunità proteiche.
- Nel canale possono passare ioni o piccole molecole (max 1000 dalton).
Ogni tessuto elabora il proprio tipo di connessina:- può essere molto diversa in tessuti differenti- è molto simile in tessuti omologhi di differenti animali con
differente stadio evolutivo
Le ginzioni serrate non sono strutture stabili:- vengono costruite in relazione all’esigenza delle cellule di
comunicare tra loro
Le giunzioni serrate hanno un aminore resistenza elettrica rispetto alla membrana:
- permettono il passaggio di ioni- si trovano con maggior frequenza nelle cellule eccitabili
(nervose, pericardio, muscolatura liscia)
Queste gap junctions non sono permanentemente aperte:- possono aprirsi e chiudersi con una alta rapidità- l’apertura dei canali rimane fino a che non vi è una alta
concentrazione di ioni Ca++.
- Sono sensibili anche alle variazioni di pH mediante la concentrazione di ioni H+
Dal punto di vista funzionale:- trasporto dell’impulso elettrico da una cellula all’altra
(tessuti muscolari lisci e miocardio, cellule nervose, ecc..)- Regolazione della crescita e del differenziamento
cellulare- Regolazione della proliferazione- Tengono l’uniformità degli eletrtoliti nelle varie cellule.
b. Citoplasma
i. Sistema membranoso interno
È un sistema costituito da membrane formate da:- tubuli- cisterne - vescicole
I principali costituenti sono:- reticolo endoplasmatico (liscio o rugoso)- apparato di Golgi- lisosomi
Tutte queste membrane e sistemi di cisterne non hano funzione protettiva, ma funzionale:
- nei reticoli endoplasmatico avviene la sintesi di proteine o glucidi o lipidi e contengono parecchi enzimi
- nel Golgi si ha lo smistamento e la parte final della sintesi di metaboliti
- nei lisosomi avviene la produzione di materiali di scarto.
1. Ribosomi
I ribosomi sono piccoli organuli presenti nel citoplasma (15-30 nm), con un carattere spiccatamente basofilo , poiché la loro composizione è prevalentemente di natura ribonucleica (rRNA, acido).
Nel citoplasma possono trovarsi liberi o adesi al reticolo endoplasmatico (rugoso):
- la loro adesione, nelle cellule eucariotiche, dipende dal tipo di proteina da sintetizzare, quindi dalla sequenza portata dall’mRNA
- quando sono attivi, si raggruppano in cumuli detti poliribosomi, che leggono lo stesso filamento di mRNA.
Si nota che:- nelle cellule embrionali prevalgono i poliribosomi liberi- in quelle specializzate prevalgono quelli adesi al reticolo
endoplasmatico rugoso
Sono dei piccoli corpuscoli formati da due subunità (minore e maggiore), che prendono parte alla sintesi proteica, e interagiscono con:
- amminoacidi- mRNA- tRNA
Vi sono sostanzialmente due classi di ribosomi:- 70 S: formati da due subunità da 30 S e 50 S, presenti
nei procarioti- 80 S: formati da due subunità da 60 S e 40 S, presenti
per lo più negli eucarioti
Nelle cellule eucariote, i ribosomi 80S sintetizzano tipi di proteine differenti a seconda della loro posizione:
- liberi: sintetizzano proteine destinate a restare nel citosol- adesi al RER: sintetizzano per lo più proteine destinare
ad essere secrete o proteine integrali di membrana
I ribosomi sono sensibili ad agenti chimici che bloccano le attività sintetiche:- per le cellule eucariote (ribosomi 80 S) l’inattivatore è la cicloesimide.
Swedemberg (S): unità di superficie esposta di una molecola o elemento biologico
La sintesi dei ribosomi nelle cellule eucariotiche avviene a livello del nucleolo, ma senza entrare in contatto con il DNA (differentemente dai procarioti).
Funzioni
I ribosomi assicurano le corrette interazioni e le disposizioni di tutte le molecole che intervengono nel processo di sintesi proteica.
Diventano unità attive quando sono ribosomi liberi (citosol):- un mRNA si lega alla subunità minore- a questo punto si lega anche la subunità maggiore- inizia la sintesi della proteina- tra i primi amminoacidi sintetizzati vi sono degli specifici
amminoacidi (asparagina) che dicono se sia il caso legarsi o meno al RER.
- Quando il ribosoma legge un codone di stop sull’mRNA la proteina si slega dal ribosoma, il quale torna a dissociarsi.
2. Reticolo endoplasmatico rugoso
Il reticolo endoplasmatico rugoso è composto da cisterne appiattite e parallele delimitate da una membrana citoplasmatica, che divide la composizione chimica tra il lume ed il citosol.
Sulla faccia ialoplasmatica della membrana aderiscono i ribosomi, che caratterizzano il reticolo endoplasmatico liscio per 2 motivi:
- lo fanno apparire rugoso- lo colorano come una sostanza fortemente basofilo in
presenza di coloranti acido-base
Nei poliribosomi liberi sono sintetizzate le proteine destinate a:- citosol- citoscheletro- organuli (mitocondri e perossisomi)- nucleo
Nel RER, invece, sono sintetizzate le proteine che penetrano nel lume del reticolo endoplasmatico:
- alcune rimangono nella membrana del RER- sono in generale destinate ad essere secrete e finiscono
nel Golgi- nei lisosomi- nella membrana plasmatica
Dal RER si distaccano delle vescicole che sono destinate all’apparato di Golgi, ed all’interno di questo, riversano i proprio contenuto.
All’interno del reticolo endoplasmatico sono presenti moltissimi enzimi che catalizzano le reazioni di sintesi proteica (RER), lipidica e glucidica (REL).
Tra le maggiori cellule che sintetizzano proteine da secernere (con ReR molto sviluppato) vi sono:
- eritroblasto: sss- leucocita eusinofilo: ha una funzione antiparassitaria e
antiallergenica. Il suo RER produce proteine enzimatiche che secerne sotto forma di vescicole
- plasmacellula: secerne anticorpi. Ha delle cisterne molto sviluppate
- cellula acinosa (es pancreas): è presente nelle vescicole e nelle ghiandole di secrezione.
a. Sintesi proteica
La sintesi proteica è attuata principalmente dai ribosomi, che si trovano inizialmente liberi nel citoplasma.
L’associazione al RER avviene in questo ordine:1) Il ribosoma si lega alla molecola di mRNA e ne decodifica la
prima sequenza amminoacidica, detta sequenza segnale2) La leader sequence è riconosciuta da proteine specifiche sparse
nel citoplasma, le SRP (SIgnal recognition particle), che si
legano alla leader sequence inattivando la sintesi degli amminoacidi
3) L’SRP si dirige verso il proprio recettore sul reticolo endoplasmatico, un recettore dipendente dalla GTP formato da due subunità
4) La sintesi proteica riprende quando l’SRP viene rilasciato, immettendo la proteina all’interno della cisterna del reticolo endoplasmatico, grazie alla liposolubilità del gruppo amminico
5) Il ribosoma rimane ancorato alla membrana grazie ad una specifica proteina cava, detta traslocone (famiglia delle riboforine), in cui viene immessa la sequenza amminoacidica sintetizzata
6) All’arrivo del segnale di STOP la sintesi si interrompe ed il ribosoma viene rilasciato
7) una peptidasi (enzima) taglia la leader sequence, la quale rimane legata all’interno della membrana, per poi essere rilasciata nel lume del RER.
La SRP è un grosso complesso proteico formato da:- 6 proteine organizzate intorno ad una molecola di RNA,
che ha sostanzialmente funzione strutturale- il complesso ha superficie pari a 7 Svedenberg- possiede un sito GTPasi
Per quanto riguarda le proteine destinate a rimanere nella membrana del RER il procedimento differisce in parte:
1) Alcune, con il gruppo - NH2 nel lume e il –COOH nel citosol possiedono una sequenza di stop che le fa rimanere legate alla membrana, in modo che all’interno si formi una a-elica senza impedire il completamento della sintesi
2) Altre volte la sequenza segnale non è all’inizio della catena, ma in un punto centrale. Viene riconosciuta e legata dal traslocane, che la immette nel canale dove sta passando anche la parte ancora sintetizzantesi. La leader sequence non vine scissa dalla peptidasi e può rimanere all’interno della membrana del RER.
Le sequenze amminoacidiche libere e il numero delle volte che la proteina attraversa la membrana durante la sintesi determinano poi la configurazione spaziale.
In base alla disposizione dei gruppi e della sequenza si classificano le proteine transmembrana del reticolo in:
- tipo 1: All’interno il gruppo carbossilico e all’esterno quello amminico
- tipo 2: all’esterno il carbossilico e all’interno quello amminico
- tipo 3: la membrana viene tagliata più volte
All’interno del lume del RER sono attive particolari proteine:- proteine BIP: impediscono che i residui amminoacidica di
proteine differenti interagiscano tra loro- isomerasi ponti disolfuro: Servono per stabilizzare la
proteina, ovvero scindono i legami S – S quando la proteia non assume la conformazione corretta.
LA GLICOSILAZIONE DELLE PROTEINE NEL RER.
Il processo di glicosilazione generico può essere così sintetizzato:1) nella membrana del reticolo endoplasmatico sono presenti
dei glicolipidi (dolicolo) la cui catena oligosaccaridica di 14 zuccheri è nel lume
2) il dolicolo funge da donatore della catena oligosaccaridica alla proteina.
3) La catena oligosaccaridica viene legata a amminoacidi di asparagina che sono circondati da una determinata sequenza
4) Il processo avviene ad opera di un enzima detto glicosiltransferasi
5) Poiché l’oigosaccaride si lega ai gruppi –NH2 dell’asparagina è detta glicosilazione N-linked.
L’oligosaccaride contenuto nel dolicolo è formato da 14 zuccheri di cui:- 2 N-acetilglucosammina
- 9 di mannosio- 3 di glucosio
La glicosilazione N-linked non è l’unica possibile. Vi sono anche zuccheri O-linked, che si legano alla serina e alla treonina.
Le porzioni glucidiche delle glicoproteine vengono poi rielaborate:- nel RER si eliminano 3 glucosio e 1 mannosio- nell’apparato di Golgi viene poi rielaborata l’intera catena
Il trasporto delle proteine avviene per mezzo di vescicole transfer, delle vescicole che si vengono a formare in un preciso luogo della membrana del RER, detta zona di transizione:
- nella parete delle VT sono trasportate le proteine di membrana,
- nel lume della VT si trovano le proteine solubili
In definitiva, nel RER vi possono essere le seguenti modifiche post traduzionali:
- glicosilazione delle proteine- modifiche covalenti a carico di amminoacidi:
idrossilazione di prolina e lisina (formazione di idrossiprolina e idrossilisina)
- formazione di ponti disolfuro a livello della cisteina
3. Reticolo endoplasmatico liscio
Il REL è molto differente dal RER per struttura, composizione chimica e funzione:
- struttura di tubuli rivestita da una membrana- privo di rRNA (senza ribosomi) presenta carattere
acidofilo
Il Reticolo Endoplasmatico Liscio ha un differente sviluppo a seconda del tipo di cellula in cui risiede.È abbondante per la produzione di ormoni steroidei, formando una struttura a rete di tubuli anastomizzati nelle cellule:
- ghiandola surrenale
- cellule del corpo luteo dell’ovaio- interstiziali di Leyding nel testicolo
Negli epatociti l’abbondante REL è associato alle riserve di glicogeno:- può utilizzare tali depositi per immettere glucosio nel
flusso sanguigno- la glucosio-6-fosfatasi del REL occupa un ruolo
importante in questo processo
Nelle cellule del tessuto muscolare formano una struttura precisa con le miofibrille: il reticolo sarcoplasmatico:
- particolarmente specializzato nel sequestrare ioni Ca2+, essenziali per la regolazione dell’attività contrattile
Lo sviluppo del REL può essere influenzato da particolari stimolatori chimici, con processi solitamente reversibili.
Funzioni
1) sintesi dei fosfolipidi
la sintesi dei fosfolipidi non avviene all’interno del lume del reticolo endoplasmatico, ma avviene sul versante citosolico.
Gli enzimi necessari alla sintesi dei lipidi sono situati sulla membrana del reticolo endoplasmatico, con i siti attivi sulla faccia esterna.
I vari fosfolipidi sono poi trasportati alle altre membrane della cellula attraverso delle particolari proteine di trasporto fosfolipidi.
Il principale fosfolipidi è la fosfatidil-colina.
2) sintesi dei lipidi complessi
Nelle cisterne del REL sono presenti numerosi enzmi che catalizzano le reazioni di produzione di:
- lipidi complessi- ormoni steroidei
Gli ormoni steroidei vengono sintetizzati insieme ai mitocondri:- la sintesi comincia con gli enzimi presenti nel REL- continua nelle membrane del mitocondrio- termina a seconda dell’ormone necessario o nel REL o
nel mitocondrio. Ciò dipende dalla presenza di enzimi differenti
Nelle cellule epatiche vengono prodotte nel reticolo endoplasmatico liscio le lipoproteine.
3) Detossificazione
Nel REL possono essere presenti numerosi enzimi che inattivano le sostanze tossiche, che poi verranno espulse.
Molto spesso elimina le sostanze lipofile mediante ossidrilazione.
4) metabolismo del glicogeno
Nel REL sono presenti numerosi enzimi che consentono il metabolismo del glicogeno.
Nelle cellule del pancreas, in risposta all’attivazione di particolari ormoni si attuano glicogenosintesi o glicogenolisi:
- insulina: stimola la glicogenosintesi a partire da glucosio-6-fosfato
- glucagone: stimola la glicogenolisi.
5) Controllo di ioni Mg e Ca
Nel reticolo sarcoplasmatico, le cisterne del REL fungono da regolatori degli ioni Mg e Ca, che sono indispensabili alla contrazione muscolare.
4. Apparato di Golgi
Osservato al microscopio ottico dopo una colorazione con sali d’argento si nota una precipitazione a livello cellulare dell’argento in prossimità di un apparato reticolare di tubuli e vescicole anastomizzate e strette tra loro.
Solitamente questo apparato si situa nel centro cellulare, in prossimità del nucleo e adiacente al reticolo endoplasmatico, tuttavia in alcune cellule dotate di polarità morfo-funzionale (ad esempio le cellule secretorie) occupa una posizione ben precisa (tra il nucleo e la superficie apicale).
La morfologia del complesso di Golgi prevede un numero variabile d cisterne appiattite disposte a pila una sull’altra:
- da 4 a 6 per le cellule animali, differenziato a seconda della funzione che svolge (le cellule secretorie hanno un apparato di Golgi parecchio sviluppato)
- oltre la decina nelle cellule vegetali
La posizione di questo apparato, può inoltre subire delle fluttuazioni a seconda del momento del ciclo secretorio in cui si trova.
Il complesso di golgi è la sede in cui vengono convogliati e rielaborati i materiali sintetizzati nel RER e nel REL, inoltre attua specifiche attività di sintesi di polisaccaridi e lipidi complessi.
Tutte le funzioni e la struttura dell’apparato di Golgi sono sotto il controllo diretto del nucleo:
- in corso di digiuno o di un inibitore della trascrizione le funzioni del Golgi si riducono considerevolmente (in relazione alla sintesi proteica effettuata)
Struttura.
Sono tre i componenti osservabili dal punto di vista ultrastrutturale nell’apparato di Golgi:
- cisterne appiattite in pila- microvescicole (vescicole di trasporto)- macrovescicole (vescicole di secrezione)
Le cisterne sono dei dischi fatti di una membrana simile a quella del reticolo endoplasmatico che delimita uno spazio interno di altezza circa 10 nm nella parte centrale, che si espande ai lati fino ad arrivare ad altezze di 30-50 nm.
Una cisterna è separata da un’altra da uno spazio di circa 10 nm, in cui non sono presenti né ribosomi, né inclusi citoplasmatici vari.
Il complesso di Golgi presenta anche una polarità interna anche a livello delle singole cisterne. Si possono quindi distinguere, in funzione anche dell’attività enzimatica e di sintesi:
- faccia cis: detta anche faccia prossimale- faccia trans: detta anche faccia distale
La faccia prossimale (o cis) è solitamente rivolta verso l’involucro nucleare o verso il reticolo endoplasmatico:
- è la camera d’ingresso che accoglie tutte le vescicole derivanti dai vari organuli di sintesi
- la stessa parte cis può avere origine dalla fusione delle varie vescicole
La faccia distale (o trans) è solitamente rivolta verso la periferia della cellula:
- rappresenta la porta d’uscita dei prodotti delle cisterne- formata da una rete complessa di tubuli anastomizzati- numerose vescicole si staccano per gemmazione.
Lo spessore delle membrane golgiane è costante:- maggiore di quelle del REL - meno spesso di quello della membrana plasmatica.
L’aumento dello spessore è lieve ed è nella direzione della faccia distale.
La composizione biochimica delle cisterne è differente:- verso la parte prossimale o cis la membrana è ricca d
lecitine
- verso la parte distale la membrana possiede parecchie sfingomieline e steroli, divenendo simile alla membrana plasmatica, con la quale le vescicole rilasciate dovranno fondersi
Ogni pila di cisterne dell’apparato di golgi è costituita da tre differenti compartimenti, ognuno dotato di uno specifico corredo enzimatico che catalizza le varie fasi di elaborazione delle glicoproteine giunte dal RER:
- cis- mediano- trans
Questi tre compartimenti constano di una o due cisterne ciascuno e sono in rapporto tra loro mediante il distacco di vescicole laterali:
- le vescicole gemmano dai margini della cisterna e si fondono con la cisterna adiacente
- trasportano glicoproteine a differente stadio di elaborazione
Come già accennato, vi sono altri due tipi di vescicole:- microvescicole o vescicole transfer- macrovescicole o vescicole secretorie
Le vescicole transfer hanno un diametro di circa 80-100 nm e sono indipendenti:
- si fondono insieme a livello della membrana cis del Golgi per coalescenza
Queste vescicole hanno movimenti bidirezionali mediati da tracce microtubulari:
- si instaura un equilibrio volumetrico tra RER, REL, mitocondri o altri organuli e compartimento cis
- dal cis ritornano vescicole che sono destinate a rifondere la membrana dell’organulo che è stata staccata
I granuli di secrezione presentano un diametro di circa 1 micron e derivano dai vacuoli che si staccano dal compartimento trans:
- nelle cellule a funzione secretoria possiedono il prodotto di secrezione
- si fondono con la membrana plasmatica per esocitare il secreto
Anche nel caso delle macrovescicole vi è un ritorno di membrana al complesso del Golgi:
- le vescicole endocitate dalla cellula forniscono nuova membrana al compartimento trans.
Compartimentazione delle cisterne golgiane.
È più plausibile la teoria che le cisterne si scambino materiale attraverso vescicole piuttosto che il ricambio di materiale avvenga per trasformazione di un compartimento nei suoi vari stadi:
- le vescicole arrivano dagli organuli nel compartimento cis- vengono elaborate e passate nel mediano attraverso
piccole vescicole (laterali)- vengono ulteriormente elaborate e passate al
compartimento trans.
Questa compartimentazione rende possibile la simultanea elaborazone di tre tipologie di prodotti:
- quelli destinati ai lisosomi- quelli secreti attraverso i granuli di secrezione- quelli destinati al rinnovo dei componenti della membrana
plasmatica
Ogni compartimento ha una precisa competenza biochimica, contenendo enzimi differenti.
Da studi biochimici si è dimostrato che le proteine vengono glicosilate con l’aggiunta di:
- N-acetilglucosammina nel compartimento mediano- Galattosio e acido sialico nel trans
La glicosilazione delle proteine
1) Dal RER arrivano vescicole di trasporto riconoscibili per il loro rivestimento proteico e si fondono con il cis-Golgi.
2) Nel cis arrivano glicoproteine ramificate con 14 zuccheri, che hanno già subito il distacco di tre molecole di glucosio e una di mannosio nel RER (2 N-acetilglucosammina, 9 mannosio, 3 glucosio)
3) Alcune di queste proteine subiscono l’aggancio di due gruppi fosfato ai mannosi terminali mediante attacco di N-acetilglucosammina-fosfato e distacco dell’N-acetilglucosammina ad opera di due enzimi (N-acetilglucosammina fosfatotransferasi, fosfoglicosidasi)
4) Queste proteine, a causa del legame con il gruppo fosfato, non subiscono ulteriori modificazioni, giungono nel trans-Golgi network e vengono espulse con destino lisosomiale fondando vescicole idrolasiche.
Altre glicoproteine sono elaborate a livello del compartimento mediano ad opera di altri enzimi:
1) la mannosidasi I stacca tre unità di mannosio2) la N-acetilglucosammina-transferasi aggiunge una molecola di N-
acetilglucosammina mediante energia fornita da UTP3) la mannosidasi II rimuove ulteriori due molecole di mannosio4) la N-acetilglucosammina-transferasi aggiunge un’altra molecola
di N-acetilglucosammina
Trasportate nel trans-Golgi network le glicoproteine subiscono, da parte di enzimi specifici, l’aggiunta di altre molecole quali:
- galattosio- acido sialico- fucosio
Queste glicoproteine differenti, a seconda delle diverse aggiunte nel trans, hanno destini differenti:
- alcune sono destinate ai granuli di secrezione- altre a rinnovare la membrana plasmatica, in particolare
le proteine ricche di acido sialico, che forma il glicocalice
- vescicole idrolasiche sono formate da quegli enzimi (idrolasi) elaborati nel compartimento cis, che rimangono nel citoplasma
Le proteine, dunque, non sono separate finché non raggiungono il reticolo trans dell’apparato di Golgi, dove vengono riconosciute e smistate alle loro differenti destinazioni.
Ad ogni spostamento di vescicole, è bene ricordare che la membrana del vacuolo di trasporto viene restituita mediante un ritorno alla cisterna precedente.
Funzioni
Il ruolo primario dell’apparato di golgi è quello dell’impacchettamento e della condensazione dei secreti.
Tuttavia il complesso di Golgi svolge anche altri ruoli fondamentali che si sono scoperti negli ultimi anni:
- rinnovamento del sistema membranoso interno: sintetizza le proteine di membrana con la rielaborazione delle catene oligosaccaridiche
Oltre alla rielaborazione degli oligosaccaridi N-linked legati alle proteine sintetizzate nel RER è anche capace di operare la O-glicosilazione:
- la catena oligosaccaridica è sintetizzata interamente nell’apparato di Golgi e legata a residui i serina o di treonina con legami O-glucosidico.
Alcune proteine di secrezione (es. insulina) vanno incontro a modificazioni per proteolisi, ovvero subiscono il distacco dalla catena più lunga che ha origine nel RER.
Avvengono anche le sintesi di:- polisaccaridi- polisaccaridi con zuccheri amminici (es.
Glicosamminoglicani) che legati a un asse proteico di serina vanno a costituire i proteoglicani
- solfatazione dei proteoglicani
Partecipa anche alla sintesi di alcuni lipidi:- glicerofosfolipidi e colesterolo sono sintetizzati nel REL- gli sfingolipidi sono sintetizzati nell’apparato del Golgi
La sintesi degli sfingolipidi avviene solo per quanto riguarda lo scheletro molecolare nel REL, mentre nel Golgi viene legato un gruppo di fosforilcorina, formando sfingomieline a cui vengono aggiunti carboidrati.
5. Il processo di secrezione
Il RER, il REL e il complesso di Golgi svolgono un ruolo sinergico in vari processi:
- ogni apparato è provvisto di una composizione chimica differente
- ogni compartimento ha una specifica funzione, ma l’attività di uno è strettamente correlata a quella dell’altro
Uno dei processi più importanti è quello della secrezione:- nel reticolo endoplasmatico vengono sintetizzate le
sostanze- nel Golgi vengono elaborate e chiuse in vescicole- questi granuli di secrezione si fondono con la membrana
plasmatica secernendo il secreto all’esterno della cellula.
Nel complesso di Golgi le proteine subiscono modifica post-traduzionali ed entrano a far parte di vescicole che gemmano dal trans-golgi network.
In molte cellule secernenti che accumulano il prodotto di secrezione, le vescicole sono sede di condensazione:
- perdono progressivamente acqua- diventano granuli di screzione o granuli di zimogeno
I granuli di zimogeno sono la forma inattiva delle proteine enzimatiche sintetizzate, che si attivano non appena rilasciate all’esterno della cellula per esocitosi.
Nel processo di evoluzione il meccanismo secretorio si è conservato:- tutte le cellule hanno le medesime modalità di secernere
vari tipi di secreto
Molte cellule, degli organismi pluricellulari, si specializzano per un particolare tipo di secreto, ad esempio:
- enzimi digestivi- muco- proteine sieriche- fattori di crescita- ormoni- ecc..
tuttavia esistono due differenti modalità con cui il secreto viene espulso dalla membrana plasmatica:
- via secretoria costitutiva- via secretoria regolata
La via secretoria costitutiva comprende quei fenomeni che avvengono in tutte le cellule, come il rinnovamento della membrana plasmatica e delle proteine di membrana, il rilascio di lipidi o proteoglicani all’esterno della membrana o altro genere di molecole regolativeI.
Questa via è un processo continuo che non necessita di essere stimolata e non è calcio-dipendente.
La via secretoria regolata, invece è presente solamente in cellule specializzate, come ad esempio le cellule ghiandolari endocrine ed esocrine e alcune cellule nervose, che accumulano in vescicole il secreto per lungo tempo.
Questi granuli contenenti il secreto si accumulano al di sotto della membrana plasmatica, talvolta fondendosi con essa, e rilasciano il secreto solamente quando, a causa di uno stimolo nervoso o ormonale esterno, i innalza la concentrazione degli ioni Ca2+ nel citoplasma.
I granuli secretori sono dunque dei granuli di accumulo del secreto soggetti alla concentrazione di calcio nella via secretoria regolata.
I granuli secretori che vengono gemmati dal trans-Golgi sono granuli immaturi, che nel corso della permanenza nel citoplasma giungono a maturazione:
- viene eliminato il volume in eccesso- vengono condensate le proteine- vengono rimossi certi costituenti di membrana.
6. Lisosomi
I lisosomi sono vacuoli delimitati da membrana che contengono enzimi idrolitici a pH acido (idrolasi acide):
- sono capaci di degradare differenti tipi di molecole- sono la principale sede di digestione cellulare
Il materiale che viene degradato può avere differenti provenienze:- materiale obsoleto della cellula- materiale introdotto dall’esterno
I lisosomi sono molto eterogenei per il tipo di enzimi che contengono e per le loro dimensioni:
- uno dei fondamentali componenti è la fosfatasi acida
Ogni cellula contiene un numero variabile di lisosomi:- abbondanti nelle cellule fagocitarie (macrofagi o
granulociti neutrofili)- in altri tessuti possono avere una distribuzione
preferenziale
La forma di questi piccoli vacuoli e le dimensioni possono variare a seconda di cosa hanno inglobato:
- le dimensioni e la forma saranno maggiori e irregolari se all’interno sono pezzi fagocitati
- le dimensioni saranno minori e la forma ovoidale se il contenuto è proteico
Un lisosomi contiene enzimi idrolitici di varia natura, che possono variare a seconda dei tipi cellulari. I più comuni e frequenti sono:
- idrolasi acide- proteasi- glicosidasi- ribonucleasi - desossiribonucleasi- solfatasi- glicosidasi- solfatasi…
Tutti i tipi di molecole biologiche possono essere degradati all’interno dei lisosomi in condizioni di pH ottimali, ovvero intorno a 5:
- si spiega l’impossibilità del funzionamento dei medesimi enzimi nel citosol (pH è 7,2)
- nella membrana lisosomiale vi è la presenza di pompe protoniche (necessitano di ATP) che immettono H+ nel lume per mantenere il pH=5.
Oltre alle pompe protoniche ATP-asiche della membrana del lisosomi sono presenti altre proteine transmembrana:
- alcune proteine hanno una porzione glucidica che sporge nel lume e serve ad impedire la digestione della membrana da parte delle proteasi attive
Formazione e funzione dei lisosomi
La formazione del lisosomi, con le sue caratterisitiche funzioni enzimatiche e la sua peculiare acidità si forma per la fusione di varie vescicole che forniscono le varie componenti molecolari necessarie.
Dalla membrana plasmatica, per endocitosi, si formano delle vescicole che possiedono già alcune proteine di membrana: gli endosomi precoci:
- proteine di membrana presenti nel plasmalemma vengono riciclate
- la sua maturazione e l’acquisizione di pompe protoniche facilita la diminuzione del pH del lume (da 7,3 a circa 6 negli endosomi tardivi)
- la maturazione a endosomi tardivi avviene quando sono state acquisite proteine di membrana, pompe protoniche e l’ambiente interno ha pH di circa 6.
Si ritiene che le pompe protoniche, sintetizzate nel RER e rielaborate nel Golgi siano fatte giungere agli endosomi mediante vescicole differenti da quelle contenenti idrolasi.
La fusione dell’endosoma tardivo con le vescicole idrolasiche (prodotte dal Golgi, di diametro di circa 400 nm e contenenti enzimi idrolasi) porta alla formazione di un endolisosoma:
- per futura acquisizione di pompe protoniche diventa il vero e proprio lisososma, in cui può avvenire la digestione.
- Il pH di un lisososma arriva a 5
Lo smistamento delle idrolasi è dovuto alla marcatura delle stesse con mannosio-6-fosfato:
- nel cis-Golgi le idrolasi subiscono la fosforilazione dei mannosi terminali
- nel trans-Golgi sono presenti recettori sulle cisterne in particolari siti addensati
- Le proteine marcate con mannosio-6-fosfato a pH neutro si legano ai recettori
- Dal trans-Golgi gemmano le vescicole contenenti le idrolasi acide ancora legate ai recettori
- Quando le vescicole idrolasiche si fondono con l’endosoma tardivo, il pH acido fa slegare le idrolasi marcate con mannosio-6-fosfato che rimangono nell’endolisosoma
- La membrana della vescicola con i recettori per il mannosio-6-fosfato vengono riciclati dal trans-Golgi.
Il lisosoma non contiene solamente enzimi proteolitici e idrolasi acide, ma anche materiale residuo che deve essere degradato, solitamente assunto per endocitosi dalla cellula.
Quando il materiale che deve essere degradato è di grosse dimensioni poiché assunto per fagocitosi, la fusione del fagosoma (vacuolo contenente il materiale fagocitato) con l’endosoma tardivo forma una grossa struttura detta fagolisosoma.
Se invece la necessità e di digerire organuli invecchiati, quindi di fare dell’autofagia:
- gli organuli vengono racchiusi in vacuoli detti autonomi- gli autonomi si fondono con gli endosomi tardivi formando
gli autofagolisosomi.
Il meccanismo dell’autofagia, a seconda del tipo cellulare, può avere dimensioni imponenti:
- nel fegato si ha un ricambio di mitocondri per miliardi all’ora
Le molecole risultanti dalla digestione intercellulare sono rilasciate nel citosol, trasportate all’esterno del lisosoma da specifiche proteine di membrana, che possono in futuro fungere da materiale di sintesi per:
- metaboliti- organuli- nuove molecole
Altri prodotti, invece, sono espulsi dalla cellula come prodotti d’escrezione.
Talvolta, come nel caso degli osteoblasti, gli enzimi lisosomiali possono essere espulsi dalla cellula, con specifiche funzioni nella matrice extracellulare.
Deficienze genetiche ed enzimi lisosomiali
Sono state descritte parecchie malattie in cui le mutazioni geniche portano alla mancanza di geni che codificano per specifiche idrolasi:
- malattie da accumulo lisosomiale , in quanto il substrato dell’enzima interessato non può essere degradato e si accumula nel lisosoma,
- le conseguenze delle malattie da accumulo possono anche essere molto gravi.
Un altro genere di malattia, riguarda il deficit di recettori per il mannosio-6-fosfato:
- è definita malattia a cellule I, poiché si riscontrano particolari inclusioni citoplasmatiche
- i vari enzimi idrolitici non possono legarsi al mannosio-6-fosfato e indirizzati nelle vescicole idrolasiche
- gli enzimi vengono esocitati per la via secretoria costituitva, riversandosi nel sangue.
7. Trasporto cellulare mediato da vescicole
Il complesso sistema di membrane all’interno di una cellula (RER, REL, involucro nucleare, Golgi, sistema endosomi/lisosomi) è in continua comunicazione:
- i compartimenti si scambiano continuamente vescicole- le vescicole trasportano nel lume le proteine solubili- la membrana delle vescicole si fonde con le varie
membrane ed assicura il continuo ricambio delle proteine di membrana.
La comunicazione tra le vescicole e il plasmalemma aiuta anche a cambiare la composizione proteica della membrana plasmatica:
- di fondamentale importanza per determinare la possibilità di interazioni con altre cellule e con la matrice extracellulare
- necessità per il mantenimento degli organi e del loro sviluppo
IN cellule specializzate/polarizzate la differente composizione molecolare di lipidi e proteine di membrana è assicurata dalle differenti destinazioni delle vescicole gemmate dal trans-Golgi:
- si formano trasportatori distinti per il corretto indirizzo sulle regioni della membrana
Il traffico delle vescicole avviene su due differenti vie:- via biosintetica- via endocitica
Su ogni via, è assicurato il riciclaggio dei componenti poiché vi è la presenza di un traffico di ritorno.
Le vescicole, al momento della gemmazione, sono coadiuvate da un rivestimento che nel momento del distacco funge da chiusira per la membrana donatrice:
- in seguito, rimane a coprire la vescicola fino al momento dell’apertura
- se la vescicola non si fonde con nessun’altra membrana, il rivestimento si distaccherà dalla vescicola.
Il rivestimento per le vescicole di via biosintetica è costituito da proteine reclutate sul RER e sull’apparato di Golgi:
- COP-I e COP-II : sono complessi di proteine morfologicamente simili ma hanno differente composizione molecolare
Al momento dell’assemblaggio si ha l’attivazione di un monomero proteico che lega GTP in prossimità del legame alla membrana:
- i siti di legame delle proteine di rivestimento alla membrana sono code citoplasmatiche di particolari proteine di membrana
Dal reticolo endoplasmatico al Golgi il rivestimento è di tipo COP-II, mentre dal Golgi ad altri apparati il rivestimento è COP-I.
Le vescicole mantengono il rivestimento COP fino a quando non sono agganciate alla membrana di destinazione:
- a questo punto il rivestimento si disgrega e le vescicole si agganciano alla membrana bersaglio
Un altro tipo di rivestimento è quello di clatrina, che comprende le vescicole impegnate nel trasporto nato da:
- endocitosi (trasporto tramite endosomi dal plasmalemma)- trans-Golgi network (compartimento tubulare) in direzione
della membrana plasmatica e dei lisosomi- fagocitosi, ma è un rivestimento incompleto
La molecola di clatrina è una molecola esamerica con tre braccia:- il rivestimento intorno alla vescicola è a maglie
pentagonali o esagonali- la peculiarità di tale rivestimento è la pronta
disgregazione, che richiede ATP.
Il trasporto attuato dalle vescicole clatriniche è tipicamente selettivo:- le specifiche molecole da trasportare sono riconosciute
da recettori di membrana- i complessi ligando-recettore sono addensati in una zona
della membrana da cui ha origine la vescicola- La porzione citoplasmatica dei recettori serve come
segnale per il rivestimento di clatrina, mediato e attuato da adaptine.
Il traffico delle vescicole deve essere precisamente indirizzato:- molecole complementari sulla membrana bersaglio e su
quella delle vescicole assicurano il corretto posizionamento
- molecole v-SNARE sono posizionate sulla vescicola come recettori
- molecole t-SNARE sono presenti sulla membrana bersaglio come recettori delle v-SNARE.
- Altre proteine specifiche (ad esempio le proteine Rab) esercitano il controllo sull’esattezza del riconoscimento.
Affinché la fusione delle due membrane avvenga, occorre un ancoraggio che vinca le forze di repulsione elettrostatiche:
- sono adoperate particolari proteine di fusione, che con ausilio di ATP e GTP come riformìnimento energetico vincono le forze idrofile della membrana bersaglio
- proteine come e NSF e SNAP si legano alla membrana bersaglio e catalizzano la fusione della membrana della vescicola. A processo concluso, ritornano nel citoplasma.
8. perossisomi
Il perossisoma è una vescicola di diametro di 0,6-0,7 µm, delimitato da una membrana:
- contiene uricasi e una sostanza cristallina contenente vari enzimi
Nel nucleoide cristallino che si forma in zone addensate del perossisoma, sono localizzati tre enzimi funzionalmente correlati tra loro:
- uricasi- D-amminoacido-ossidasi- Catalasi
L’uricasi catalizza l’ossidazione dell’acido urico, degradando le purine, dando come prodotto l’allantoina e acqua ossigenata
La D-amminoacido ossidasi da come sottoprodotto acqua ossigenata.
L’acqua ossigenata viene poi degradata dalla catalasi presente nel perossisomi.
Il nucleoide dei perossisomi e la funzione enzimatica nell’ossidazione delle purine, è presente solamente negli animali non mammiferi:
- questi secernono nell’urina l’allantoina- i mammiferi secernono invece acido urico
I perossisomi, sono tuttavia presenti in tutte le cellule eucariotiche e contengono enzimi ossidativi differenti a seconda delle specie:
- il loro nome deriva dalla presenza delle catalasi che degradano il perossido d’idrogeno a acqua e ossigeno.
Gli enzimi dei perossisomi impiegano ossigeno molecolare per rimuovere idrogeno dalle molecole, dando come sottoprodotto acqua ossigenata:
- l’acqua ossigenata viene poi degradata ad acqua pura dalla catalasi.
I perossisomi sono utilizzati per neutralizzare la tossicità di numerose molecole introdotte con la dieta (ad esempio l’alcol etilico):
- ossidano anche gli acidi grassi ad acetil-coenzima A- questo è poi inviato ai mitocondri per il ciclo di krebs
Si calcola la presenza di numerosi enzimi, tra cui molti anche impegnati nella biosintesi dei lipidi e fosfolipidi.
9. inclusioni citoplasmatici
Con il termine inclusione si intende sostanza contenta in una cellula che non fa parte di organuli, ma che è morfologicamente visibile.
I più importanti inclusi sono rappresentati dalle sostanze di riserva e dai pigmenti.
SOSOTANZE DI RISERVA
I materiali di deposito fungono da riserva energetica. Sono presenti nel citosol senza alcuna delimitazione da parte di membrane.
I glucidi sono immagazzinati sotto forma di un polisaccaride chiamato glicogeno:
- è immagazzinato in alcuni tipi cellulari e, depolimerizzato in glucosio rappresenta una fonte energetica di riserva che raggiunge tutte le altre cellule attraverso il flusso sanguigno
- la sintesi è catalizzata da un enzima detto glicogeno-sintetasi
- la depolimerizzazione è catallizzada dalla glicogeno-fosforilasi.
I lipidi si conservano in alcuni tipi cellulari sotto forma di goccioline di trigliceridi, oppure come nel caso delle cellule adipose, come grossi accumuli che formano un’unica goccia al centro della cellula.
I lipidi appaiono come spazi tondeggianti all’interno della cellula.
PIGMENTI
I pigmenti sono inclusioni citoplasmatiche di varia natura chimica. Si possono distinguere in:
- pigmenti esogeni: provenienti dall’ambiente esterno- pigmenti endogeni: provenienti dal metabolismo
cellulare.
Esempi di pigmenti endogeni possono essere:- melanina: si trova in particolari dellule della cute, dette
melanosomi, di olore bruno o nero. È presente anche sull’epitelio pigmentato della retina.
- Lipofuscine: Sono aggregati di materiale fluorescente che si trovano in alcune cellule degli organismi anziani. La presenza in soggetti anziani fa supporre che siano materiale inutilizzato che no riesce ad essere espulso.
- Derivati dell’emoglobina: ad esempio la bilirubina o la emosiderina si trovano sotto forma di granuli scuri nei macrofagi della milza, del fegato e del midollo osseo.
I pigmenti esogeni, sono immessi con la dieta, per inalazione o per immisione cutanea:
- il carotene è assunto con la dieta - le polveri di carbone sono inalate se presenti nell’aria ed
inglobate dai macrofagi polmonari- per assorbimento cutaneo è possibile assumere alcuni
minerali come argento e piombo.
c. Mitocondri
I mitocondri sono organuli presenti nel citoplasma delle cellule animali e vegetali, benché mancano nei procarioti.
Sono organuli estremamente dinamici:
- reagiscono ai cambiamenti di pressione osmotica rigonfiandosi in ambiente ipotonico e restringendosi in ambiente ipertonico
- hanno dimensioni e forma variabile, in relazione ai momenti funzionali della cellula
- possono passare dalla forma filamentosa a quella a bastoncino con estrema rapidità, allungarsi, stringersi, gonfiarsi con facilità
- possono scindersi in due mitocondri- possono fondersi due distinti mitocondri- gli spostamenti dipendono dai sistemi di movimento
intracellulari.
Nella mitosi il patrimonio mitocondriale delle due cellule figlie è dimezzato rispetto alla cellula madre:
- in fase G1 i mitocondri vanno incontro a fenomeni di divisione dopo aver replicato il proprio DNA (in maniera indipendente da quello del nucleo della cellula)
- si ricostruisce il numero di mitocondri tipico della cellula madre.
La principale funzione dei mitocondri è la produzione di ATP come fonte energetica per tutto il metabolismo cellulare:
- le reazioni metaboliche dei glucidi liberano l’energia che viene immagazzinata sotto forma di ATP (adenosintrifosfato)-
- la principale fonte di energia sono lipidi e carboidrati, in misura minore sono sfruttati anche gli amminoacidi.
Forma, dimensioni, numero, localizzazione.
In cellule in coltura, i mitocondri possono essere osservati dopo colorazione con il verde Janus, che rimane nella forma ossidata solamente nei mitocondri, che sono ben visibili.
La forma dei mitocondri è estremamente variabile, da tondeggiante a tubulare.
Le dimensioni variano con il variare della forma:- la lunghezza può andare da 1 a 6 µm, potendo giungere
anche a 10 µm- lo spessore può invece passare da 0,2 a 1 µm
Il numero dei mitocondri in relazione al fabbisogno energetico della cellula:
- in una normale cellula si trovano 1000-2000 mitocondri- in ovociti di alcune specie possono esservene anche
30000.
Si ritiene che il 30-35% delle proteine di una cellula siano dislocate nei mitocondri:
- le membrane di questi sono ricchissime di proteine.
La distribuzione dei mitocondri è generalmente omogenea. Possono tuttavia esservi delle eccezioni, in relazione alla posizione ove è necessaria maggiore energia:
- nelle ghiandole, generalmente i mitocondri si trovano verso la superficie basale
- negli epiteli intestinali, questi si trovano generalmente ai due poli
- nello spermatozoo formano una guaina elicoidale nel pezzo intermedio alla coda
- nei muscoli sono allineati ai fasci di miofibrille- ecc..
Ultrastruttura
Al microscopio elettronico si osserva che un mitocondrio è formato da una superficie con una doppia membrana:
- la membrana esterna, ha spessore di circa 6-8 nm, - ma membrana interna ha anch’essa spessore di 6 nm,
ma è tutta ripiegata su sé stessa in invaginazioni dette creste mitocondriali, disposte perpendicolarmente all’asse longitudinale del mitocondrio.
Nei mitoocndri delle cellule che producono ormoni steroidei (es. corteccia surrenale o gonadi) hanno creste disposte a tubuli.
Le due membrane delimitano uno spazio denominato spazio perimitocondriale o camera esterna.
La camera interna, invece, è lo spazio delimitato dalla membrana interna del mitocondrio:
- contiene materiale finemente granulare e opaco, detto matrice mitocondriale
la matrice mitocondriale contiene enzimi che servono per l’ossidazione di acidi grassi e del piruvato e per il funzionamento del ciclo di Krebs:
- talvolta queste proteine con funzione enzimatica sono così numerose da conferire alla matrice l’aspetto di un gel granulare
- Il numero di granuli è in rapporto all’accumulo e al trasporto di ioni calcio e magnesio, di cui i mitocondri sono la principale riserva a livello cellulare.
Nella matrice mitocondriale sono presenti molecole di DNA ad anello, con le relative tre classi di RNA (messaggero, transfer, ribosomiale) e dei ribosomi di dimensioni leggermente più piccole di quelli citoplasmatici.
Sulle creste mitocondriali, sul lato della matrice, si possono riscontrare dei complessi proteici denominati F1:
- formati da 5 o più subunità- sono ancorati alla membrana mediante un peduncolo di
3-4 nm
Le subunità del complesso F1 sono legate a quelle del complesso F0, che è totalmente inserito nella membrana interna e la attraversa completamente:
- l’intero complesso F1-F0 è orientato in modo che le componenti F1 possano sporgere verso l’interno della membrana (nella matrice)
- questo complesso (particella elementare) è l’enzima che attua la fosforilazione ossidativa.
Composizione chimica
In generale i mitocondri sono costituiti per la maggior parte da proteine, con la seguente composizione chimica:
- 65-70% di proteine- 25-30% di lipidi- piccole quantità di acidi nucleici per circa 1-0,5%
è anche possibile ottenere dati sulla composizione chimica delle componenti isolate:
- la membrana esterna è relativamente permeabile e ha un contenuto lipidico più alto di quella interna (40-50%). I lipidi principali sono i fosfolipidi.
- la membrana interna ha un minor contenuto lipidico (20%), scarsa di colesterolo e ricca di proteine.
Altri componenti dei mitocondri sono:- acidi nucleici (DNA, RNA)- nucleotidi (ATP, ADP, NAD, NADP, FAD)- ioni Na+, Ca2+, Mg2+.
Modificazioni ultrastrutturali dei mitocondri nei vari tessuti
In differenti condizioni fisiologiche i mitocondri possono presentare forme differenti:
- quando i processi do ossidoriduzione della fosforilazione rallentano, la camera interna si rigonfia e quella esterna si riduce, assumendo la cosidetta forma ortodossa
- se viene stimolata la fosforilazione ossidativa, la camera interna si riduce e quella esterna si amplia. Si ha la forma condensata.
La forma condensata viene raggiunta poiché quando il mitocondrio è in attività, vengono pompati protoni dalla camera interna a quella esterna, con conseguente aumento di pH:
- viene immessa acqua per evitare l’esagerata acidità nella camera esterna
Nel digiuno prolungato i mitocondri si gonfiano e mostrano una diminuzione delle creste ed una rarefazione della matrice.
In ambiente anaerobio la membrana interna si presenta liscia e le creste scompaiono.
Ciclo vitale, biogenesi ed origine.
Un mitocondrio si divide per frammentazione, e parte della sua membrana viene conservata:
- la vita di un mitocondrio può durare differenti giorni o poche ore, a seconda del tipo cellulare in cui si trovano
- l’eliminazione avviene per via autofagica, quando vengono avvolti da membrane del reticolo endoplasmatico e fusi con vescicole lisosomiali
I mitocondri possiedono un proprio genoma e un proprio apparato sintetico:
- il DNA mitocondriale è ciclico e non legato a proteine. È agganciato alle creste mitocondriali
- le differenti lunghezze dei filamenti genomici nei diversi organismi non comporta un numero differente di geni, ma solamente di sequenze introniche che vengono ripetute o di esoni.
La maggior parte delle proteine mitocondriali proviene dal citoplasma:- sintetizzate sotto il controllo del nucleo.
Il DNA mitocondriale, invece, codifica per:- RNA ribosomiale dei mitocondri- Geni per i 22 tRNA- Geni per 13 proteine che sono coinvolte nel processo di
trasporto di elettroni e del complesso ATP-sintetasi.
Per quanto siano dotati di DNA e di tutto il corredo per la produzione di proteine, i mitocondri non sono in grado di produrre tutte le molecole di cui sono costituiti:
- le proteine dei mitocondri sono in larga parte sintetizzate su ribosomi presenti nel citosol con informazioni fornite dal nucleo della cellula
- le proteine hanno una specifica sequenza di riconoscimento legata all’estremo amminoterminale di 12-80 residui
- sono legate da uno specifico recettore sulla membrana esterna del mitocondrio
- dalla membrana sono poi smistate con vari procedimenti
Si pensa che il punto in cui le due membrane siano parecchio vicine sia un sito di traslocazione di proteine da una membrana all’altra e dalla membrana esterna alla matrice.
Dal citosol vengono anche importati i costituenti della membrana, in gran parte fosfolipidi, tra cui la cardiolipina, che è un fosfolipide che conferisce impermeabilità.
Sull’origine dei mitocondri vi sono due ipotesi:- endosimbiotica : i mitocondri sarebbero ex cellule
procarioti capaci di attuare meccanismi ossidativi che non erano possibili alle cellule eucarioti, quindi questi sarebbero entrati in simbiosi
- autogena : i mitocondri sarebbero nati da scissione di una parte di DNA dal nucleo della cellula eucariota al momento della divergenza con i procarioti. La porzione di DNA di membrana sarebbe stata racchiusa da membrane, che non sarebbero potute essere attraversate da proteine.
Funzione
La funzione principale dei mitocondri è quella di fornire energia alla cellula. L’energia è fornita alla cellula sotto forma di ATP
(adenosintrifosfato), sintetizzata dai mitocondri grazie ad una serie di processi ossidoriduttivi con la catalisi dell’enzima ATP-sintetasi.
La sintesi dell’ATP si svolge in tre fasi:1) glicolisi anaerobica : viene formato acido piruvico a partire
da glucosio2) ciclo di Krebs 3) fosforilazione ossidativa : viene creata energia dalla
differente concentrazione di protoni tra i due spazi interni ai mitocondri.
Un mitocondrio può avere anche altre funzioni:1) capacità di accumulare ioni calcio : l’importanza degli ioni calcio
nella motilità intracellulare è data dal fatto che il calcio regola il movimento dei microfilamenti. La capacità di accumulare calcio è data dal potenziale di membrana che si viene a creare nella catena ossidoriduttiva.
2) Associazione reversibile di alcuni enzimi come le esochinasi : questi si associano alla membrana esterna e regolano alcuni processi come ad esempio la glicolisi che avviene nel citoplasma
3) Sintesi di ormoni streroidei : partecipano insieme al REL nella sintesi di ormoni steroidei con alcuni enzimi posti sulla membrana esterna.
4) Gluconeogenesi : è un meccanismo che interviene quando il glicogeno e il glucosio sono insufficienti per l’apporto energetico necessario alla cellula. Viene sintetizzato glucosio a partire da precursori non saccaridici.
5) Sintesi proteica : sebbene limitata alle proteine necessarie al mitocondrio.
6) Produzione di calore : quando non vi è sufficiente ADP per trasformare tutta l’energia in ATP, l’energia residua che deriva dalla fosforilazione viene dissipata in calore
7) Sintesi di lipidi e fosfolipidi .
d. Citoscheletro
Una cellula in vita tende a mantenere ordinati i propri organuli e le proprie strutture per coedere i processi che competono al suo metabolismo:
- le manifestazioni motorie sono eventi specifici e programmati attuati da una struttura filamentosa eterogenea di natura proteica che viene definita citoscheletro
Il citoscheletro non è una struttura puramente di sostegno, ma permette anche i movimenti che sono definiti motilità cellulare:
- è una struttura in continuo movimento, di assemblaggio e disassemblaggio
- alcune parti, tuttavia, svolgono anche le pure funzioni meccaniche.
Il citoscheletro è costituito da tre elementi principali:- microfilamenti- microtubuli- filamenti intermedi
Ognuna di queste tre tipologie di filamento possiede una precisa localizzazione all’interno della cellula.
I microfilamenti sono costituiti da actina e sono concentrati:- al di sotto della membrana plasmatica (cortex)- formano fasci che si collegano alla superficie della cellula
(stress fiber)
I microtubuli si irradiano a partire da un sito sul nucleo (il centrosoma) e raggiungono la periferia della cellula innestandosi sulla cortex (struttura planare formata da microfilamenti).
Il filamenti intermedi formano delle reti tridimensionali che si dispongono in zone differenti:
- intorno al nucleo (vimentina)- a livello dell’involucro nucleare (lamine nucleari)- fasci che si connettono a complessi di giunzione
(cheratina)
- lungo i prolungamenti citoplasmatici come villi, ciglia, assoni, ecc… (neurofilamenti).
Tutte queste strutture sono strettamente interconnesse mediante complessi di giunzione, legandosi alla membrana nucleare e a quella plasmatica, nonché ai vari organuli.
Il citoscheletro è una peculiarità delle cellule eucariotiche:- i procarioti non hanno compartimentazione interna, e tra
attività incompatibili non v’è separazione fisica, bensì temporale
Il sistema membranoso interno di una cellula suddivide il citoplasma in due compartimenti distinti:
- spazi chiusi: sistema rappresentato dagli organuli nel loro interno
- citoplasma libero: porzione citoplasmatica non racchiusa
Il citoplasma libero è attraversato da una fitta rete di filamenti proteici, che costituisce il citoscheletro.
Mentre dal punto di vista fisico il citoplasma libero si suddivide in spazi (aperti o chiusi), dal punto di vista chimico il citoplasma si distingue in due fasi:
- una solida rappresentata dalle membrane e dal citoscheletro
- una più fluida, rappresentata dalla sostanza fondamentale (o ialoplasma, o citosol).
Nella fase fluida avviene la fase elettiva del metabolismo intermedio cellulare:
- se non vi fosse il citoscheletro le molecole dovrebbero reagire in maniera del tutto casuale
- il citoscheletro invece fornisce supporto alle reazioni chimiche che vengono svolte nel citoplasma, legando ribosomi e enzimi glicolitici.
Il citoscheletro è anche coinvolto in numerosi eventi della motilità cellulare, e ne è il principale responsabile:
- spostamento selettivo dei recettori di membrana (clustering)
- locomozione cellulare (movimento della cellula rispetto ad un substrato fisso)
- traffico citoplasmatico delle vescicole- emissione di pseudopodi- ecc..
ACTINA E MICROFILAMENTI.
L’actina è una proteina globulare del peso di 42,3 kD:- presente in tutte le cellule eucariotiche- rappresenta la maggior parte delle proteine (15-20% delle
proteine totali)
L’actina delle cellule muscolari è un’isoforma rispetto all’actina citoplasmatica, che presenta delle minime differenze (qualche amminoacido nella struttura primaria):
- -actina: presente nelle cellule muscolari (striate, lisce, cardiache)
- -actina: presente nel citoplasma
La forma dell’actina varia con il pH e la concentrazione di ioni:- con bassa concentrazione ioni Ca2+ e ATP e un pH basico
l’actina si presenta in forma monometrica (G-actina)- con l’abbassamento del pH e degli ioni metallici (Mg2+, K+)
la G-actina si polimerizza dando origine ad un fascio doppio di filamenti avvolti a doppia elica del diametro di 5-7 nm (F-actina).
Ogni monomero di G-actina è legato ad una molecole di ATP:- nella polimerizzazione ad F-actina l’ATP viene idrolizzata
a ADP, che rimane legato alle subunità proteiche- l’energia liberata dall’idrolisi sembra non essere
necessaria al processo di assemblaggio
Una polarità dell’actina è già presente nella forma monometrica (G-actina), ma diventa ancor più marcata nei filamenti F-actinici:
- i due estremi del filamento mostrano una configurazione spaziale differente, quindi un differente comportamento chimico
La polarità dell’actina è evidenziabile marcandola con meromiosina (HMM):
- dopo l’attacco di HMM alla actina si verifica che la stereospecificità del legame porta l’HMM ad un attacco inclinato a 45° sempre nella medesima direzione
- le HMM si dispongono a punta di freccia (harrowhed complexes)
La disposizione della meromiosina permette chiaramente di definire le estremità della F-actina:
- pointed-end : estremità in cui sono rivolte le punte delle frecce
- barbed-end: lato opposto.
Al termine della polimerizzazione si raggiunge lo steady state, che non è un momento stazionario, ma un momento estremamente dinamico:
- il polimero di F-actina si trova frazionato in un certo numero di filamenti
- i monomeri di G-actina che non sono stati polimerizzati sono in continua interazione con il polimero
La minima quantità di monomeri affinché si stabilisca l’equilibrio dinamico tra polimerizzazione e depolimerizzazione è definita concentrazione critica:
- un certo numero di monomeri si lega al polimero a livello del barbed end
- un ugual numero di monomeri si distaccano dal polimero a livello del pointed end.
- La quantità di G-actina che si lega è uguale a quella che si scioglie
Si assiste dunque ad un flusso unidirezionale dal barbed end al pointed end dei monomeri actinici:
- questo fenomeno è chiamato treademilling (mulinello)
Tuttavia il fenomeno del treademilling non è assolutamente legato al movimento di organuli e macromolecole:
- il trasporto di organuli e macromolecole è attuato da specifiche proteine motore, che spendono energia mediante idrolisi di ATP
- la velocità del trasporto su via actinica è tra l’altro maggiore nel senso contrario al treademilling
Nonostante le possibili apparenze, la forma F e la forma G dell’actina sono in ugual numero presenti:
- le molecole di G-actina sono spesso complessate alle ß-timosine
- rimane tuttavia una parte di G-actina libera per rendere possibile la concentrazione critica;
- la cellula si assicura in questo modo un numero adeguato di monomeri actinici per poter mantenere il dinamismo della F-actina
Tutti i movimenti della cellula actino-mediati sono coadiuvati da F-actina:- vi sono specifiche proteine coadiuvanti che aiutano la F-
actina ad assumere conformazioni tridimensionali utili
Queste proteine che aiutano l’F-actina ad assumere le adeguate conformazioni tridimensionali sono chiamate actin-binding protein, e si possono dividere in:
- interagenti con G-actina- interagenti con F-actina
Alcune delle proteine actin-binding che interagiscono con G-actina sono:- profiline- ß-timosine- vitamin D-binding protein- DNasi- Depactina- Actoforina
Le action-binding protein che interagiscono con F-actina si distinguono per il ruolo svolto sulla F-actina e sono moltissime, tra cui:
- gelsolina (in grado di tagliare i filamenti)- miosina (proteina motore del sistema acto-miosinico)- filamina - spectrina- -actinina (organizza in fasci o reti i filamenti actinici)- tropomiosine (nelle cellule non muscolari stabilizzano il filamento di
actina)- distrofina
MOTILITÀ CELLULARE ACTINO-MEDIATA
Le manifestazioni di motilità cellulare mediate da actina possono essere distinte in due tipologie:
- movomenti retroattivi: sono movimenti che prevedono l’inervento di una proteina motore, che nel caso dei movimenti actino-mediati è la miosina.
- movimenti propulsivi: sono quei movimenti che possono essere sostenuti solamente mediante la polimerizzazione dell’actina (es. emissione di pseudopodi)
Il movimerto propulsivo con l’emissione di una estroflessione della membrana plasmatica (es. villi, pseudopodi, microvilli, ecc…) dipende da specifici segnali provenienti dala membrana plasmatica e rielaborate nella stessa:
- sono presenti degli specifici recettori di membrana che producono il riarrangiamento del cortex.
- In alune zone si ha l’espansione de citoplasma mediante l’allungamento dei filamenti del cortex
- In altri casi si ha l’introflessione del plasmalemma per permettere la fusione e la formazione delle vescicole e dei granuli secretori (avviene poiché lo strato corticale si ammollisce).
Una volta prodotta l’estroflessione della membrana, questa deve essere resa stabile, con un procedimento che varia a seconda delle specie cellulari:
- in una cellula nervosa, un cono di crescita del neurite viene stabilizzato mediante la formazione di microtubuli, e i filamenti di actina vengono smantellati. Le molecole di
G-actina prodotte dallo smantellamento sono poste in superficie del cono di crescita per poter essere utilizzate per l’ulteriore allungamento
- in un leucocita invece, l’estroflessione non può produrre movimento della cellula intera se questa non si è ancorata a livello dell’emissione dello pseudopodio mediante una placca di adesione. A questo aggancio segue il movimento retrattile derivante dall’interazione actina-miosina.
Il movimento ameboide quindi si può suddividere in due momenti:- emissione dello pseudopodio, con trasformazione G/F-
actina e aggancio mediante placca di adesione- fase motoria attiva (mediante idrolisi si ATP) ad opera del
complesso actina-miosina.
FENOMENO CONTRATTILE
La miosina è una proteina che in struttura quaternaria si presenta come un esamero del peso di circa 500 kD. Le sei catene polipeptidiche sono:
- 2 catene pesanti che si avvolgono ad elica lineare per un lungo tratto, ma ad un estremo divergono ed assumono avvolgimenti globulari (teste)
- 2 coppie di catene leggere addossate alle teste.
La contrattilità è una delle proprietà fondamentali delle cellule:- Le uniche differenze del fenomeno contrattile nei vari tipi
cellulari riguardano solamente le modalità di svolgimento- Non implica l’accorciamento di filamenti all’interno della
cellula.Lo scivolamento di alcune strutture (sliding) rispetto ad altre che rimangono immobili è alla base del fenomeno contrattile:
- i filamenti di actina si spostano grazie alle teste della miosina
- la direzione del moto segue la polarità del filamento actinico (microfilamenti).
- Il moto è in direzione della pointed end.
Il movimento dell’actina sulle teste della miosina è un fenomeno:- ciclico- ATP-dipedente- Calcio-regolato.
Si formano ponti trasversali transitori con le teste della miosina, ed avviene in tutte le cellule, è un meccanismo universale.
La regolazione del fenomeno contrattile, invece, avviene con modalità differenti nei vari tipi cellulari, sebbene sia sempre un meccanismo calcio-dipendente:
- la principale differenza riguarda le molecole che agiscono come interruttori calcio-sensibili
- nel tessuto muscolare striato scheletrico, l’interruttore calcio-sensibile è rappresentato da un complesso proteico di troponina/tropomiosina situato sui filamenti sottili.
Nel muscolo, quindi, la contrattilità è regolata dalla disponibilità del filamento actinico ad interagire con le teste della miosina, mediata dal complesso proteico:
- quando questo complesso è disponibile, la miosina forma ponti transitori con l’ausilio di ATP
Nelle cellule non muscolari, invece, il fenomeno è attivato dalla fosforilazione delle teste di miosina, attivato sempre dal calcio.
TUBULINA E MICROTUBULI.
CC
NN
Anche i microtubuli sono costituenti universali delle cellule eucariotiche:- sono gli elementi citoscheletrici di maggiori dimensioni- hanno un diametro esterno di circa 25 nm e un diametro
interno di 15 nm- la parete ha spessore e lunghezza variabile.
Il principale costituente dei microtubuli è la tubulina, una molecola globulare del peso di circa 50 kD che tende a polimerizzare in strutture sovramolecolari, chiamate protofilamenti.
I protofilamenti si aggregano in pareti, generalmente in numero di 13 protofilamenti, costituendo strutture circolari che sono i veri e propri microtubuli.
A differenza dei microfilamenti, i microtubuli sono eterodimeri:- la tubulina è presente in tre differenti famiglie molecolari
( )- nel microtubuli sono presenti -tubulina e -tubulina .
Le isoforme diferenti della tubulina non sono dovute a differenti geni, bensì a modificazioni post-trascrizionali, quali:
- acetilazione- fosforilazione- tirosinazione/detirosinazione.
Le molecole di tipo alfa e quelle di tipo beta sono fortemente affini tra loro:
- nel citoplasma non si trovano in forma monometrica- si aggregano in eterodimeri in cui l’-tubulina si lega
sempre alla -tubulina
Un protofilamento e di conseguenza anche un microtubulo, è costituito da una sequenza ordinata di tubuline alfa e beta.
Come per l’actina, anche l’assemblaggio delle tubulina in polimeri necessita di un nucleotide energetico, il GTP. Tuttavia esistono anche delle marcate differenze riguardo all’actina:
- l’unità costitutiva di un microtubulo è un dimero, non un monomero.
- La polimerizzazione di actina richiede ATP, mentre per i microtubuli è necessaria una polimerizzazione GTP dipendente
- L’assemblaggio della tubulina è promossa dallo ione magnesio, mentre risulta fortemente inibita dallo ione calcio.
- La polimerizzazione della tubulina è temperatura-dipendente, procede spontaneamente a temperture superiori ai 30°C.
- La polimerizzazione della tubulina è influenzata positivamente da proteine ancillari.
- L’andamento della polimerizzazione avviene con velocità esponenziale e differente nei vari estremi + e -.
Alcune molecole possono influire sull’equilibrio dimeri/polimero:- la colchicina, è in grado di inibire a polimerizzazione e
innestare una depolimerizzazione della maggior parte dei microtubuli
- viblastina e vincristina, sono potenti inibitori della formazione dei microtubuli. Se presenti nel citoplasma a concentrazioni elevate, causano una aggregazione in forma cristallina della tubulina. Usati come antiproliferanti in casi di cellule tumorali.
- Tavolo: è un altro antitumorale. Favorisce la formazione dei microtubuli, stabilizza il polimero e abbassa la concentrazione critica.
MAPs e instabilità dinamica.
La sola associazione della tubulina non rende ai microtubuli le capacità funzionali necessarie:
- allo scheletro di tubulina devono legarsi le MAPs, proteine accessorie in grado di conferire particolari caratteristiche funzionali all’intera struttura microtubulare
- sono chiamate MAPs quelle proteine che copurificano con la tubulina durante l’assemblaggio/disassemblaggio
Vi sono due gruppi di MAPs:- MAPs ad alto peso molecolare : intorno ai 250-350 kD- MAPs a basso peso molecolare : 60-70 kD.
Le MAPs ad alto peso molecolare comprendono due famiglie di proteine (MAP1 e MAP2), ognuna delle quali presenta tre isoforme, A, B, C.
Le MAPs a basso peso molecolare, sono solitamente chiamate proteine Tau, che sono probabilmente implicate nel morbo di Alzheimer.
Anche per la tubulina e per i microtubuli, così come per l’actina e per i microfilamenti, si giunge ad uno steady state, in cui una quantità di dimeri rimane in equilibrio con il microtubulo assemblato:
- valgono le regole che avvengono per l’actina- tuttavia l’equilibrio è estremamente dinamico.
Lo steady state della tubulina presenta un fenomeno che non è riscontrabile nei filamenti actinici, detto di instabilità dinamica:
- essendo proprio dello steady state, non altera le concentrazione complessiva dei dimeri presenti nei microtubuli
- pur mantenendo una concentrazione costante, il polimero varia di lunghezza,
- varia ovviamente il numero di unità in cui il polimero è frammentato.
L’instabilità dinamica è il metodo più efficace per la cellula al fine di cambiare la propria struttura microtubulare:
- le MAPs sono il mezzo con cui la cellula attua questi cambiamenti sui propri microtubuli
Le MAPs sono estremamente fosforilabili:- con la maggior fosforilazione le MAPs perdono affinità per
le preti del microtubulo.- Premettono di fare entrare determinati settori
microtubulari in instabilità dinamica scindendosi dalle loro pareti.
Centri di organizzazione microtubulare (MTOCs)
I microtubuli non compaiono casualmente in qualsiasi punto del citoplasma, ma sono sempre originati da ammassi posti in luoghi particolari detti centri di organizzazione microtubulare.
I MTOCs si trovano sempre a ridoso di particolari strutture come:a) centriolib) corpuscoli basalic) membrana nucleared) membrana plasmaticae) microtrabecole
Questi centri di organizzazione microtubulare sono in grado di esercitare varie forme di controllo sui microtubuli:
- controllo spaziale: ne controllano il numero, l’orientamento, la polarità, la localizzazione e l’impacchettamento reciproco
- controllo del differenziamento tubulare : regolano la composizione delle pareti del microtubulo.
In studi recenti si è localizzata la -tubulina in prossimità dei centri di organizzazione microtubulare:
- non entra mai nelle pareti dei microtubuli- regola e promuove l’assemblaggio delle altre due
isoforme tubuliniche a livello dei MTOCs.
È da ricordare che i microtubuli sono la principale impalcatura citoplasmatica, che fornisce supporto temporale alle altre strutture filamentose del citoplasma.
Spesso, a livello delle giunzioni con la matrice extracellulare e con le atre cellule, portano anche l’informazione per quanto riguarda la distribuzione dell’intero tessuto.
MOTILITA’ MICROTUBULO-MEDIATA
Nel corso dell’evoluzione si possono notare solamente pochi sistemi i motilità cellulare:
- flagello batterico- motilità dei filamenti di actina- motilità microtubulare
Questi sistemi, sono tra l’altro molto simili tra loro:- sono attribuibili all’interazione ATP-dipendente tra una
struttura polimerica e una proteina che presenta attività ATP-asica
- la proteina che tramite idrolisi di ATP stimolata da ioni metallici permette il movimento è generalmente indicata come proteina motore.
- La proteina motore è in grado di produrre movimento in un unico senso di moto, che è dato dalla polarità della struttura del polimero a cui si lega
Le proteine motore, benché diferenti nei tre tipi di motilità, presentano una sorprendente somiglianza:
1) molecole di alto peso molecolare, formate dall’unione di più polipeptidi
2) presentano ad una delle estremità delle strutture globulari, dette teste
3) le teste acquisiscono capacità di idrolizzare ATP in presenza di ioni metallici (calcio, magnesio, ecc..)
4) l’energia liberata dall’ATP è in grado di produrre il cambiamento conformazionale delle teste che permette l’evento motorio.
5) Ogni proteina motore è caratterizzata da un unico senso di moto, in relazione alla polarità del polimero interagente.
Mentre nel movimento dei microfilamenti di actina interviene solamente la miosina e is ha un unico senso di moto, nei microtubuli si hanno due sensi di movimento sulla medesima direttrice:
- sui microtubuli sono presenti più proteine motore
CIGLIA E FLAGELLI
Le ciglia vibratili e i flagelli sono le strutture in cui il movimento microtubulare mostra la resa termodinamica più alta:
- ciglia vibratili: sono strutture regolar ed allineate parallelamente tra di loro sulla superficie libera degli epiteli di rivestimento. Vibrano su un unico piano.
- flagelli: sono strutture simili alle ciglia, ma generalmente più lunghi (fino a 100 µm) e molto meno numerosi. Il loro movimento è consentito su tutti i piani possibili
Queste strutture devono essere considerate specializzazioni delle superfici cellulari.
Le due strutture, a livello microscopico e funzionale, sono pressoché identiche, quindi si tratta ora solamente delle ciglia vibratili.
Le ciglia vibratili sono costituite da:- porzione libera, detta anche tratto espanso, che ha un
diametro di circa 0,2-0,1 µm ed una lunghezza compresa tra i 5 e i 10 µm. Sono rivestiti da una membrana di circa 9 nm che è in continuità con la membrana plasmatica.
- Porzione immersa, che è una parte immobile immersa nel citoplasma.
In sezione trasversale, al ME, il ciglio risulta composto da una complessa struttura microtubulare, immersa in una matrice poco densa agli elettroni.
In sezione longitudinale, si può osservare che i tubuli, poggiano su in corpuscolo basale e sono paralleli tra loro.
In sezione trasversale si osservano nove coppie di microtubuli disposte a cerchio intorno a una coppia centrale di microtubuli:
- questa struttura 9+2 prende il nome di assonema- oltre l’assonema, fa seguito la porzione infissa nel
citoplasma.
STRUTTURA DELL’ASSONEMA.
Nell’assonema, i due microtubuli centrali sono perfettamente circolari, isolati e distinti tra loro:
- sono circondati da una guaina che li avvolge in maniera elicoidale
- il piano di vibrazione del ciglio è perpendicolare al piano passante per il loro centro.
Le coppie di tubuli disposte a circolo intorno alla coppia centrale sono parzialmente fusi e addossati l’uno all’altro.
Il tubulo più vicino all’interno è chiamato tubulo A:- più all’interno del ciglio- diametro inferiore rispetto al tubulo B- porta legati coppie di bracci uncinati di dineina , una
proteina motore del microtubulo- costituito da 13 filamenti di tubuline (alfa e beta)
Il tubulo B è il tubulo più esterno:- è addossato al tubulo A- la circonferenza parziale del tubulo B è di 10-11
protofilamenti- più largo rispetto al tubulo A
Il tubulo A è connesso sia ai tubuli centrali che al tubulo A laterale:- si connette alla coppia centrale tramite la guaina che li
avvolge, con un filamento lungo 36 nm, chiamato raggio o ponte.
- È connesso al microtubulo A laterale tramite un ponte di nexina.
I bracci uncinati di dineina che protendono dai tubuli A sono rivolti verso i tubuli B e si collegano ad essi in prossimità del movimento grazie all’idrolisi di ATP.
La porzione infissa nel citoplasma comprende:- Piastra basale- Corpuscolo basale
- Sistema di radici e radichette ciliari.
La piastra basale segna il confine tra l’assonema il corpuscolo basale:- può essere situata a ridosso della membrana oppure in
posizione intracitoplasmatica- la coppia centrale di microtubuli si interrompe- le nove coppie di microtubuli A e B proseguono con 9
triplette di tubuli con struttura identica ai centrioli.
Il corpuscolo basale è un cilindretto di lunghezza circa 500 nm e larghezza 300-500 nm:
- le sue pareti sono costituite da 9 triplette di microtubuli, due delle quali (A e B) provengono direttamente dalla porzione espansa dell’assonema.
- A livello della piastra basale le ripete vanno a delimitare una circonferenza
- Il tubulo addizionale è chiamato tubulo C ed è legato al tubulo A della tripletta vicina mediante un filamento spesso 4,5 nm.
- La struttura del corpuscolo basale è molto simile a quella del centriolo.
Le radichette ciliari sono porzioni di filamenti proteici paralleli tra loro che emergono dal corpuscolo basale:
- lungo questi filamenti si alternano zone chiare e zone scure.
- Possiedono proprietà contrattili calcio-sensibili
MICROVILLI
Sono estroflessioni digitiformi del citoplasma rivestite dalla membrana plasmatica.
Hanno diametro di circa 50/100 nm e lunghezza di circa 1 µm.
Sono principalmente formati da fasci di actina , uniti da differenti complessi proteici firmati da:
- fimbrina- villina
Al di sotto dei microvilli vi è una spessa impalcatura citoscheletrici.
La loro principale funzione è quella di aumentare la superficie di assorbimento citoplasmatica.
TRAFFICO VESCICOLARE MICROTUBULO-MEDIATO.
Si ribadisce il concetto che la migrazione di vescicole nel citoplasma non è casuale, ma si svolge sempre su direttrici ben definite, che nella maggior parte dei casi sono date da microtubuli.
Le vescicole, gemmate dal sistema membranoso interno o dal plasmalemma, si muovono lungo i microtubuli grazie all’interazione con proteine motrici, quali la dineina e la chinesina.
Esiste la possibilità, tuttavia, che una parte del traffico vescicolare sia mediata da microfilamenti (F-actina), con una distinzione generale che non è scevra di eccezioni:
- i movimenti radiali si svolgono su binari microtubulari- i movimenti circolari si svolgono su microfilamenti actinici.
L’esempio più palese è dato dal trasporto assonale, che avviene nelle cellule nervose nel trasporto dei neurotrasmettitori:
- vescicole contenenti neurotrasmettitori sintetizzati nella parte centrale del corpo cellulare vengono trasportati fino alla zona presinaptica su binari microtubulari
- si fondono con il plasmalemma e rilasciano il neurotrasmettitori dalla fessura sinaptica.
- Può anche esistere un moto contrario di vescicole vuote per il riciclo di membrana che sfrutta la medesima componente microtubulare dell’assone.
FILAMENTI INTERMEDI.
I filamenti intermedi sono fasci di proteine fibrose stabili e resistenti alla tensione, che si dispongono in una rete che serve a conferire resistenza meccanica.
Il diametro di un filamento intermedio (8-12 nm) è di dimensioni che sono comprese tra quelle dei microfilamenti (6-7 nm) e i microtubuli (25 nm).
La caratteristica peculiare dei filamenti intermedi risiede nella loro stabilità:
- a differenza degli altri componenti de citoscheletro, l’equilibrio tra le molecole proteiche che li costituiscono e quelle libere nel citoplasma è quasi totalmente spostato verso la forma aggregata.
- La stabilità di queste reti di filamenti intermedi sembra addirittura essere inerte ad alcuni rimaneggiamenti della cellula.
Nella vita di una cellula, è necessario un rimaneggiamento delle strutture interne e il mantenimento di una determinata plasticità:
- l’equilibrio dinamico tra tubulina e actina nei microtubuli e dei microfilamenti è facilmente in grado di conferire questa plasticità poiché è facile alterarne l’equilibrio;
- può darsi invece che per quanto riguarda i filamenti intermedi vi siano alcune lacune funzionali.
È stato tuttavia dimostrato che i filamenti intermedi, in alcune cellula, si raggruppano a gomitolo in precise zone e durante la citodieresi si scindono in due parti uguali tra le cellule figlie.
Sembra infatti che le proteine che costituiscono i filamenti intermedi siano suscettibili all’azione enzimatica delle chinasi:
- la fosforilazione enzimatica è uno dei meccanismi di regolazione della formazione dei filamenti intermedi.
Per quanto riguarda la distruzione, questa è affidata a processi di proteolisi, con enzimi calcio-dipendenti che scindono i filamenti in punti selezionati.
La digestione proteolitica dei filamenti intermedi non corrisponde alla depolimerizzazione.
Composizione chimica dei filamenti intermedi.
Le proteine costituenti i filamenti intermedi sono raggruppabili il varie classi a seconda del peso molecolare e delle omologie strutturali.
Nei vertebrati si distinguono 4 classi (I-IV) con localizzazione citoplasmatica ed una classe con localizzazione nucleare (classe V).
Tutte le proteine costituenti i filamenti intermedi possiedono una struttura comune:
- lunga porzione centrale lineare a composizione -elica- Le porzioni –COOH e –NH2 sono variabili.
La formazione delle strutture filamentose avviene grazie a:- assemblaggio dei monomeri in dimeri- assemblaggio dei dimeri in tetrameri- assemblaggio dei tetrameri in strutture composte da 16
dimeri, con formazione di fasci filamentosi del diametro di circa 10 nm.
Classe I e II
Le prime due classi di molecole comprendono le cheratine, che sono suddivisibili in due classi distinte:
- cheratine acide (tipo I): sono molecole con peso molecolare e punto isoelettrico meno elevato
- cheratine neutro-basiche (tipo II): soo caratterizzate da massa molecolare e punto isoelettrico maggiori rispetto alle cheratine di tipo I
I filamenti di cheratina sono sempre eteropolimeri, quindi formati da almeno una cheratina acida e una basica:
- in una cellula devono essere presenti entrambi i tipi.
Classe III
Le proteine della classe III sono proteine che permettono la formazione di omopolimeri, formando quindi filamenti di una sola tipologia.
In opportune condizioni, possono addirittura copolimerizzare, dando origine a filamenti ibridi.
Le principali proteine appartengono alle famiglie di:- vimentina- desmina- proteina acida gliale.
Classe IV
Sono proteine presenti nei neurofilamenti. La proteina a più basso peso molecolare dei neurofilamenti (NFL) polimerizza spontaneamente.
In alcuni casi la NFL può copolimerizzare con le altre proteine dei neurofilamenti a maggior peso molecolare (NFM, NFH), che da sole non possono formare un neurofilamenti:
- la formazione di un neurofilamento dipende da NFL.- La presenza di questa classe determina l’allungamento
degli assoni
La periferina è una proteina che sembrava essere presente solamente nel sistema nervoso periferico:
- di recente si è scoperta la sua presenza nei neuroni del sistema nervoso centrale
- differisce dalle cellule dei neurofilamenti, poiché è molto simile alla desmina e alla vimentina.
Classe V.
Le lamìne sono localizzate a livello della superficie interna dell’involucro nucleare:
- formano un sistema polimerico detto lamina nucleare.
Le lamine sono simili alle cheratine, dato l’alto contenuto di glicine e serina, ma non formano filamenti di diametro 10 nm:
- si organizzano in strutture reticolari con la presenza di tre tipi di lamine
- esistono nei mammiferi le lamine A, B, C.
Queste proteine sono sintetizzate nel citoplasma, ma contengono i segnali per il loro trasporto nel nucleo.
A differenza dei filamenti intermedi citoplasmatici, queste si assemblano a mitosi conclusa quando si deve ricostituire l’involucro nucleare e si disassemblano nel processo mitotico:
- sono importanti nel determinare la scissione del nucleo nel processo mitotico/meiotico.
Questo tipo di proteine possiede una alta specificità per il tessuto a cui appartengono:
- la specificità tissutale è molto utile nella diagnosi dei tumori
- scoprire l’origine tissutale di un tumore aiuta a capire il tessuto da cui si sviluppa, ed è possibile mediante l’analisi dei filamenti intermedi delle cellule tumorali.
Proteine ancillari dei filamenti intermedi.
Anche i filamenti intermedi, come le altre componenti del citoscheletro cooperano nello svolgimento delle loro funzioni mediante proteine associate ai filamenti intermedi (IFAPs):
- contribuiscono all’architettura e al posizionamenti dei filamenti
- alcune malattie genetiche sono correlate alla mancata codificazione di questo genere di proteine, con un
consequenziale collasso o errori di formazione del reticolo dei filamenti intermedi.
e. Endocitosi ed esocitosi
Il trasporto di ioni e piccole molecole (zuccheri e amminoacidi) avviene nella membrana plasmatica attraverso le proteine di trasporto, le permeasi e altre.
Tuttavia la cellula deve poter inglobare altre macromoleocle ed alcuni batteri che devono essere distrutti per mezzo di enzimi lisosomiali:
- questi complessi di maggiori dimensioni sono assunti mediante endocitosi
- l’endocitosi richiede meccanismi cellulari complessi e ampi movimenti della membrana plasmatica con il suo continuo riciclo.
Il processo inverso, con il quale la cellula espelle prodotti di secrezione e prodotti del catabolismo cellulare come rifiuti, si chiama esocitosi.
In alcuni casi, il processo di espulsione di materiale citoplasmatico circondato da plasmalemma può avvenire mediante gemmazione a livello della superficie cellulare.
Nell’innesco di tali meccanismi (gemmazione, esocitosi, endocitosi), ha probabilmente un ruolo fondamentale l’asimmetria del bilayer fosfolipidico della membrana plasmatica:
- lo strato esterno della membrana plasmatica è ricco di colina e contiene numerosi glicolipidi, con la porzione glucidica rivolta all’esterno della membrana plasmatica.
- Lo strato lipidico interno è invece ricco di fosfolipidi con la parte amminoterminale rivolta all’interno
- Si ritiene che la differente confluenza dei due strati determini la scelta preferenziale di endocitosi o esocitosi
ENDOCITOSI E GEMMAZIONE.
L’esocitosi è un processo che avviene in tutte le cellule:
- è massima nelle cellule ghiandolari in cui vi sono massicci processi di esocitosi che prendono il nome di secrezione.
Il processo di secrezione tratta di attività che iniziano nel reticolo endoplasmatico rugoso:
- dl RER gemmano vescicole che vengono immesse nell’apparato di Golgi
- Nel Golgi vengono rielaborate e convogliate in vescicole di secrezione.
- Le vescicole di secrezione si muovono su tracce microtubulari fino al citoplasma superficiale.
- Le vescicole incontrano la barriera di microfilamenti che può essere superata solamente con variazioni locali degli ioni Ca2+.
- La variazione della concentrazione degli ioni calcio avviene grazie a segnali ormonali che si legano a specifici recettori.
L’entrata degli ioni calcio permette l’attivazione di actin severing protein, che scinde i microfilamenti actinici, permettendo il passaggio dei granuli secretori:
- la vescicola secretoria si fonde con la membrana plasmatica e rilascia all’esterno il suo contenuto.
- Il flusso di membrana plasmatica di ritorno è assicurato da fenomeni di endocitosi.
Il turnover è tanto più imponente nelle aree con maggior specializzazione della membrana plasmatica, come ad esempio la parte apicale dell’epitelio ghiandolare:
- il processo endocitico e quello esocitotico si alternano in ugual misura con una elevata velocità.
La gemmazione comporta l’evaginazione di aree della membrana plasmatica con la formazione di vescicole che si chiudono in prossimità del peduncolo che si viene a formare tra i due strati della membrana:
- comporta il distacco di una porzione della membrana plasmatica
- si verifica in alcuni processi di secrezione apocrina, come ad esempio nelle ghiandole della mucosa uterina, nell’epitelio tubarico, nell’estrusione di goccioline lipidiche nella fase di allattamento dalla ghiandola mammaria.
CARATTERISTICHE DEL PROCESSO SECRETORIO.
Il processo secretorio è caratterizzato da specifiche proprietà:1) vettorialità, poiché avviene in specifiche direzioni2) interazione tra membrane, con la formazione di vescicole3) l’interazione tra membrane è conservativa, l’esocitosi non
comporta perdita di membrana4) si formano specifiche strutture pentalaminari nel momento della
fusione tra due membrane.5) le membrane si riciclano nell’apparato di Golgi6) le vescicole di secrezione sono rivestite di clatrina.
La secrezione deve soddisfare precise necessità fisiologiche. Per attuare questo intento esistono differenti modalità:
- secrezione costitutiva : è un processo lento e continuo- secrezione regolata (inducibile) : permette l’accumulo del
secreto ed è attivata da segnali extracitoplasmatici.
Precisi segnali di traduzione sono dati da proteine recettoriali.
ENDOCITOSI
Il termine endocitosi indica tre differenti modalità della cellula di assumere materiale dall’ambiente esterno:
- la fagocitosi- la pinocitosi- l’endocitosi mediata da recettori.
La fagocitosi consiste nella internalizzazione di particelle di dimensioni notevoli, come interi microorganismi o porzioni di altre cellule:
- sono assunte dall’ambiente mediante estese propaggini di membrana
- entrano nel citoplasma sottoforma di grossi vacuoli;
- questi vacuoli si fondono poi con i lisosomi
La fagocitosi viene svolta dai Protozoi a scopo nutritivo e da alcune cellule di organismi pluricellulari a scopo difensivo.
La pinocitosi è un meccanismo per cui la cellula ingloba fluido extracellulare in cui sono contenute anche macromolecole di interesse metabolico.
Avviene con una invaginazione della membrana plasmatica di dimensioni variabili (molto minore rispetto a quelle fagocitotiche), che forma vescicole che sono rilasciate nel citoplasma.
Il termine pinocitosi significa letteralmente “cellula che beve”, tuttavia non è prettamente corretto, poiché la cellula non immette fluidi, ma materiale di diversa natura presente nel fluido extracellulare:
- le varie vescicole pinocitotiche si fondono tra loro dando origine agli endosomi precoci
- gli endosomi precoci tramite le pompe protoniche diventano endosomi tardivi
- gli endosomi tardivi si fondono poi con i lisosomi e digeriscono il materiale ingerito tramite le idrolasi acide;
L’endocitosi mediata da recettori è un processo altamente specifico, in cui le macromolecole da endocitare si legano a determinati recettori specifici:
- è possibile anche a concentrazioni minime di substrato
Ogni recettore lega alla molecola per via stereochimica il proprio ligando e innesca movimenti di invaginazione della membrana sottostante:
- si formano delle vescicole che si fonderanno con gli endosomi precoci.
Per la maggior parte, il materiale ingerito in questi tre processi va incontro a degradazione, fondendosi con i lisosomi.
In altri casi, soprattutto nelle cellule specializzate e polarizzate, avviene il meccanismo della transcitosi:
- il materiale endocitate attraversa la cellula e viene rilasciato dall’altra superficie
- gli endosomi precoci fungono da sede di smistamento, danno cioè origine a vescicole per gemmazione, che contengono materiali differenti e vengono smistate alle varie superfici.
Questo processo, avviene ad esempio nelle cellule endoteliali, in cui dal sangue, il materiale attraversa completamente la cellula per riversarsi nel liquido interstiziale.
Nei neonati, gli anticorpi ingeriti con il latte materno, attraversano le superfici intestinali per transcitosi, passando dal lume allo spazio extracellulare a livello della superficie basolaterale.
FAGOCITOSI
La fagocitosi è un meccanismo innescato dal contatto di grandi aggregati di materiale con la superficie esterna della membrana plasmatica di una cellula fagocitaria.
Il fenomeno non dipende sempre dalla interazione specifica delle due membrane:
- la complementarietà superficiale tra fagocita e “fagocitando” avviene solamente in particolari cellule dei Vertebrati (leucociti e granulociti).
I macrofagi riconoscono gli organismi da fagocitare grazie alla marcatura dell’organismo con un anticorpo (molecola proteica secreta da plasmacellule), legato ad esso mediante il processo di opsonzzazione.
Sul macrofago, solamente alcune porzioni della membrana plasmatica sono adibite alla fagocitosi e sono ricoperte da appositi recettori:
- i recettori possono tuttavia spostarsi su ampie porzioni di membrana per rendere possibile la fagocitosi di organismi di grandi dimensioni
Una volta che si stabilisce il contatto fisico con la particella da ingerire, la membrana plasmatica attua operazioni avvolgenti:
- si estroflette in pseudopodi ai lati della particella- si introflette in una invaginazione in modo da ingerire la
particella.
Tutte queste operazioni si svolgono grazie ad ampi movimenti del citoscheletro, e richiedono energia rilasciata da ATP:
- il materiale fagocitato viene avvolto in vescicole che hanno destino lisosomiale;
I macrofagi hanno sulla loro superficie numerosi recettori, il cui principale scopo è quello di facilitare l’adesione:
- alcuni recettori, tra cui l’Fc per le immunoglobuline, operano per il riconoscimento di particelle opsonizzate (es. batteri).
- Alcuni altri recettori riconoscono dei ligando presenti sulla membrana di altre cellule, normalmente nascosti e visibili in condizioni particolari, rendendole fagocitabili. (ad esempio il mannosio esposto sulla superficie degli eritrociti invecchiati, o la fosfatidilserina sulle cellule andate incontro ad apoptosi).
PINOCITOSI
L’assunzione aspecifica di molecole immerse nel fluido extracellulare si distingue a seconda delle dimensioni delle vescicole che si formano:
- macropinocitosi: forma vescicole di grandi dimensioni con l’incamerazione del materiale extracitoplasmatico con un processo simile alla fagocitosi
- micropinocitosi: si formano piccole fosse nella membrana plasmatica, che si richiudono all’interno in vescicole che hanno un diametro medio di 65 nm circa.
Le vescicole assunte per micropinocitosi si fondono subito insieme aper formare gli endosomi precoci:
- sono formazioni molto dinamiche
- continuano a cambiare forma per partenza e arrivo di nuove vescicole
- alcune vesciche si distaccano per riciclare membrana plasmatica.
Il processo di pinocitosi è un meccanismo costitutivo della cellula e le dimensioni del fenomeno sono tali da operare il movimento di ingenti quantità di membrana plasmatica e di fluidi cellulari.
Le differenze di composizione della membrana plasmatica nei vari luoghi della cellula porta alla formazione di endosomi precoci differenti:
- il materiale endocitate si fonde in grosse vescicole, che attraverso il passaggio su microtubuli diventano endosomi tardivi
- il compartimento endosomiale tardivo, invece, no presenta distinzioni, ma ha significato funzionale e strutturale differente a seconda del tipo cellulare.
ENDOCITOSI MEDIATA DA RECETTORI.
IN questo tipo di endocitosi, in prossimità delle fossette dove inizia l’invaginazione, sono presenti dei rivestimenti spinosi:
- queste fossette sono definite fossette ammantate o rivestite.
- Nei fibroblasti in coltura, le fossette ammantate costituiscono quasi il 2% della superficie cellulare e si ripiegano sul materiale che si lega ai recettori, inglobando la vescicola nel citoplasma.
Oltre ai ligando che si legano ai recettori, nelle vescicole endocitate vi è anche una porzione di fluido extracellulare che viene inglobata:
- vengono internalizzate anche altre molecole contenute nel fluido
- questo meccanismo è definito endocitosi in fase fluida.
Il materiale che riveste le fossette ammantate è di natura proteica e la proteina più comune è la clatrina:
- esamero formato da tre catene pesanti (180 kD) e tre catene leggere (35 kD)
- un esamero ha forma di triscelio, con i tre bracci delle catene lunghe a 120° tra loro e tenuti insieme dalle catene leggere.
Si ritiene che le spinosità siano formate da recettori della membrana che sporgono sul lato citoplasmatico:
- la clatrina si lega a queste porzioni proteiche con l’interazione di adaptine;
- Le vescicole neoformate, che ancora non hanno perso il loro rivestimento di clatrina interagiscono con i microfilamenti (actina)
I trisceli clatrinici formano strutture a maglie pentagonali ed esagonali che si avvolgono a cestello sulle fossette ammantate, obbligandosi a chiudersi in vescicole.
L’assemblaggio dei cestelli di clatrina è stimolato dal legame ligando-recettore sulle fossette ammantate:
- avviene anche se la concentrazione dei ligando è molto bassa
- i complessi recettore-ligando si spostano tutti in regioni ristrette della membrana e al di sotto si inizia l’assemblaggio della clatrina
- l‘aumentare del rivestimento clatrinico porta alla invaginazione della fossetta e alla chiusura in vescicola in cui è contenuto il ligando.
La vescicola ammantata entra nel citoplasma e perde il rivestimento di clatrina:
- la vescicola si fonde con gli endosomi precoci- la clatrina si disassembla e torna in superficie per essere
riutilizzata.
Il pH acido dell’endosoma permette il distacco del ligando dai recettori:- i recettori ormai distaccati si dirigono in un’unica parte
della vescicola, che viene rispedita nel plasmalemma.
- Questo procedimento premette anche il riciclo di membrana
Il ligando passa negli endosomi tardivi, poi nei lisosomi, in cui viene degradato.
L’endocitosi mediata da recettori permette di inserire nella cellula proteine funzionali e metaboliti:
- LDL e transferrina (proteina di trasporto del ferro)- Fattori di crescita come EGF (epidermal growth factor)- PDGF (plateled derived growth factor)- Ormoni (insulina)- Citochine
Anche virus come influenza e HIV possono scegliere questa via per giungere all’interno di una cellula.
Nel caso della transferrina il ligando cede il ferro trasportato e viene riciclato insieme al suo recettore.
Nel caso dell’EGF sia il ligando che il recettore vengono degradati dai lisosomi:
- serve per controllare la capacità di risposta della cellula a fattori di crescita
Certi complessi ligando-recettore non si dissociano negli endosomi e non finiscono nei lisosomi:
- ligando e recettore vengono trasportati al plasmalemma in una superficie differente da quella d’ingresso
- questa modalità avviene per il trasporto di immunoglobuline secretorie.
ENDOCITOSI DI LDL E TRANSFERRINA
I meccanismi di endocitosi mediata da recettori meglio conosciuti sono quelli di:
- colesterolo: molecola necessaria a costruire le membrane
- transferrina: proteina contenente ferro e necessaria per la proliferazione cellulare e la sintesi dell’emoglobina.
Il colesterolo è una piccola molecola lipidica sintetizzata a livello del fegato, in cui è utilizzato per produrre delle grosse particelle sferiche chiamate LDL (low density lipoprotein):
- le LDL contengono 1500 moleocle di colesterolo unito ad acidi grassi, ricoperte da una membrana di fosfolipidi, colesterolo
- la membrana di un LDL contiene una proteina denominata apo-b.
Sulle cellule bersaglio è presente un recettore per la proteina apo-b, a cui si lega l’LDL:
- la LDL viene incorporata dalla cellula in una vescicola ammantata
- perduto il rivestimento di clatrina, le vescicole contenenti LDL si fondono con gli endosomi precoci
- successivamente si distaccano dagli endosomi precoci delle vescicole contenenti LDL che si fondono con i lisosomi, liberando colesterolo e altri lipidi
- nei lisosomi, le proteine apo-b vengono disintegrate.
Mutazioni per il gene del recettore LDL causano la diminuzione o l’impossibilità da parte delle cellule di assumerle:
- aumenta fortemente il livello delle LDL nel sangue - è altissimo il rischio di infarto miocardico.
Il ferro assorbito con la dieta è legato ad una proteina di trasporto detta transferrina:
- lega due ioni ferro- quando lega i due ioni, è detta ferro-transferrina.
Le cellule adibite al metabolismo del ferro contengono nella membrana recettori di natura glicoproteica di lunghezza 180 kD:
- due lunghe catene polipeptidiche di 800 amminoacidi
- ogni molecola attraversa la membrana plasmatica e fa sporgere due catene simmetriche che legano 2 moleocle di ferro-transferrina
Una volta che il recettore si lega alle transferrine, si formano vescicole ammantate che si fondono poi con gli endosomi precoci:
- il ferro viene rilasciato nel citosol dopo essersi staccato dalla transferrina, legandosi ad un’altra molecola detta ferritina.
- i recettori vengono riportati in superficie con la membrana dell’endosoma, si fondono con la membrana plasmatica ed esocitano le transferrine
In questo caso, a differenza della maggior parte delle endocitosi mediate da recettori, manca la fase di demolizione del ligando.
f. Nucleo
i. morfologia e struttura
GENERALITA’
Mentre nei procarioti il materiale genetico è libero nel citoplasma, negli Eucarioti è racchiuso in un involucro membranoso: il nucleo.
Il nucleo è preposto:- alla direzione dei processi sintetici che si svolgono nel
citoplasma.- Alla trasmissione dei caratteri ereditari delle
generazioni cellulari.
Alcune cellule eucariotiche possono essere prive di nucleo (ad esempio gli eritrociti) ma sono cellule altamente specializzate che hanno già sintetizzato i loro prodotti e non vanno incontro a riproduzione.
Mentre sono rare le cellule prive di nucleo, sono frequenti invece le cellule pluriucleate:
- sincizi : sono cellule che si fondono tra loro e mettono in comunicazione il proprio citoplasma (es. fibre muscolari scheletriche);
- plasmodi : sono cellule in cui alla suddivisione del nucleo non è corrisposta una divisione del citoplasma. (es. i megaricociti del midollo osseo, precursori delle piastrine).
Sia nei sincizi che nei plasmodi, un nucleo controlla una porzione di citoplasma, funzionalmente distinto dall’altra parte, controllata dall’ltro nucleo.
Le dimensioni del nucleo sono generalmente proporzionali a quelle del citoplasma:
- il rapporto dell’indice nucleo-plasmatico (NP) è generalmente costante nei vari tipi cellulari
- quando questo rapporto tende ad un accrescimento del citoplasma, la cellula si divide.
Le dimensioni del nucleo sono in rapporto alla quantità di DNA da esso contenute:
- cellule poliploidi sono più grandi di cellule diploidi
Il nucleo è delimitato da un involucro formato da due membrane che hanno un decorso parallelo intervallate da uno spazio chiamato cisterna perinucleare:
- A livello di piccole aree circolari, le due membrane si continuano una nell’altra lasciando un varco nell’involucro nucleare, formando i cosiddetti pori nucleari.
All’interno del nucleo risulta ben distinguibile una formazione sferoidale composta da una parte granulare intervallata da una fibrillare, formando il cosiddetto nucleolo:
- il nucleolo è la sede della sintesi degli RNA ribosomiali (rRNA)e di assemblaggio delle subunità dei ribosomi citoplasmatici.
Il resto del nucleo è formato da:- rete fibrillare
- materiale granulare facilmente colorabile, la cromatina.
La cromatina può cambiare aspetto nelle varie fasi del ciclo cellulare:- normalmente è addensata in cumuli- durante la mitosi si addensa in strutture organizzate
denominate cromosomi.- Parte della cromatina è associata anche al nucleolo
Dal punto di vista chimico la cromatina si compone di DNA e 2 tipi di proteine:
- proteine istoniche- proteine non istoniche.
Dal punto di vista morfologico si distinguono due tipi di cromatina:- eucromatina: filamenti sottili, sparsi e poco colorabili- eterocromatina: organizzata in zolle o granuli molto
colorabili.
Il nucleo con tutte le sue componenti ben distinte si osserva in tutte le fasi della cellula, salvo quando è in corso la divisione.
INVOLUCRO NUCLEARE: STRUTTURA E ULTRASTRUTTURA.
L’involucro nucleare è costituito da due membrane (membrana nucleare interna ed esterna) e da una cavità tra le due detta cisterna o spazio perinucleare.
L’involucro nucleare è in continuità con il reticolo endoplasmatico, il quale è disposto attorno al nucleo con cisterne appiattite, giustapposte l’una all’altra.
La membrana dell’involucro nucleare è in continuità con quella del reticolo endoplasmatico.
La cavità perinucleare è in continuità con il lume del reticolo endoplasmatico.
Le membrane dell’involucro hanno il medesimo spessore delle membrane del reticolo endoplasmatico (6 nm).
La membrana nucleare esterna è coperta di ribosomi sul versante citoplasmatico ed è in continuità con il RER.
La membrana nucleare interna è liscia e in connessione con un materiale denso laminare (lamina nucleare) formato da un reticolo fibroso di natura proteica spesso 25 nm circa:
- la lamina nucleare circonda il materiale nucleare interno- ha funzioni strutturali.
I pori nucleari sono aree circolari del diametro di circa 80 nm delimitate dalla fusione puntiforme delle due membrane (interna ed esterna):
- l’interno di questa area risulta aperto- sia sul versante interno che esterno sporge un complesso
circolare chiamato anulus o complesso del poro.
L’area centrale del poro è parzialmente occlusa da un sottile diaframma, che lascia aperto solamente il canale centrale del poro:
- il passaggio di materiale dal nucleo al citoplasma è sotto uno stretto controllo di compatibilità molecolare
Il complesso del poro è relativamente indipendente dalla membrana:- sono probabilmente uniti alla lamina nucleare
la lamina nucleare ha quindi 2 funzioni:- unire le proteine del complesso del poro- ancorare le fibre dell’eterocromatina periferica. Questa si
interrompe a livello dei pori dove vi sono zone chiare dette canalicoli intracromatinici.
Il numero dei pori varia a seconda del tipo cellulare e dello stadio in cui la cellula si trova:
- maggiormente la cellula è attiva, maggiore è il numero di pori che si riscontrano.
Il complesso del poro
È una struttura cilindrica del diametro di circa 125 nm:- E’ composto intelaiatura a raggi di forma ottagonale
inserita tra un anello citoplasmatico e un anello nucleare - Dall’anello citoplasmatico partono otto filamenti di
lunghezza 30-40 nm che sporgono nel citosol- Dall’anello nucleare sporgono otto raggi che si
congiungono il zona distale in un anello più piccolo detto anello terminale, formando una struttura a cestello detta canestro nucleare
- Tra i due anelli che si trovano a ridosso delle membrane, si notano otto raggi di forma laminare che circondano una apertura centrale
- Nell’apertur centrale si trova il complesso del canale o trasportatore.
In alcune cellule (oociti, tumorali e ghiandolari) sono presenti a livello della membrana nucleare delle strutture chiamate lamelle anulate:
- doppie membrane parallele rivestite da ribosomi- differiscono dalle cisterne del RER poiché contengono
pori e sono continuative della membrana nucleare.
La posizione del nucleo nella cellula è data da una complessa organizzazione citoplasmatica:
- i filamenti intermedi formano un fitto intreccio a sostenere il nucleo
Le due membrane nucleari differiscono per il contenuto proteico:- la membrana nucleare esterna è ricca di proteine molto
simili a quelle del RER- la membrana interna invece contiene proteine per
l’ancoraggio alla lamina nucleare
Le membrane nucleari sono composte da:- 70% di proteine- 23% circa di fosfolipidi- lipidi neutri e colesterolo sono assenti.
INVOLUCRO NUCLEARE: FUNZIONI.
L’involucro nucleare è il responsabile della mediazione tra nucleo e citoplasma.
Il trasporto può avvenire sia in modo passivo che attivo:- Gli ioni e le piccole molecole passano attraverso i canali
acquosi che si formano tra i raggi che sostengono l canale centrale in modalità passiva
- Le molecole di grandi dimensioni, come ad esempio i complessi proteine-RNA, vengono trasportati attivamente con un meccanismo selettivo ATP-dipendente.
Il trasporto attraverso il canale centrale o di trasporto avviene in entrambe le direzioni:
- importazione nucleare: avviene dal citoplasma al nucleo con l’ingresso di proteine nucleari e RNA nucleari
- esportazione nucleare: avviene dal nucleo al citoplasma, con l’uscita dall’involucro dei complessi ribonucleoproteici contenenti i vari tipi di RNA e le proteine spola.
Il passaggio di grossi complessi ribonucleoproteici è permesso dalla dilatazione del canale centrale, che si adatta alle dimensioni delle particelle in transito.
Importazione nucleare
Le proteine che vengono trasportate dal citoplasma al nucleo sono marcate da una sequenza d 4-8 amminoacidi detta sequenza di localizzazione nucleare (NLS).
L’ingresso dei complessi proteici di grandi dimensioni avviene mediante specifiche proteine di trasporto che riconoscono la NLS e importano la molecola, dette importine:
- in primo luogo, si lega alla sequenza NLS una importina con meccanismo che non necessita di energia ed è temperatura dipendente
- In un secondo momento si lega al complesso NLS-importina una seconda importina , tramite un meccanismo che è GTP-dipendente.
- L’importina è in grado di legarsi a recettori specifici sulle neoporine del poro.
L’ingresso nel nucleo avviene grazie all’intervento di altre proteine (ad esempio la proteina Ran, che lega GTP):
- l’importina non attraversa il poro e rimane legata ai recettori
- l’importina attraversa il canale centrale insieme alla macromolecola marcata con NLS, e si dissocia nel nucleo.
Esportazione nucleare.
Il meccanismo dell’esportazione nucleare è molto meno conosciuto di quello dell’importazione. Sembra che anche l’esportazione dal nucleo di complessi ribonucleoproteici (RNP) necessiti di specifici segnali e proteine di trasporto.
Tuttavia non è ancora noto se le equenze segnale d’esportazione siano localizzate sulle proteine o sugli RNA.
Solo recentemente si sono localizzate alcune proteine che sono probabilmente responsabili dell’esportazione degli RNA:
- complesso proteico che lega il nuclear cap : media l’esportazione dei piccoli RNA ricchi di uracile
- HIV -1: molecola capace di esportare gli RNA del virus HIV
- Fattore Ran : sembra essere coinvolto anche nell’esportazione oltre che nell’importazione.
Esistono proteine capaci di spostarsi da nucleo a citoplasma e viceversa, dette proteine spola:
- possiedono specifiche sequenze dette segnali di esportazione nucleare (NES)
- sono sequenze in grado di indurre il trasporto dal nucleo al citoplasma di proteine eterologhe a cui sono legate.
Si ritiene infine che la membrana nucleare sia partecipe:- nella sintesi delle proteine sul versante esterno- nella spiralizzazione della cromatina nelle fasi prima di
meiosi e mitosi.
NUCLEOSCHELETRO.
Nel nucleo interfasico i cromosomi non hanno disposizione casuale, ma una ben precisa localizzazione funzionale:
- sono organizzati in subunità funzionali chiamate domini.- L’organizzazione dei domini dipende da una impalcatura
proteica del nucleoscheletro.
Nella rete di filamenti si possono individuare proteine come actina e spectrina, oltre ad altre componenti:
- proteine dei filamenti intermedi come le lamine- enzimi associati alla duplicazione del DNA- enzimi associati alla trascrizione e al processing dell’RNA
Il nucleoscheletro si compone principalmente da:- lamina fibrosa periferica- rete fibrillare- matrice nucleolare.
La lamina fibrosa periferica è la lamina nucleare:- materiale proteico che forma un reticolo fibrillare
compatto a ridosso della membrana interna del nucleo- le proteine che costituiscono la lamina nucleare sono
denominate lamine, ed appartengono ai costituenti de filamenti intermedi
- le lamine si legano in modo specifico alle proteine intrinseche della membrana interna.
La lamina nucleare svolge un ruolo di fondamentale importanza nel processo di divisione nucleare:
- prima della disgregazione dell’involucro nucleare le lamine vengono fosforilate
- la lamina B rimane legata alla membrana dell’involucro mentre le A e C si disgregano
- al termine della divisione vengono defosforilate e si ripolimerizzano a riformare la lamina nucleare
- sulla lamina si fondono le vescicole e si riforma l’involucro nucleare
- durante questi processi si ha anche la ricostruzione dei complessi del poro
La lamina nucleare fornisce il supporto scheletrico all’involucro nucleare:- interagisce con i pori;- Nelle regioni in cui è presente eterocromatina, presenta
delle strutture perpendicolari all’involucro che sono in contatto con l’eterocromatina.
Nella mitosi e nella meiosi, i cromosomi iniziano a spiralizzarsi proprio in prossimità delle zone di contatto tra la lamina e l’eterocromatina.
La rete fibrillare interna è una rete di filamenti a maglie irregolari che si estende dalla lamina fibrosa fino alla matrice nucleolare:
- accoglie ammassi intercromatinici
Non è ancora accertata la reale esistenza, ma se essa fosse effettiva le funzioni potrebbero essere:
- mantenimento della forma del nucleo- sito di attacco per complessi proteici coinvolti in
processing, trascrizione e splicing dell’RNA- siti di attacco per gli enzimi di duplicazione e riparazione
del DNA- architettura stabile per i lunghi filamenti di DNA.- Ecc..
La matrice nucleolare corrisponde alla parte amorfa del nucleolo.
ii. Cromatina
Nell’involucro nucleare, oltre ad uno o più nucleoli è riscontrabile la cromatina, il componente più abbondante del nucleoplasma.
La cromatina è costituita da un’insieme di strutture granulari o filamentose, chimicamente composta da:
- DNA.- Proteine- Piccola parte di RNA.
In microscopia elettronica si possono distinguere due tipi di cromatina:- una parte poco colorabile, filamentosa detta
eucromatina- una porzione granulare ben colorabile denominata
eterocromatina.
La presenza delle due componenti varia a seconda del tipo di cellula che si considera, e anche a seconda del momento funzionale della cellula stessa:
- l’eucromatina rappresenta infatti la porzione attiva del materiale genetico
- l’eterocromatina è invece la porzione a riposo del DNA, avvolta alle proteine.
Con il ME si possono osservare due tipi di granuli di natura ribonucleoproteica nel nucleoplasma:
- granuli del diametro di 30-50 nm detti granuli pericromatinici
- granuli più piccoli del diametro di 20-25 nm detti granuli intercromatinici.
La restante parte del nucleoplasma si compone di una matrice acquosa in cui sono contenute:
- proteine acide o neutre (circa 450 tipi)- RNA- Sali ionizzati- Lipidi.
Una parte intorno al 30% delle proteine è in continuo turn over con le proteine provenienti dal citoplasma.
Nella cromatina è contenuto tutto il DNA, che è caratteristico di ogni specie:
- il corredo cromosomico è ben visibile durante la mitosi di ciascuna specie
- è caratteristico della specie considerata.
Sia la cromatina che i cromosomi sono costituiti da DNA e proteine, di due classi distinte:
- istoni : molecole proteiche basiche che sono in rapporto 1:1 con il DNA
- proteine non istoniche : molecole acide o neutre di varie dimensioni.
A differenza degli istoni, i rapporti di concentrazione tra DNA e non istoni sono differenti a seconda degli stadi funzionali:
- 0,8:1 per l’eucromatina- 0,3:1 per l’eterocromatina.
DNA
Nel nucleo degli Eucarioti il DNA si trova sempre associato alle proteine, le più costanti sono gli istoni:
- forma strutture caratteristiche chiamate nucleosomi.
La quantità di DNA è costante nei nuclei di ciascuna specie e differisce da specie a specie:
- per avere una idea della quantità di DNA in una cellula, si confrontano cellule nella medesima fase del ciclo cellulare
- nella fase G1 (quella presintetica) il numero dei cromosomi si indica con 2c.
- al termine della fase S (a duplicazione ultimata) il numero di cromosomi è 4c.
Il DNA nucleare si presenta sotto forma di molecole filamentose sempre associate a proteine, andando a costituire i filamenti di cromatina.
Il numero di molecole di filamenti cromatinici è costante in ciascuna specie nelle cellule somatiche.
Il numero può essere osservato solamente in particolar momenti della vita di una cellula, poiché nei momenti intercinetici le molecole sono despiralizzate e impegnate nella trascrizione.
Nel processo di divisione mitotica questi filamenti si spiralizzano più volte su sé stessi e si accorciano sensibilmente:
- nella fase iniziale (metafase e anafase) si trovano sotto forma di bastoncelli allungati chiamati cromosomi.
- Il numero dei cromosomi nella mitosi corrisponde al numero di molecole di DNA presenti nella cellula somatica.
Nelle cellule somatiche l numero dei cromosomi è diploide (2n), ovvero sono presenti coppie di cromosomi omologhi che sono corrispondenti per:
- forma- dimensioni- composizione genica
Ciascuna specie ha un numero di cromosomi diploidi caratteristico:- l’uomo ne ha 46
Il DNA della cromatina si suddivide in unità funzionali dette geni, ovvero sequenze capaci di codificare per un mRNA che codifica una proteina:
- i geni che contengono una informazione proteica sono detti geni strutturali. Sono molto più lunghi dei corrispondenti mRNA
- Geni che codificano per l’rRNA sono detti geni ribosomiali.
- Geni che codificano per i tRNA sono detti geni transfer.
Negli Eucarioti il genoma è molto più vasto rispetto agli organismi procarioti, potendo codificare dai 10000 ai 30000 proteine.
Il DNA di questi geni è presente in un’unica copia in un corredo apolide, ma può anche essere presente almeno due volte nelle cellule somatiche diploidi.
Inoltre, i geni che codificano per rRNA e tRNA sono ripetuti alcune centinaia di volte e sono localizzati in una porzione detta mediamente ripetitiva:
- in queste zone sono ripetute più volte le sequenze che codificano per un particolare gene
- vi sono le sequenze che codificano per gli istoni- sequenze intensificatori e promotori- sequenze funzionali come le sequenze telomeriche e le
sequenze d’origine di replicazione.- Altre sequenze non funzionali
È presente un’altra frazione del DNA detta altamente ripetitiva, formata da brevi sequenze ripetute continuamente:
- non trascrive RNA- non sono chiare le sue funzioni- sono spesso raggruppate come eterocromatina in
prossimità di telomeri e centromero,- può darsi che svolgano un ruolo importante
nell’organizzazione della cromatina e dei cromosomi metafasici.
- In altri casi separano geni di DNA ribosomiale e DNA transfer, sono perciò detti spacers.
I tratti di DNA tra i geni non hanno specifica funzione, degil spaziatori vi sono anche tra i geni strutturali.
Un gene sul DNA presenta sequenze che codificano intervallate da sequenze che non codificano e non permangono nel mRNA:
- introni: sono sequenze che si trovano in mezzo alle sequenze che codificano
- esoni: sono sequenze che codificano effettivamente.
Gli introni sono eliminati (tramite dei tagli denominati splicing) a livello dell’hnRNA nucleare, tramite procedimenti chimici (processing):
- nell’mRNA citoplasmatico non sono presenti le sequenze introniche
Solamente una porzione minore del 50% del DNA codifica per proteine, mentre la parte restante ha ancora funzioni da chiarire.
ISTONI.
Gli istoni sono proteine strettamente associate al DNA della cromatina (e ai cromosomi) che si trovano in rapporto equimolecolare con il DNA.
Sono proteine basiche in quanto possiedono degli amminoacidi in gran parte con catene laterali cariche positivamente:
- arginina- lisina- istidina
Sono molecole relativamente piccole, con un peso che si aggira intorno ai 10-20 kD.
Gli amminoacidi basici formano due braccia che si estendono a partire dalla porzione neutra, di forma globulare. Entrambe sono regolatori del legame con il DNA.
Gli istoni si dividono in 5 classi, nominate con la lettera H:- H1: è l’istone più grande e ricco di lisina, pesa 20 kD- H2A e H2B: sono moderatamente ricchi di lisina e hanno
un peso di 14 kD- H3 e H4: ricchi di arginina. Peso molecolare di 11 kD per
H3 e di 15 kD per H4.
Con l’eccezione di H1, gli istoni sono in quantità equimolecolari con il DNA e la loor unione da luogo ai nucleosomi.
Gli istoni sono sintetizzati durante la fase S, contemporaneamente alla duplicazione del DNA, a cui si legano non appena finisce la duplicazione, assemblando la cromatina.
Le proteine non istoniche sono invece assemblate durante tutta la vita cellulare tranne che nella duplicazione.
PROTEINE NON ISTONICHE.
Le proteine non istoniche rappresentano una classe molto eterogenea di proteine che si legano poco stabilmente al DNA:
- i rapporti con la cromatina di questa classe di proteine variano a seconda delle attività della cellula
- una parte di queste proteine è legata mediante RNA nucleari
Le proteine non istoniche sono per lo più acide (neutre o cariche negativamente), vengono divise in 4 classi
1) ad elevato peso molecolare: sono legate al DNA e agli istoni con la probabile funzione di fornire una impalcatura
2) contrattili: actina, tubuline, miosina, tropomiosina, ecc..
3) regolatrici della trascrizione genica: Sono un gruppo eterogeneo di proteine che si legano al DNA a livello di specifiche sequenze nucleotidiche.
Le modalità di legame e di riconoscimento dipendono dalla conformazione della proteina e da alcuni motivi comuni a vari sottogruppi di proteine regolatrici.
Queste proteine regolatrici sono caratterizzate da due siti specifici:- elica di riconoscimento (ER)- porzione elicoidale di stabilizzazione (ES)
Possono formare dei dimeri:- omodimeri: si legano a sequenze uguali
- eterodimeri: proteine che si possono legare a sequenze differenti.
4) funzione enzimatica: catalizzano le varie attività del DNA nucleare (trascrizione, duplicazione, ricombinazione, riparazione).
Alcune di queste molecole sono relativamente indipendenti dalla cromatina (alcune DNA-polimerasi) altre sono strettamente dipendenti dalla cromatina (RNA-polimerasi)
ORGANIZZAZIONE DELLA CROMATINA.
Il materiale genetico di una cellula, nel nucleo intercinetico si presenta sotto forma di cromatina, che si compone di:
- DNA- Istoni- Proteine non istoniche - RNA appena trascritto.
Al microscopio ottico la cromatina appare come un materiale filamentoso o granulare, composto di:
- porzioni poco colorabili (eucromatina)- porzioni molto colorabili (eterocromatina)
Al microscopio elettronico la cromatina pare una struttura fibrillare con fibre di varie dimensioni avvolte a formare dei grossi ammassi.
In vivo la cromatina si presenta in filamenti dello spessore di 30 nm, che corrisponde alla struttura del filamento nativa.
La struttura fondamentale, invece, si compone di granuli uniti da un filamento di DNA, formando una struttura fondamentale chiamata nucleosoma:
- questi granuli di natura istonica (core) hanno un diametro di circa 10 nm;
- sono avvolti per 1 giro e ¾ da un filamento di DNA, che per un breve tratto prosegue senza istoni e poi si arrotola ad un altro istone.
- Questa struttura filamentosa è chiamata a filo di perle.
I tratti che collegano i nucleosomi (linker) sono formati da 10-90 paia di basi (bp), mentre la porzione di DNA avvolta è di circa 146 bp.
Ciascun core è formato da due cilindretti appiattiti e sovrapposti detti eminucleosomi:
- ogni eminucleosoma è formato da istoni H2A, H2B, H3, H4.
- Ogni nucleosomi è dunque un ottametro sul quale si avvolge il filamento di DNA per una lunghezza di 146 bp.
L’istone H1 svolge invece un ruolo importante nella formazione di strutture di ordine superiore:
- con il corpo centrale si lega ad un nucleosomi- con i due bracci si lega ai nucleosomi adiacenti- è il responsabile della struttura con diametro 30 nm.- La struttura che si viene a formare è un’elica in cui i
nucleosomi si avvolgono nella tipica struttura a solenoide.
L’attività di condensazione dell’H1 dipende dal suo grado di fosforilazione.
Osservazioni sperimentali hanno dimostrato la presenza di strutture di ordine superiore alla fibra di 30 nm:
- l’ipotesi è che la fibra di 30 nm si avvolga ad anse radiali.- È stata dimostrata la presenza di un’impalcatura di
proteine non istoniche che avvolge con una struttura ad anse il solenoide.
- Il filamento ad anse ha diametro di circa 300 nm.
EUCROMATINA ED ETEROCROMATINA.
A livello strutturale non sono ancora totalmente chiare le differenze tra eterocromatina (granulare e colorabile) e eucromatina (fibrosa e poco colorabile):
- nell’eterocromatina si ha una condensazione in ulteriori livelli strutturali
- non si conoscono le modalità con cui la eterocromatina si leghi alle proteine non istoniche ne i rapporti di concentrazione.
Sono meglio note le attività dei due tipi di cromatina per quanto riguarda la trascrizione del DNA:
- l’eterocromatina non è attiva- si può dividere in due sezioni (facoltativa e costitutiva).
L’eterocromatina facoltativa è una porzione di eterocromatina che all’occorrenza può essere trasformata in eucromatina ed essere trascritta:
- un esempio può essere il corpo di Barr
L’eterocromatina costitutiva invece è cromatina che non viene mai trascritta:
- si trova in zone particolari (es. centromero oppure associato al nucleolo)
- si trova in punti del centromero con significato strutturale- è sempre allo stato condensato.- Formata da DNA altamente ripetitivo.
Il passaggio da eterocromatina facoltativa ad eucromatina può essere indotto da specifici segnali chimici provenienti dal citoplasma.
La percentuale di eu ed eterocromatina in una cellula varia a seconda della sua attività:
- un neurone ha un nucleo quasi completamente eucromatico a causa della sua intensa attività sintetica
- un eritroblasto, completata la fase di accrescimento, prima di perdere il nucleo, ha un nucleo quasi completamente eterocromatico.
L’eterocromatina facoltativa, può essere determinata dalla presenza di repressori:
- svolge un ruolo importante nell’equilibrio genico degli animali che hanno determinazione cromosomica del sesso
Negli animali, è presente una coppia di cromosomi sessuali (o eterocromosomi) che determinano il sesso dell’individuo:
- nella femmina sono presenti due cromosomi X uguali tra loro
- nel maschio è presente un X e un cromosoma più piccolo Y assai povero di geni.
Nelle femmine, il secondo cromosoma X è represso in una passerella eterocromatina nota come corpo di Barr con lo scopo di avere equilibrio genico.
Negli individui maschi, il cromosoma sessuale Y non è invece represso, poiché esso esprime i geni della mascolinità:
- l’attività delle cellule pascili, che sono prive del corpo di Barr, risulta identica a quella delle cellule femminili con un solo X attivo
- vi è equilibrio genico e trascrizionale.
CROMOSOMI
I cromosomi sono dei bastoncelli di cromatina addensata:- prima di dividersi, il DNA e le proteine della cromatina si
duplicano- Il cromosoma è l’unione di due cromatidi fratelli, due
filamenti paralleli di cromatina condensata, identici come composizione genica.
- I due cromatidi si uniscono in una struttura detta centromero.
- Nella divisione i due cromatidi che formano un cromosoma si separano e migrano ai poli opposti
- Al termine della divisione, le cellule figlie hanno un cromatidio ciascuna.
Al microscopio ottico sono osservabili i cromosomi metafasici a forma di bastoncello, lungo la cui struttura si nota una strozzatura, rappresentata dal centromero, che è il punto di unione dei due cromatidi:
- metacentrico : se il centromero si localizza a metà cromosoma
- submetacentrico: se il centromero individua bracci ineguali
- arcocentrico: se il centromero si trova in prossimità di un estremo.
Le estremità dei cromosomi, individuate dal centromero si chiamano telomeri.
Al microscopio ottico, al centro del centromero si intravvede un’area bianca detta cinetocore:
- sul cinetocore si attaccano le fibre del fuso che dirigono gli spostamenti del cromosoma
- all’inizio della divisione, quando il cromosoma è composto di due cromatidi fratelli, ogni cromatide ha il proprio cinetocore orientato dalla parte del fuso.
Al microscopio elettronico, si osserva il cinetocore come una struttura discoidale a tre strati:
- piastra del centromero: è il disco esterno, che si lega alle fibre del fuso mitotico
- intermedia: è una porzione poco densa agli elettroni intermedia tra i due dischi
- interna: è un disco che si lega alla cromatina del centromero.
In molti casi al piastra è rivestita da fibre che si collegano al’esterno formando la corona.
CARIOTIPO E MALATTIE
Ogni specie possiede un corredo cromosomico caratteristico, per numero e morfologia dei componenti:
- l’analisi viene attuata sui cromosomi della metafase, poiché sono allo stadio maggiormente condensato.
- Ogni cromosoma possiede, dopo la duplicazione, due cromatidi fratelli
Il corredo cromosomico delle cellule somatiche è diploide (2n) poiché vi sono coppie di cromosomi che corrispondono per forma, struttura, dimensioni, serie delle informazioni contenute:
- sono detti cromosomi omologhi- solamente nelle cellule prodotte per meiosi si ha un
corredo aploide, indicato con n.
in tutti gli organismi la cui determinazione del sesso avviene geneticamente, il cariotipo del maschio differisce da quello di una femmina per una coppia di cromosomi detti cromosomi sessuali.
Le restanti coppie sono corrispondenti e sono definite autonomi.
I cromosomi sessuali contengono i geni che portano alla formazione del sesso:
- eterogametico o digametico: il sesso che produce la coppia di cromosomi differenti tra loro (es. l’uomo maschio)
- omogametico : il sesso che produce gameti aploide tutti con lo stesso tipo di eterocromosoma (o cromosoma sessuale).
Nell’uomo sono presenti:- 22 autosomi sia nel maschio che nella femmina- una coppia XX nella femmina- una coppia XY nel maschio.
La formula diploide tipica di una specie si nomina euploide, mentre quella che presenta lacune o eccessi di cromosomi si definisce aneuploide:
- i casi di aneuploidia comportano gravi malformazioni patologiche oppure la morte
- nell’uomo sono pochissimi i casi di aneuploidia compatibili con la vita e difficilmente presentano individui in grado di riprodursi.
Fra le più famose e frequenti si annovera la sindrome di Down o trisomia del 21 dovuta alla presenza di un cromosoma omologo in più nel 21esimo cromosoma:
- comporta malformazioni cerebrali e di altro genere- si caratterizza per la presenza dell’occhio a mandorla- è più frequente nei nati da donne over 40.
Tra le sindromi che colpiscono i cromosomi sessuali vi sono:- sindrome di Turner: caratterizzata dalla mancanza di un
cromosoma sessuale (X0). Gli individui affetti da questo cariotipo con 44+X cromosomi sono femmine con gravi malformazioni all’apparato genitale
- sindrome di Klinefelter: caratterizzata nei maschi sterili dalla presenza di un cromosoma X aggiuntivo.
Altri generi di aberrazioni cromosomiche che non comportano la variazione del numero di cromosomi sono:
- delezione: perdita di segmenti del cromosoma- duplicazioni: raddoppio di segmenti del cromosoma- traslocazione: scambio di porzioni di cromosoma tra
cromosomi differenti- inversioni: segmenti orientati in modo capovolto rispetto
alla sequenza abituale.
Benché questo tipo di variazioni non siano sempre vantaggiose, si ritiene siano la causa primaria del processo evolutivo, poiché fonte di variabilità.
ORGANIZZAZIONE MOLECOLARE DEI CROMOSOMI.
Ogni cromosoma contiene una sola molecola lineare di DNA, è cioè una struttura uninemale.
Alla base dell’organizzazione del DNA vi sono i nucleosomi:- formano un filamento di 30 nm
Un modello dell’organizzazione del DNA, detto a fibrilla elicoidale ipotizza che il filamento di DNA+istoni di 30 nm si ripieghi varie volte su sé stesso formando un filamento di notevoli dimensioni.
Un altro modello tiene conto anche delle proteine non istoniche presenti nel nucleoplasma:
- ritiene che vi sia uno scheletro (scaffod) di natura proteica indipendente dal filamento di nucleosomi
- nello scaffod vi sono proteine non istoniche, tra cui due principali (es. tropoisomerasi, responsabile dei superavvolgimenti del DNA).
- La forma ad anse radiali che ha un diametro di circa 300 nm si spiralizza ulteriormente avvolgendosi allo scaffod, formando un filamento di 700 nm.
Il DNA è un filamento continuo, che in piccola parte aderisce allo scafford nei siti SAR con tratti longitudinali ricchi di A-T e in gran parte si espande lateralmente.
RNA NUCLEARI
Circa il 5% dell’RNA di una cellula ha localizzazione nucleare:- è un RNA nettamente differente da quello citoplasmatico- sono anche i precursori degli RNA citoplasmatici- la loro funzione è probabilmente connessa alla cromatina.
Tutti gli RNA originano dal DNA e sono subito associati a delle proteine formando ribonucleoproteine (RNP).
Circa il 70% degli RNA nucleari sono i precursori degli RNA ribosomiali.
Il rimanente 30% comprende grosse molecole associate a polipeptidi che si trovano in parte nel nucleoplasma e in parte associati alla cromatina:
- sono gli hnRNA e rappresentano i precursori degli mRNA citoplasmatici
Altri tipi di RNA sono presenti in quantità molto inferiori sempre associati alla cromatina:
- RNA primer: coinvolti nella duplicazione del DNA- snRNA: sono detti piccoli RNA nucleari.
NUCLEOLO.
È l’organulo intranucleare deputato alla biosintesi dei ribosomi (splicing dei geni e complessazione dell’rRNA con proteine per formare le subunità ribosomiali):
- corpuscolo molto sferico in posizione eccentrica- associato con masserelle di eterocromatina.- Le dimensioni variano a seconda dell’attività della cellula.- Assume coloranti basici poiché ricco di rRNA
Il numero di nucleoli contenuti in una cellula può essere differente, ma solitamente corrisponde al grado di ploidia:
- e n’è uno in una cellula aploide- due in una diploide- ecc..
Si compone di tre parti:- parte granulare: costituita da granuli di diametro 15-20
nm che sono della medesima natura dei ribosomi (rRNA e proteine)
- parte fibrillare: contiene fibrille elettrodense di 5-10 nm poco distinte tra loro fatte di DNA, RNA e proteine
- parte amorfa: poco colorabile, contiene DNA non in fase di trascrizione.
Il nucleolo non è sempre presente nella vita della cellula:- scompare nella seconda parte della profuse- ricompare verso la fine della telofase.
Durante la profuse il nucleolo aderisce ad un certo cromosoma, formando gli organizzatori nucleolare:
- contengono molti geni ripetuti per la sintesi di rRNA- a livello di questi si riforma il nucleolo una volta ultimata la
mitosi.- Corrisponde alla pars fibrillaris.
Nelle cellule dell’uomo sono presenti 10 organizzatori nucleolare, tuttavia quando si forma il nucleolo questi si fondono tra loro.
iii. Ciclo cellulare
Il periodo che intercore tra l’origine di una cellula da una precedente divisione fino a quando la cellula si divide a sua volta costituisce il ciclo cellulare o ciclo vitale della cellula.
Generalmente il ciclo comprende quattro fasi:- la cellula neoprodotta si sviluppa- replica i propri costituenti molecolari- si divide in due cellule figlie.
La prima fase è detta fase G1, in cui la cellula accresce il proprio citoplasma aumentando di volume.
La fase centrale è detta fase S (di sintesi), in cui la cellula duplica il proprio DNA nucleare.
Dopo la fase S è presente un’altra fase G2, in cui la cellula continua a sintetizzare materiali citoplasmatici.
La vita della cellula culmina con la fase M (o mitosi), in cui il materiale nucleare si condensa in cromosomi, che vengono ripartiti tra le due cellule figlie insieme agli organuli citoplasmatici. Nella fase M avviene il processo di divisione mitotica.
L’intera vita della cellula (G1, S, G2, M) comprende generalmente un periodo che può durare dalle alcune ore a qualche decina di giorni.
Le fasi G1, S, G2 costituiscono un periodo detto di intercinesi (o interfase):
- la regolare alternanza delle quattro fasi avviene nelle popolazioni cellulari che costituiscono i tessuti labili, che vanno cioè incontro ad un continuo ricambio cellulare.
La fase G1 vede i processi di:- trascrizione del DNA e sintesi di proteine a livello del
citoplasma.- La maggior parte dei costituenti citoplasmatici viene
prodotta in fase G1.
La fase S vede la sintesi di:- nuovo DNA (duplicazione)- nuovi istoni che entrano nel nucleo e vanno a costituire
nuova cromatina.
In fase G2 il citoplasma sintetizza nuove proteine che sono destinate alla membrana e all’apparato mitotico:
- vengono prodotti i microtubuli che andranno a costituire il fuso per la separazione dei cromosomi
- sono sintetizzati anche vari enzimi.- È sostanzialmente un periodo di preparazione alla fase M
Le cellule che vanno incontro ad un profondo differenziamento (es. neuroni e tessuto muscolare cardiaco) sono incapaci di dividersi e formano i tessuti perenni:
- nei tessuti perenni la fase G1 si protrae all’infinito senza che vi sia la duplicazione del materiale genetico (assente la fase S e le altre fasi).
- Questa quiescenza delle cellule dei tessuti perenni è detta fase G0
Molte cellule, dopo una serie di cicli vanno incontro alla fase G0, divenendo incapaci di dividersi e solitamente andando incontro alla morte cellulare.
I gameti sono il frutto di una particolare divisione cellulare detta meiosi:- consiste di una fase S seguita da due fasi M successive- il risultato consiste in 4 cellule aploidi con patrimonio
genetico dimezzato.
Il controllo della vita cellulare è basato sull’azione di due gruppi di proteine:
- cicline : hanno cicli regolari di sintesi e degradazione- proteine chinasi ciclina-dipendente ( cdk ): sono sempre
presenti nella cellula.
FASE G1.
Durante il periodo di crescita le cellule comunicano tra loro:- una cellula non è indipendente ma si scambia fattori di
crescita ormonali- i fattori di crescita ormonali inducono determinati proto-
oncogeni.
Una mutazione dei proto-oncogeni fa si che la crescita di una cellula sfugga al controllo:
- patologicamente parlando si ha il cancro.
Nel corso della fase G1 la cellula sintetizza i vari tipi di RNA partendo dal DNA per poi sintetizzare proteine regolatrici ed enzimi:
- alcuni RNA passano al citoplasma dopo processing nucleare (hnRNA > mRNA)
- A differenza dei Procarioti, nelle cellule eucariotiche la sede di trascrizione è nel nucleo ed è differente da quella di traduzione che avviene nel citoplasma.
La sintesi degli RNA richiede l’intervento di almeno tre differenti RNA-polimerasi:
1) RNA-polimerasi I: trascrive i precursori degli rRNA
2) RNA-polimerasi II: trascrive i precursori degli mRNA (hnRNA) e gran parte degli snRNA
3) RNA-polimerasi III: trascrive molti RNA di piccolo peso, tra cui i tRNA e l’RNA 5S extranucleolare dei ribosomi.
Le RNA-polimerasi si legano in particolari siti del DNA con sequenze ripetute A-T dette promotori:
- iniziano la lettura in uno solo dei due filamenti in direzione 5’-3’.
- Costituiscono catene di nucleotidi complementari a quelle del DNA
- Particolari sequenze (stop) indicano alla RNA-polimerasi il punto in cui attuare il distacco
- Gli istoni sono completamente allontanati durante questo processo.
Trascrizione e maturazione di rRNA.
Il processo di trascrizione dell’RNA è stato studiato grazie all’osservazione degli organizzatori nucleolari:
- si presenta come un filamento esteso per alcune centinaia di µm
- possiede tratti lunghi circa 4,5 µm in cui vi sono fibrille laterali disposte in ordine di lunghezza crescente
- a questi sono alternati dei tratti di 2 µm senza fibrille laterali, detti spacers.
Ciascun tratto dell’organizzatore nucleolare codifica per un gene ribosomiale:
- l’asse è costituito da DNA - le fibrille sono ribonucleoproteine (RNP)- gli spacers sono filamenti di DNA senza fibrille non
trascrivibili.
L’esame delle sequenze dimostra che:- alla base delle fibrille, sulla catena del rDNA è presente
un granulo che è la RNA-polimerasi I- le fibrille laterali hanno lunghezza crescente in quanto
sono a differente avanzamento della trascrizione.
I ribosomi prendono origine nel nucleolo a partire dalla porzione fibrillare, passando a quella granulare e infine giungendo nel citoplasma.
Il nucleolo può essere considerato come un insieme di geni uguali tra loro che trascrivono l’rRNA, che ha la particolarità di:
- legarsi subito con le proteine a formare il precursore delle subunità ribosomiali
- restare a lungo in relazione con il DNA di origina.
Il gene ribosomiale trascritto genera un complesso di 45 S, che ha un peso molecolare molto superiore a quello degli rRNA dei ribosomi citoplasmatici di 28, 5,8 e 18 S:
- il precursore di 45 S subisce varie modificazioni prima di originare gli rRNA definitivi dei ribosomi
L’RNA di 45 S appare come una fibrilla laterale, che legato alle proteine forma unità (RNP) con coefficiente di sedimentazione 80 S:
- le RNP si staccano dal DNA quando sono mature formando dei granuli
- l’RNA contenuto in esse subisce il processing.
Il processing consiste nella metilazione d’alcune catene del RNA 45 S e nell’idrolisi delle sequenze non mutilate.
I granuli di 80 S vengono subito divisi in:- un granulo minore con un RNA di 18 S che passa subito
nel citoplasma a formare la subunità minore del ribosoma- un granulo di 65 S contenente un RNA 32 S e un RNA 5
S proveniente da altre aree del genoma
I granuli da 65 S formano la pars granularis del nucleolo:
- perdono una componente proteica e parte dell’RNA 32 S, trasformandosi in un granulo di 60 S.
- Questo granulo di RNP (subunità maggiore del ribosoma) è composto da RNA 28 S e 5,8 S frammentati.
- Il granulo di 60 S passa nel citoplasma come subunità maggiore.
Negli umani, è presente il fenomeno della ridondanza genica, che consiste nella ripetizione per alcune centinaia di volte delle sequenze che codificano per RNA o proteine molto necessarie:
- tRNA- rRNA ribosomiali- istoni- RNA 5 S
Trascrizione e processing degli RNA messaggeri.
Gli mRNA citoplasmatici sono trascritti sotto forma di hnRNA e subito complessati con proteine:
- prima di passare alla forma di messaggeri citoplasmatici subiscono processi di metilazione, idrolisi, trasferimento su proteine particolari
- sono trascritti sotto forma di fibrille a partire dai geni strutturali con un meccanismo simile a quello per gli rRNA, ma sono di lunghezza differente a seconda del gene trascritto
Le maggiori lunghezze degli hnRNA rispetto agli mRNA sono dovute alla presenza degli introni, sequenze che no codificano per un amminoacido ma ugualmente trascritte.
Appena trascritto, l’hnRNA viene complessato con:- un cap costituito da metil-GTP che protegge l’RNA
nascente in posizione 5’- una coda poli-A, formata da 100-200 nucleotidi di adenina
che ne incrementa la stabilità
Successivamente l’hnRNA subisce il processo di splicing ad opera di enzimi detti spliceosomi, i quali:
- riconoscono le estremità degli introni e li rimuovono- uniscono le sequenze esoniche- dipendono da snRNA
Questo processo di maturazione dell’mRNA avviene probabilmente in siti intercromatinici chiamati cluster.
Trascrizione e maturazione dei tRNA.
Sono prodotti da sequenze di geni separate da spacers con le stesse modalità per le altre trascrizioni:
- contiene tratti complementari agli spacers in estremità 5’ e 3’
- questi tratti sono rimossi in fase di maturazione da una ribonucleasi che è legata al piccolo RNA nucleare M1.
DUPLICAZIONE DEL DNA NUCLEARE E FASE S.
Nella fase S il materiale genetico viene duplicato, passando da 2n a 4n, in modo che le due cellule figlie abbiano un corredo cromosomico 2n ciascuna:
- nella fase G2 ogni fibrilla cromatinici contiene due molecole di DNA che si avvolgeranno a fare i cromatidi di ogni cromosoma
La duplicazione del DNA è fondata su un modello semiconservativo:1) si srotola la doppia elica nel punto in cui inizia la
duplicazione2) su ciascun polinucleotide ne viene sintetizzato
uno nuovo con basi azotate complementari.
Si vengono a creare due molecole identiche all’elica madre costituite da un filamento appartenente alla vecchia e un filamento appartenente alla nuova.
Un enzima antielicante chiamato elicasi apre la catena individuando i due filamenti. I due filamenti si suddividono in:
- elica principale: sulla quale la sintesi avviene da 3’ a 5’- elica secondaria: sulla quale la scrittura avviene in
direzione 5’ a 3’.
Sul filamento principale un’enzima DNA-polimerasi ∂ legge il filamento e trascrive direttamente un filamento di DNA 5’-3’ complementare al principale.
Sul filamento secondario, il metodo di scrittura è molto più complesso:- un enzima RNA-primasi trascrive dei filamenti d’innesco
detti primer, - la DNA-polimerasi è incapace di leggere in direzione 5’-
3’, quindi sostituisce alle sequenze primer di RNA dei corti filamenti di DNA della lunghezza massima di 1000 nucleotidi (frammenti di Okazaki)
- enzimi tipo ligasi uniscono i vari frammenti completando la formazione dell’elica.
La duplicazione del DNA ha una velocità relativamente bassa, di 2 µm/min:
- se la duplicazione avvenisse in un solo punto occorrerebbero dei giorni per duplicare la molecola del DNA eucariotico
- in realtà il processo impiega solamente alcune ore, poiché la duplicazione inizia in più punti, e i frammenti sono successivamente uniti dalle ligasi.
Durante la duplicazione i nucleosomi si separano dal DNA, ma sembra si leghino subito dopo la duplicazione della catena.
Contemporaneamente alla sintesi del nuovo DNA, nella fase S, avviene la sintesi citoplasmatica degli istoni:
- nuovi istoni si portano subito nel nucleo e si legano con le nuove molecole in maniera casuale tra vecchi e nuovi
FASE G2.
Dopo avere sintetizzato molecole e organuli nella fase G1, duplicato i componenti della cromatina nella fase S, la cellula inizia un periodo del suo ciclo vitale in cui prepara la propria divisione cellulare:
- ha inizio la sintesi dell’apparato mitotico- si iniziano a sintetizzare i microtubuli del fuso.
I centrioli, sono stati duplicati in G1 e rappresentano uno dei centri di organizzazione microtubulare (MTOCs).
Altre proteine globulari dei microtubuli sono fabbricate in G2 e poi polimerizzate.
Nella fase G2 vengono anche sintetizzate:- componenti delle membrane che sono utilizzati per la
costruzione delle membrane plasmatiche delle due cellule figlie.
- La cicline B, che poi entra in unione con la cdk per formare il MPF che induce la cellula ad entrare in mitosi.
DIVISIONE MITOTICA (FASE M).
Formazione dell’apparato mitotico
All’inizio della fase M:- i cromosomi si spiralizzano- si formano i costituenti dell’apparato mitotico
L’apparato mitotico si compone di:- centrioli- materiale pericentriolare- fuso mitotico (fasci di microtubuli che collegano i due
centrioli)
All’inizio della mitosi i diplosomi (coppie di centrioli disposti perpendicolarmente) sono già stati duplicati:
- sono circondati da un’area tondeggiante detta centrosoma
- all’inizio della mitosi i centrosomi sono circondati da raggi di microtubuli che formano le astrosfere.
- I due centrosomi della cellula si vanno separando e tra loro si evidenzia una struttura fusiforme, è il fuso mitotico.
Il fuso mitotico è costituito da due gruppi di microtubuli polari che partono da ciascun centrosoma e si incontrano al centro del fuso:
- quando la membrana nucleare scompare, compare un secondo fuso che parte dai centrosomi e si lega ai cinetocori dei cromosomi
- i cromosomi si dispongono al termine della profuse lungo l’asse equatoriale della cellula, lungo un piano che viene definito equatoriale, ortogonale alle fibre del fuso.
- In metafase è completo l’apparato mitotico.
Fasi e significato della mitosi
Il primo stadio del processo mitotico è denominato profase:- nel citoplasma si organizza l’apparato mitotico- tutta la cromatina si trova sotto forma di cromosomi al
termine della profase.- Ogni cromosoma appare come un duplice filamento,
poiché costituito da due cromatidi fratelli uniti a livello del centromero.
- Verso la fine i nucleoli si disintegrano legandosi ai cromosomi
- Si disgrega l’involucro nucleare (si disperde nel reticolo endoplasmatico o si addossa alle fibre del fuso)
Con il termine prometafase si individua uno stato intermedio che intercore tra:
- la dissoluzione dell’involucro nucleare- l’organizzazione dei cromosomi sul piano equatoriale da
opera dei microtubuli del fuso
Il secondo stadio è detto metafase, in cui i cromosomi si trovano allineati sul piano equatoriale della cellula con i centromero diretti verso il centro:
- i cromosomi costituiscono una figura a forma di stella detta aster o piastra metafasica.
- I cromosomi raggiungono il massimo livello di spiralizzazione, salvo che a livello del centromero.
- Ai due cinetocori del centromero di ogni cromosoma sono collegate le fibre del fuso mitotico che dividono i due cromatidi
La localizzazione dei cromosomi al piano equatoriale dipende dalla capacità dei cinetocori di legarsi ai microtubuli del fuso e dall’azione di proteine motore.
La terza fase è definita anafase e viene distinta in due sotto-momenti:- anafase I: i cromosomi sono tirati verso i due poli dalle
fibre del fuso, verso i centrosomi. I cromatidi identici si scindono e ognuno migra verso un polo differente
- anafase II: all’allontanamento dei cromosomi dal piano equatoriale si somma anche un allontanamento dei due poli, che divergono.
L’ultimo stadio è rappresentato dalla telofase, in cui si ha la ricostruzione dell’involucro nucleare:
- i cromatidi sono diventati cromosomi delle cellule figlie- ogni polo possiede un corredo cromatidico identico- i cromatidi si vanno despiralizzando- si riforma il nucleolo
La formazione della membrana nucleare avviene per la fusione di:- lamine defosforilate che ricreano la lamina nucleare
(strato proteico sottostante al nucleo)- vescicole sintetizzate nuovamente nel RER
- vescicole appartenenti al vecchio nucleo
Con la formazione dei due nuovi nuclei intorno ai cromosomi figli si riformano anche i pori nucleari e tutte le proteine di membrana presenti nel nucleo:
- l’apparato mitotico si va depolimerizzando- i centrioli restano inalterati.
L’ultimo processo che completa la divisione delle cellule è quello di citodieresi:
- la cellula presenta una strozzatura in posizione equatoriale, ad opera di fibre di actina e miosina disposte a circonferenza sotto la membrana nucleare.
- le membrane si introflettono, si fondono e si staccano le due nuove cellule con i nuclei figli.
- le nuove cellule sono geneticamente identiche, la mitosi è un processo conservativo
DIVISIONE MEIOTICA.
La divisione meiotica avviene esclusivamente per le cellule germinali, quelle destinate alla formazione dei gameti:
- è l’ultimo evento di divisione della gametogenesi- ha come scopo la formazione di cellule aploidi, differenti
tra loro per quanto riguarda il patrimonio genico.
La meiosi è quindi la base della riproduzione sessuata, che consente un ampio rimescolamento del patrimonio genico:
- ha determinato la scelta di questo meccanismo riproduttivo nell’evoluzione
La fonte di diversità tra gli individui figli rispetto ai genitori è data da:- rimescolamento delle informazioni presenti- unione di due genomi differenti- mutazioni.
La riproduzione sessuale di un individuo è data dalla fusione di due cellule aploidi dette gameti:
- il gamete maschile è lo spermatozoo- il gamete femminile è l’ovulo, una cellula di grandi
dimensioni poiché contenente parecchi materiali di riserva.
L’unione tra i due gameti è detta fecondazione, che da origine ad una cellula diploide detta zigote:
- dallo zigote, per successive mitosi si origina il nuovo individuo
Le cellule somatiche degli organismi pluricellulari sono generalmente diploidi:
- i cromosomi sono sempre presenti in doppia copia- si presentano copie di cromosomi omologhi,
corrispondenti per forma, dimensioni e contenuto genico.
I gameti, dopo la divisione meiotica, possiedono solamente metà del patrimonio genico della cellula diploide che li ha formati:
- di ciascuna coppia dei cromosomi omologhi viene ereditato solamente uno
- ricostituendosi con il gamete dell’altro sesso, si ricostruisce il patrimonio genetico diploide nello zigote
Ciascuna delle coppie di omologhi presenti nelle cellule di un organismo a riproduzione sessuale è costituita da:
- un cromosoma di origine materna- un cromosoma di origine paterna
La meiosi porta alla formazione di 4 cellule aploidi a partire da una cellula diploide che ha solamente una fase S, mentre vede due divisioni nucleari consecutive.
Il passaggio di un cromosoma paterno o materno in un gamete è totalmente casuale, cosicché si possono ottenere 223 combinazioni differenti solamente in un gamete.
Un altro processo di rimescolamento dei geni è dato dal crossing-over:- geni presenti su cromosomi differenti possono in seguito
trovarsi su un solo cromosoma- permette un’ampio rimescolamento genico.
Né deriva che i gameti di un individuo sono sempre differenti tra di loro dal punto di vista genetico:
- si possono avere eventi che danno luogo ad una ampia variabilità anche tra loro
- questo processo aiuta enormemente il processo di selezione naturale.
IL MECCANISMO DELLA MEIOSI
Il meccanismo della meiosi porta alla formazione di un gamete aploide, con patrimonio genetico 1n, dopo una sola fase S seguita da due divisioni nucleari cosecutive.
I processi delle divisioni consecutive sono simili a quelli meiotici (profase, metafase, anafase, telofase), tuttavia presentano caratteristiche peculiari. Si parla di:
- prima divisione meiotica (meiosi I)- seconda divisione meiotica (meiosi II).
Il primo stadio della meiosi I è la profase I, che è un processo molto lento che si può dividere in 5 parti:
- leptotene : inizio della spiralizzazione della cromatina che si avvolge in filamenti. I telomeri sono tutti rivolti verso un polo dell’involucro nucleare
- zigotene: i cromosomi iniziano ad appaiarsi e ogni cromosoma (formato da una coppia di cromatidi fratelli) si sovrappone al suo omologo mediante una struttura proteica chiamata complesso sinaptemale (CS), formando i bivalenti o tetradi (formati da 4 cromatidi dei due cromosomi omologhi)
- pachitene: i bivalenti si spiralizzano ulteriormente pur rimanendo gli omologhi appaiati. Avviene il crossing-over.
- Diplotene: i bivalenti iniziano a separarsi e rimangono in contatto solamente nei punti in cui è avvenuto il crossing-over, detto chiasmo.
- Diacinesi: i chiasmi scorrono verso le estremità e si distaccano tra loro. Scompare l’involucro nucleare e i cromosomi iniziano a legarsi ale fibre del fuso.
Il secondo stadio è lo stadio della metafase I:- le tetradi (o bivalenti) si orientano sul piano equatoriale
della cellula- i cinetocori delle tetradi sono orientati verso un polo
cellulare- a ogni coppia di omologhi si attacca una fibra del fuso.
La terza fase è la anafase I:- i due cromosomi di ogni coppia si separano e si muovono
verso i poli opposti- ogni cromosoma è ancora formato da due cromatidi
fratelli uniti a livello del centromero.
Segue la telofase I:- la cellula di partenza si divide in due cellule figlie,
ciascuna contenente un numero aploide di cromosomi con una quantità 2c di DNA.
- si forma un involucro nucleare- ha inizio la citodieresi
Tra la prima e la seconda divisione meiotica v’è una intercinesi molto breve poiché i cromosomi non si sono ancora despiralizzate ed è necessario solamente costruire un nuovo apparato mitotico in ciascuna cellula figlia.
La profase II: - i centrioli migrano ai poli opposti della cellula - si riforma l’apparato del fuso
La metafase II comporta l’allineamento del numero aploide di cromosomi all’equatore della cellula.
Con l’anafase II i cromosomi figli (cromatidi fratelli) migrano verso i poli opposti della cellula.
Il processo meiotico si conclude con la telofase II, in cui:- si riforma l’involucro nucleare- avviene una seconda citodieresi
la seconda divisione meiotca è equazionale, ha cioè il solo scopo di smistare ai gameti la metà ordinata dei cromatidi fratelli presenti nelle cellule della prima divisione.
I quattro gameti che si formano sono tutti geneticamente differenti tra di loro, poiché hanno subito una ricombinazione casuale con lo scambio di quelli paterni e materni, oltre che al crossing-over.
Il crossing-over è un meccanismo di ricombinazione che avviene nel pachitene della profase I:
- i cromatidi corrispondenti di due cromosomi omologhi possono subire ricombinazioni, scambiandosi porzioni di cromosoma tra loro
- il punto di incontro è detto chiasma.- Vengono scambiati segmenti corrispondenti tra cromatidi
non fratelli appartenenti a cromosomi differenti.
g. regolazione genica
La struttura e l’attività di una cellula dipendono dalla presenza e dalla concentrazione di determinate proteine. La variazione di concentrazione di queste permette all’organismo di adeguare le attività metaboliche alla necessità del momento.
L’espressione genica è differente tra procarioti ed eucarioti. Gli eucarioti pluricelulari, hanno inoltre sviluppato altri meccanismi che rendono
possibile il differenziamento delle cellule quando si trovano allo stadio embrionale.
i. Regolazione negli eucarioti
A differenza degli organismi procarioti, la sintesi degli eucarioti avviene in maniera più complessa. La regolazione genica non è fatta solo nel momento trascrizionale, ma anche in quelli post-trascrizionale e traduzionale.
La struttura del DNA degli eucarioti è molto più complessa rispetto a quella dei procarioti:
- il DNA è presente in quantità molto superiore- è legato a proteine (istoniche o non istoniche), alcune
delle quali hanno importanza regolativa.- I geni non formano operoni, ma sono formati da
sequenze introniche (che non codificano) ed esoniche (che codificano).
- Il DNA eucariotico è ricco di sequenze altamente ripetute che svolgono la funzione di regolare alcune attività di espressione genica degli animali o dei vegetali.
Altro fattore di enorme importanza è che il materiale genetico (DNA) è racchiuso in un involucro che lo isola dal resto, il nucleo:
- la trascrizione è separata dalla traduzione.- Questo permette la formazione di un hnRNA (RNA
eterogeneo) nel nucleo, che può venire ulteriormente elaborato prima di passare nel citoplasma e diventare mRNA per la traduzione (sintesi proteica)
- Sono questi alcuni dei meccanismi post-trascrizionali e traduzionali.
Regolazione della trascrizione.
La complessità dei meccanismi di regolazione genica degli eucarioti dipende da:
- presenza nel DNA di numerose sequenze regolative
- l’RNA-polimerasi per agire deve legarsi a dei fattori basali di trascrizione, che si uniscono al promotore
Un gene strutturale è costituito da:- sequenza codificante- sequenza promotore, dove si deve legare l’RNA-
polimerasi per iniziare la trascrizione.
A monte di un gene strutturale si trovano numerose sequenze di controllo molto lunghe:
- intensificatori (enhancers) : intensificano la trascrizione- silenziatori (silencer) : reprimono la trascrizione.
Queste sequenze, che possono distare anche migliaia di nucleotidi dal promotore, sono intervallate da sequenze spacers, a cui si legano proteine non istoniche con funzione regolativa.
La trascrizione inizia con la formazione di un complesso di proteine:- gli attivatori si legano agli intensificatori sul DNA- i coattivatori si legano agli attivatori e fanno da ponte per i
fattori basali di trascrizione- i fattori basali di trascrizione si legano alla sequenza
promotore- ai fattori basali di trascrizione si lega l’RNA-polimerasi
La repressione della trascrizione avviene quando:- alcune proteine, dette repressori, si legano ai silenziatori, - questi legami impediscono agli attivatori di legarsi agli
enhancers.- La trascrizione rallenta o si blocca
Una stessa proteina può influenzare due o più geni differenti, a causa della comunanza di intensificatori e silenziatori in alcuni geni.
Per poter avere meccanismi di attivazione o repressione della trascrizione, nonché del legame dell’RNA-polimerasi al promotore, è necessario segare il DNA dagli istoni :
- dipende dall’aggiunta di gruppi acetilici (CH3CO) alle braccia lineari dell’istone
- l’acetilazione contrasta la carica positiva sulle braccia della proteina, la quale si scinde dal DNA a carica negativa
Anche il controllo della cromatina è un ottimo meccanismo per la regolazione della trascrizione:
- le zone eucromatiche sono attive- le zone eterocromatiche sono inattive
La in attivazione di una gran parte della cromatina permette di inibire numerose sequenze in modo stabile:
- ha un ruolo fondamentale a livello dei processi di differenziamento.
Un ruolo importante per la condensazione o de-condensazione di cromatina è svolto dalle proteine non istoniche:
- controllano anche la compensazione di dosaggio del cromosoma X
- controllano la condensazione della cromatina durante la mitosi.
Regolazione a livello post-trascrizonale
Alcuni altri meccanismi di regolazione genica agiscono a livello del DNA-processing:
- splicing alternativo : le sequenze ottenute dall’hnRNA possono essere differenti a seconda di come vengono unite dopo lo splicing alcune sequenze esoniche. SI ottengono mRNA differenti. È un buon esempio l’alternative splicing dei linfociti B, in cui da differenti combinazioni di esoni si ottengono differenti immunoglobuline.
- trasporto degli RNA : alcuni RNA non sono fatti penetrare nel citoplasma, impedendone la sintesi delle relative proteine.
Regolazione a livello della traduzione
Il controllo a livello della traduzione può essere:- quantitativo regolando cioè il numero di proteine
sintetizzate- qualitativo con induzione o repressione della sintesi
proteica.
Altri tipi di controllo si basano su:- differente stabilità degli RNA- differente scelta del codone AUG come sequenza d’inizio
(alcune volte il ribosoma non sceglie quello vicino al cap)
ii. differenziamento
L’origine di un individuo comincia dall’uovo fecondato, detto zigote. Questo si accresce, dividendosi ripetutamente, formando una sferula di cellule detta blastula, che presenta una cavità interna detta blastocele.
Successivamente dei vari movimenti cellulari portano un fianco della blastula ad invaginarsi verso l’altra parete, fino a schiacciarsi su di essa. In questo processo di gastrulazione, si forma la gastrula quando i due strati di cellule si dispongono formando una sfera.
La gastrula è quindi costituita da due strati di cellule:- ectoderma (esterno)- endoderma (interno)
Nell’interstizio tra i due stati è presente una sostanza intercellulare amorfa (mesenchima) in cui sono immerse varie cellule: questo tessuto è il mesoderma.
Questi tessuti, nonostante appaiono morfologicamente simili, hanno già subito una prima diversificazione molecolare tale per cui sono destinate a svilupparsi in tessuti differenti.
Si formano in seguito gli abbozzi dei primi organi:- tubo neurale : diverrà il sistema nervoso
- somiti : di derivazione mesodermica, da cui nasceranno i tessuti muscolari, il derma cutaneo e le vertebre
- lamine di mesoderma laterale : daranno origine alle cavità sierose
Con il susseguirsi della diversificazione dei tessuti si ha il differenziamento, che è il processo in cui le varie cellule tissutali si specializzano.
Alla base del differenziamento sta la capacità delle cellule eucarioti di esprimere solamente determinati geni e reprimerne altri.
Da questa capacità dipendono:- specializzazioni morfologiche e funzionali- aggregazione delle varie cellule a costituire i tessuti- mantenimento dell’organismo differenziato adulto
Le cellule differenziate dei vari tessuti hanno tutte il medesimo DNA:- la specializzazione dei tessuti dipende da stimoli che
giungono al nucleo dal citoplasma- trapiantando un nucleo di una cellula in un’altra cellula di
un tessuto differente il nucleo è in grado di riprogrammarsi
- rende possibile la clonazione
Il processo che porta a differenziamento dei vari tipi cellulari è molto complesso e dipende dalla successione temporale dell’espressione di particolari geni che agiscono solo in questo stadio della vita di un organismo.
Questa espressione di geni differenti comporta la produzione di proteine regolatrici che regolano l’effetto a cascata del differenziamento.
Negli eucarioti la regolazione genica dipende anche da controllo della cromatina:
- determinate proteine prodotte permettono la difforme condensazione della cromatina in varie parti dell’organismo.
Espressioni strutturali nel corso del differenziamento cellulare.
Mentre all’inizio il differenziamento dipende dall’espressione genica (sintesi di molecole differenti), successivamente dipende dall’assemblaggio di specifiche macromolecole secondo un progetto strutturale molto preciso, che richiede la presenza di svariate attività enzimatiche.
Le proteine che vengono sintetizzate possono essere di tre tipi per gli eucarioti:
- proteine citoscheletriche responsabili dell’impalcatura della cellula
- proteine enzimatiche che devono svolgere funzioni specializzate
In base poi alla concentrazione e alla disponibilità di determinate proteine la cellula assume caratteristiche fenotipiche specializzate:
- questo avviene in tutti i compartimenti cellulari- successivamente, anche la presenza di tali proteine
stimolerà lo sviluppo di determinati compartimenti cellulari a seconda della funzione della cellula
Istodifferenziamento
L’istodifferenziamento è quel processo che avviene quando nello sviluppo si vengono a formare tessuti con caratteristiche morfofunzionali altamente specializzate.
Alcune popolazioni, durate l’istodifferenziamento possono riunirsi in comunità organizzate, formando complessi funzionali definiti (es. gli epiteli).
Per poter unirsi sono indispensabili due requisiti:- presenza di un supporto a cui attaccarsi- possibilità di attuare giunzioni per aderire e comunicare
con le cellule adiacenti.
Le cellule epiteliali, ad esempio dovranno:- produrre glicoproteine che formino gli emidesmosomi per
legarsi alla membrana basale- Devono produrre proteine specifiche che permettano
l’adesione meccanica come i desmosomi- Devono attuare anche giunzioni comunicanti (gap
junctions) che permettano la intercomunicazione
Altri tipi di cellule invece non si uniscono e rimangono immerse in una matrice extracellulare da loro stesse prodotta:
- i tessuti connettivi, che hanno origine mesenchimale.
Il tessuto osseo o il cartilagineo hanno sviluppato particolari prodotti extracellulari in modo tale da formare una struttura ben definita.
Anche il sangue è un tessuto di origine mesenchimale, che presenta caratteristiche altamente connettive.
Dal mesoderma derivano anche i tessuti muscolari, che si organizzano in particolari unità (sarocomeri) che permettono la contrazione.
Infine dall’esoderma derivano i neuroni, che formano il tessuto nervoso congiungendosi con particolari giunzioni (le sinapsi). Queste cellule sono altamente differenziate e si specializzano per conduttività ed eccitabilità.
Il posizionamento delle cellule differenziate che si vengono a formare è regolato da uno scambio reciproco di informazioni:
- quando un tessuto è ormai differenziato, le cellule si dicono cosa fare a vicenda,
- le popolazioni di cellule in via di sviluppo si autocontrollano e si indicano dove migrare, cosa sintetizzare, ecc…
Il mantenimento dello stadio differenziato.
Si è visto che il processo restrittivo e la produzione di particolari prodotti di sintesi producono cellule altamente specializzate.
La specializzazione, tuttavia, comporta una perdita della capacità proliferativa.
Per ovviare, i tessuti che hanno bisogno di un ricambio sempre maggiore, possiedono cellule poco differenziate, dette cellule staminali , che hanno il compito di riprodursi e fornire al tessuto gli elementi cellulari necessari.
Il mantenimento della struttura differenziata è attuato grazie a degli stimoli ormonali e a feed-back positivi nelle divisioni cellulari:
- permettono il costante mantenimento delle macromolecole regolatrici
iii. apoptosi
La morte cellulare non è solamente un evento patologico o traumatologico:
- vi sono anche metodi fisiologici, relativi anche al mantenimento del differenziamento cellulare, che causano morte cellulare
I due processi di morte cellulare si chiamano:- necrosi- apoptosi
La necrosi fa seguito a gravi danni chimici o fisici alla cellula oppure a condizioni di ischemia o emorragia massivi di un organo:
- il danno è esteso a tutta la cellula, membrana, organuli e nucleo
- porta alla completa distruzione della cellula- durante la necrosi la cellula rilascia agenti flogogeni che
causano uno stato infiammatorio nelle zone necrotiche di un organo
- questi stimolano la riparazione e la nuova proliferazione a partire dalle cellule non affette da necrosi
L’apoptosi non comporta danni né alla membrana né agli organuli, ma solamente al nucleo:
- le cellule morte in seguito ad apoptosi vengono ingerite dai fagociti (non vanno incontro a lisi cellulare)
- in questo modo si evitano gli eventi flogistici conseguenti alla lisi che si ha con la necrosi
- è un meccanismo con cui i tessuti (soprattutto quelli labili) attuano il ricambio delle cellule che li compongono
- mediata da enzimi detti caspasi
I nuclei apoptotici hanno caratteristiche varie a seconda del tipo di cellula a cui appartengono.
La fagocitosi delle cellule morte per apoptosi avviene grazie ad una molecola di fosfatidilserina che viene esposta all’esterno delle cellule, sulla membrana plasmatica e funge da recettore.
Altre volte, nei tessuti superifciali particolarmente labili, le cellule vengono eliminate dopo essere state sfaldate:
- le cellule dell’epidermide vengono rilasciate sulla superficie cutanea
- nell’intestino vengono lasciate nel lume
La frammentazione del nucleo viene operata da enzimi endonucleasi attivabili con ioni zinco (Zn2+).
L’apoptosi prende anche io nome di morte cellulare programmata:- vale soprattutto in ambito di morfogenesi embrionale e
metamorfosi- risultato di un programmato equilibrio tra proliferazione e
morte cellulare programmata.
L’apoptosi può essere anche indotta da stimoli esogeni che si legano a recettori sulla membrana plasmatica:
- un esempio di recettore che porta a apoptosi è dato dalla molecola APO-1,
- APO-1 è una molecola che viene identificata come antigene FAS
L’antigene Fas appartiene ad una famiglia di recettori che comprende:
- TNF: tumor necrosis factor- NGF : nerve growth factor
Il cross-linking di APO-1/FAS, con la mediazione di anticorpi, porta ad apoptosi nelle cellule APO-1-positive.
Altri recettori/complessi possono scatenare fenomeni apoptotici, creando reazioni a cascata all’interno del citoplasma:
- MIS- TNF.
Può anche essere scatenata da fattori lipofilici che inducono la codificazione di geni che creano proteine che portano il nucleo ad apoptosi.
5. xxx