CHIMICA ORGANICA...B) Ho più di due sostituenti in un alchene, non ci sono due idrogeni -->...
Transcript of CHIMICA ORGANICA...B) Ho più di due sostituenti in un alchene, non ci sono due idrogeni -->...

1
1 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
CHIMICA ORGANICA nomenclatura
ALCANI PREFISSO RADICE SUFFISSO
Quali sono i sostituenti? dove sono?
Qual è la catena carboniosa più lunga?
Qual è il gruppo funzionale?
Procedimento
1. Individua la catena carboniosa continua più lunga e nomina la molecola usando il nome della radice
corrispondente e il suffisso tipico di ogni gruppo funzionale.
1) Se ci sono due catene di uguale lunghezza seleziona la catena con più sostituenti.
2. Numera la catena più lunga in modo da assegnare al primo sostituente il numero più basso.
1) Se il primo sostituente è alla stessa distanza da entrambe le parti, numero la catena in modo da
assegnare ai sostituenti successivi il numero più basso.
2) Se la numerazione ha gli stessi valori, decido di numerare secondo l’ordine alfabetico
3. Nomina i sostituenti come gruppi alchilici e assegna loro la posizione numerandola.
1) Se due o più sostituenti sono legati alla catena principale si usa un prefisso per indicare la quantità.
( Di-, Tri-, Tetra-)
4. Unisci i nomi dei sostituenti e il numero, la radice e il suffisso.
1) Fai precedere al nome della radice i nomi dei sostituenti
2) Poni in ordine alfabetico i sostituenti ignorando i prefissi, tranne nel caso dell’iso-
3) Ci deve essere un numero per ogni sostituente
4) Separa i numeri con la virgola e i numeri dalle lettere con un trattino.
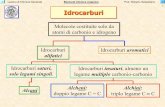
ACICLICI [CnH2n+2]
Catena principale Gruppi Alchilici (sostituenti) Formula chimica
Metano Metile
Etano Etile
Propano Propile isopropile
Butano Butile sec-butile isobutile terbutile
CICLOALCANI [CnH2n]
1) Quando è presente un anello aggiungo prima della radice la parola “ciclo-“
2) Se il numero degli atomi di carbonio dell’anello è maggiore o uguale al numero degli atomi di carbonio
della catena più lunga, il composto è nominato come un cicloalcano.
3) I radicali sono nominati similmente agli alcani aciclici, successivamente ruoto in senso orario o
antiorario in base ai sostituenti ed il loro ordine alfabetico.

2
2 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
TABELLA GRUPPI FUNZIONALI NOMENCLATURA Nome gruppo funzionale
Gruppo funzionale
Suffisso (g.f. è principale)
Prefisso (g.f. non principale)
Alcani -ANO ALCHIL
Alogeno derivati -ANO FLUORO, CLORO, BROMO, IODIO
Eteri -ANO ALCOSSI
Alcheni -ENE \
Alchini -INO \
Ammine
-AMMINA AMMINO
Alcoli
-OLO IDROSSI
Chetoni
-ONE OSSO
Aldeidi
-ALE OSSO
Nitrili
-NITRILE \
Ammidi
-AMMIDE \
Cloruri acilici
CLORURO DI -OILE \
Esteri
ALCANOATO (-ATO)DI ALCHILE
\
Anidridi
ANIDRIDE \
Acido carbossilico
ACIDO -OICO \
1. Devo considerare sempre la catena più lunga che contiene il gruppo funzionale più importante e
che di conseguenza conferisce il nome alla molecola.

3
3 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
I DERIVATI DEL BENZENE Nome Molecola Formula di Lewis Nome Molecola Formula di Lewis
Benzene
Anilina
Toluene
Acido Benzoico
Cumene
Benzanammide
Stirene
Cloruro di Benzoile
Acido Fenico (Fenolo)
Benzoato di Metile
Benzaldeide
Benzonitrile
Metossibenzene (Anisolo)
Anidride benzoica
Acetofenone
Nitrobenzene
Acido ortoidrossi Benzoico
Clorobenzene
Cinamaldeide
2,4,5 Tricoloro Fenolo
La

4
4 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
ISOMERIA Due composti con la stessa formula molecolare:
Sono SOVRAPPONIBILI ?
Sì: sono la stessa molecola
No: sono isomeri.
Differiscono per il modo in cui gli atomi sono legati?
Sì: sono isomeri costituzionali. (Isomeri con atomi legati ad atomi differenti)
No: sono stereoisomeri. Differiscono per la distribuzione spaziale dei sostituenti.
Sono i sostituenti ad essere legati in modo diverso?
Sì: sono regioisomeri
No: sono isomeri costituzionali.
Stereoisomeri: Possono essere convertiti l’uno nell’altro per rotazione attorno ad un legame?
Sì: sono isomeri conformazionali (conformeri)
No: sono isomeri configurazionali
Isomeri CONFIGURAZIONALI che stiamo considerando sono speculari?
Sì: Enantiomeri
No: Diasteroisomeri
1.DIASTEROISOMERI Possono essere convertiti l’uno nell’altro per rotazione intorno ad un legame, quindi è necessario
specificare nel nome della molecola di quale Diasteroisomero si parla: (isomeri configurazionali)
A) Ho due sostituenti in un alchene e sono in presenza di due idrogeni.--> Nomenclatura CIS- e TRANS-
B) Ho più di due sostituenti in un alchene, non ci sono due idrogeni --> Nomenclatura E e Z.
a. Scelgo il sostituente prioritario, ovvero quello con il numero atomico superiore
perpendicolare.
b. Guardo la molecola: se sono insieme rispetto al doppio legame si dice (Z), se sono da parti
opposte rispetto al doppio legame si dice (E)
N.B. Spesso capita che non si debba aggiungere il descrittore geometrico, in quanto le due molecole
potrebbero essere semplicemente la stessa. Tentare una traslazione.
2. ENANTIOMERI Molecole chirali, non sovrapponibili rispetto alle loro immagini speculari (proiezioni di Fischer). Nelle
molecole chirali è possibile individuare degli stereocentri, ovvero degli atomi attorno ai quali si presenta la
proprietà di chiralità, è una condizione sufficiente ma non necessaria.
Devo attribuire i descrittori R, S affinché la molecola presa in considerazione sia univocamente individuata:
1) Identifico lo stereocentro
2) Riconosco il sostituente principale prioritario e i seguenti in ordine di massa atomica (n°atomico)
3) Il sostituente di priorità più bassa si deve trovare dalla parte opposta rispetto all’osservatore.
4) Ruoto in senso antiorario partendo dal sostituente principale per attribuire (S), mentre ruoto in
senso orario per attribuire (R).
E’ possibile ottenere l’enantiomero speculare scambiando due sostituenti dei tre con importanza più alta
2n è il numero massimo degli stereoisomeri che si possono scrivere (n=n°stereocentri)
La proiezione di Fischer aiuta ad identificare le varie configurazioni, in quanto presenta gli atomi lontani
dall’osservatore sulla verticale e gli atomi vicini all’osservatore sull’orizzontale, così da semplificare la sua
rappresentazione tridimensionale geometrica. (La molecola risulta appiattita)

5
5 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
Attività ottica Due enantiomeri hanno identiche proprietà fisiche eccetto che per il modo con cui interagiscono con la luce
piano-polarizzata(avente il vettore elettrico oscillante solo in un piano). Due enantiomeri ruotano la luce
piano-polarizzata di ugual valore ma nella direzione opposta. (In senso orario(+)(destrogiro), o senso
antiorario(-)(levogiro))
Per misurare l’angolo della luce piano polarizzata si utilizza un polarimetro. L’angolo misurato dipende dalla
cella e dalla concentrazione della miscela presa in considerazione.
Potere ottico rotatorio specifico La misurazione avviene rispetto alla lunghezza d’onda dell’atomo di sodio che ha riga di emissione D(589
mm), la temperatura a 20 C° è generalmente si cerca di rendere l’esperimento indipendente dalle
condizioni in cui è stata effettuata la misura, quindi a stesso solvente e stessa concentrazione.
Per ogni sostanza dobbiamo stabilire se è destrogiro o levogiro e il suo valore è opposto rispetto al potere
ottico rotatorio specifico.
Acido Tartarico L’acido tartarico può esistere in 3 strutture:
Destrogiro (R,R)
Levogiro (S,S)
Mesoforma Achirale
Queste misurazioni sono state possibili grazie alla dispersione atomica dei raggi X=tecnica per determinare
la configurazione assoluta e quindi per indicare le proprietà fisiche ottiche da associare ad R ed S.
Ai tempi di Pasteur (1848) queste tecniche non erano così raffinate, infatti egli si accorse di queste
proprietà casualmente, dopo aver fatto cristallizzare l’acido tartarico con sali di sodio e di ammonio da
acqua. Da una molecola per acidificazione otteniamo un tipo di cristallizzazione, dall’altra l’enantiomero
levogiro, e quindi permettendo di separare un composto racemo. (Raramente questo accade)
RACEMO: soluzione in cui pongo sia la soluzione destrogira, sia quella levogira e non polarizza la luce (1:1)
Esempi di attività biologica differente Tutti i nostri amminoacidi sono chirali levogiri, ad eccezione della Glicina, che non possiede uno
stereocentro, infatti nel nostro organismo solo gli enantiomeri levogiri sono in grado di reagire con i nostri
recettori chirali. Metanfetamina(1), Mentolo(2), Enantium(3), limonene(4)
Eccesso enantiomerico L’eccesso enantiomerico, detto anche purezza ottica, ci dice quanto in più c’è dell’elemento prevalente,
rispetto alla miscela racemica 1:1. (ee=% di un enantiomero-%dell’altro enantiomero)

6
6 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
Stereoisomeri conformazionali Le conformazioni sono arrangiamenti diversi di atomi che interconvertono per rotazione attorno a un
legame singolo. Una particolare conformazione è chiamata conformero.
Etano La struttura più stabile è quella sfalsata, dove i
legami C-H su un carbonio bisecano l’angolo di
legame H-C-H del carbonio adiacente. La struttura
meno stabile è quella eclissata, dove i legami C-H
di carboni diversi sono allineati. Le conformazioni
sfalsata ed eclissata dell’etano interconvertono a
temperatura ambiente, ma i due conformeri non
hanno la stessa stabilità, in quanto la repulsione
sterica degli elettroni ne aumenta l’energia. (La
differenza energetica tra i due conformeri è di circa
3 Kcal/mol chiamata energia torsionale)
Proiezione sfalsata
Proiezione eclissata
Butano Sebbene ogni rotazione di 60° attorno al legame
converta un conformerò sfalsato in un conformero
eclissato, nessuno è uguale ad un altro. Una
conformazione sfalsata con i due raggruppamenti
più voluminosi a 180° l’uno dall’altro è detta anti.
Una conformazione sfalsata con i due
raggruppamenti più voluminosi a 60° l’uno
dall’altro è detta Gauche. Le interazioni steriche
non favorevoli aumentano l’energia (ogni
interazione CH3-CH3 corrisponde a 4 Kcal/mol,
ogni interazione H-CH3 corrisponde a 1.5 Kcal/mol)
La differenza di energia fra due conformazioni a più bassa e più alta energia è chiamata barriera alla
rotazione.
Sfalsata anti
Eclissata
Sfalsata Gauche
Eclissata
Sfalsata Gauche Eclissata

7
7 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
Cicloalcani Oltre alla tensione torsionale e sterica, le conformazioni dei cicloalcani sono caratterizzate dalla tensione
angolare, ovvero un aumento di energia che si osserva quando gli angoli di legame si discostano dal valore
tetraedrico ottimale di 109.5°. (tensione di Baeyer). Proprio per ridurre la tensione angolare i cicloalcani
con più di tre atomi di carbonio nell’anello non sono molecole plantari, sono piuttosto piegati per ridurre la
tensione, sia quella angolare sia quella torsionale.
Nel caso del cicloesano, la conformazione a sedia elimina ogni tipo di tensione angolare e torsionale. Ogni
atomo di carbonio nel cicloesano ha due diversi tipi di idrogeno: assiali se sono localizzati sopra l’anello,
equatoriale se sono localizzati nel piano dell’anello. Le forme a sedia sono 7 Kcal/mol più stabili delle
conformazioni a barca, una situazione di passaggio fra i due conformeri a sedia.
In generale le forme più stabili sono quelle in cui i sostituenti più grandi sono in posizione equatoriale.
Velocità di reazione Solitamente le reazioni avvengono in più atti di reazione, che portano alla conversione dei reagenti nei
prodotti. (Meccanismo di reazione). La velocità di reazione dipende dagli urti che avvengono nelle specie
chimiche e la loro frequenza.
L’energia di attivazione è l’energia minima che le specie chimiche devono avere affinché l’urto sia efficace.
L’atto lento è l’atto che determina la velocità di tutta la reazione.
aA+bB <--> cC+dD
Aumentare la velocità di reazione A. Cambio le concentrazioni iniziali(non sempre valido)
B. Aumento la temperatura (aumenta l’energia cinetica (aumento l’energia cinetica e gli urti efficaci).
Non sempre è possibile per reazioni termodinamiche spontanee. Equazione di Arrhenius
C. Catalizzatori (non partecipa alla reazione ma cambia il meccanismo di reazione abbassando
l’energia di attivazione, non agisce sulla termodinamica)
a. Catalisi omogenea --> in stessa fase
b. Catalisi eterogenea --> catalizzatore solido e specie reagenti in fase liquida o gassosa
c. Catalisi enzimatica --> consentono di ottenere enantiomeri di preferenza, reazioni in
condizioni blande. L’effettiva attività dell’enzima può essere ben spiegata dal concetto di
chiave e serratura e dalla trasformazione della molecola attraverso al sito attivo.

8
8 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
Alcani e reazioni
Proprietà fisiche
Non solubili in acqua (forze di VDW)
Hanno alti punti di fusione e bassi punti di ebollizione
Sono molecole apolari con legami carbonio idrogeno
Più sono ramificati più sono densi e con temperature di ebollizione più basse.
Combustione Gli alcani danno luogo alla combustione, cioè essi bruciano in presenza di ossigeno per formare anidride
carbonica e acqua. Il composto organico viene ridotto e l’ossigeno viene ossidato.
Alogenazione radicalica Questa reazione avviene a catena grazie alla rottura di un alogeno attraverso l’energia assorbita
dall’ambiente (temperatura o luce) e si propaga catena finché non si raggiunge lo stadio di terminazione. In
base alla quantità di cloro che aggiungo posso alogenate il metano fino al tetracloruro di carbonio.
INIZIO (rottura omeolitica della molecola di cloro per effetto di luce o riscaldamento) PROPAGAZIONE (reazione con l’alcano e sua estensione ad altre molecole di Cl2)
1° stadio 2° stadio TERMINE:
1. Due radicali CH3• possono reagire fra di loro e non con altri Cl2. Si forma etano 2. Radicale cloro produce il clorometano e non produce la rottura di altre molecole di metano. 3. Due cloro reagiscono fra di loro e producono Cl2
INIZIO (rottura omeolitica della molecola di bromo per effetto di luce o riscaldamento) PROPAGAZIONE (è favorita la creazione di un radicale secondario : il 2-Bromopropano)
I regioisomeri di questa reazione non sono favoriti allo stesso modo, per cui si parla di reazione
regioselettiva. In alcune reazioni alcuni prodotti sono favoriti al 100% e quindi la reazione si definirà
regiospecifica (2-Bromopentano)
Il cloro è meno regioselettivo del bromo
Il fluoro è pericoloso ed è difficile fare monofluorurazioni

9
9 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
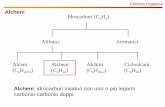
Alcheni e reazioni
Proprietà fisico chimiche
Gassosi fino a 5 atomi di carbonio ramificato
Meno densi dell’acqua e non solubili
Elettrofilo --> carica positiva, acido di Lewis
Nucleofilo --> Carica negativa, base Lewis
Molecola più reattiva degli alcani grazie al doppio legame.
3 orbitali ibridi sp2 (geometria trigonale planare della molecola)
Reazioni di addizione
Elettrofila
1. Alogenazione a) Atto lento con carbocatione b)Atto rapido
2. Reazione con HX a) Atto lento con carbocatione b)Atto rapido
3. Idratazione acido catalizzata a) Attacco dell’alchene sull’elettrofilo b)Neutralizzazione carica positiva
c) La specie evolve con la liberazione di H+
Quando due regioisomeri che si presentano con frequenze differenti, è più comune il regioisomero
nel quale la porzione nucleofila si lega al carbonio più sostituito (REGOLA DI MARKOVNIKOV). Infatti
il carbocatione più stabile è quello terziario, ovvero anche l’atto lento della reazione. La reazione
favorita è quella con il carbocatione più stabile.
Con meccanismo concertato
1. Idroborazione degli alcheni
2. Cicloaddizione di Dies Alder

10
10 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
Reazione di idrogenazione
L’idrogeno viene idrogenato dalla stessa parte poiché la molecola è planare.
Addizione radicalica agli alcheni
PREPARAZIONE scaldo la miscela e rompo i legami O-O INIZIO reazione radicale con 1 moli di etilene (si forma legame O-C) PROPAGAZIONE reazione specie radicalica al carbonio con un etilene (si formano legami C-C) TERMINE
a) Il titolo reagisce con le specie radicaliche presenti e poi si blocca con un radicale simile b) Due catene in crescita si legano, senza propagarsi ad altri etilene c) Ramificazioni e conclusione di catena
Polimerizzazione dell’etilene
Nella stessa reazione ho la partenza di più catene, che possono avere massa molecolare diversa.
Quando definisco la massa molecolare devo fornire la media. (MISURO ATTRAVERSO VISCOSITÀ’)
Quando la mm media è raggiunta dall’esterno interrompiamo dall’esterno la formazione di legami
aggiungendo tioli.
Poiché le catene sono ramificate e non lineari, è possibile che l’elettrone spaiato strappi un
idrogeno da una catena diversa.
Reazioni di ossidazione
1. Reazione con il permanganato di potassio
2. Reazione con l’ozono
a) TrifenilFosfina (PPh3)
b) Sodioboroidruro (NaBH4)
3. Reazione con i peracidi

11
11 STEFANO MAGNI | INGEGNERIA BIOMEDICA POLITECNICO DI MILANO
Alchini e reazioni Così come con gli alcheni le instaurazioni di due orbitali è rimasti non ibridati permettono di formare legami
pi greco. Questi legami, molto facili da rompere permettono di fornire elettroni a elementi elettrofili e cosi
compiere reazioni di addizione elettrofila.
Addizione di alogeni
Addizione di HX
Addizione di H2O catalizzato da H2SO4/HgSO4
A)
B)
C)
Idrogenazione degli Alchini
Reazioni degli alchini terminali con basi forti A)
B)
- L’etanoato di sodio può reagire con gli alogenuri alchilici e formare molecole complesse.