3 Acidi Ammine Amminoacidi
-
Upload
vincenzo-de-marco -
Category
Documents
-
view
37 -
download
0
description
Transcript of 3 Acidi Ammine Amminoacidi
-
Acidi Carbossilici
-
Acidi Carbossilici R-COOHAcido Formico
-
NomenclaturaAcido Alcanoico (se gruppo principale)Se gruppo secondario: carbossi
HC(=O)OHAcido metanoico (formico)CH3C(=O)OHAcido etanoico (acetico)CH3CH2C(=O)OHAcido propanoico (propionico)CH3CH2CH2C(=O)OH Acido butanoico (butirrico)
C6H5C(=O)OHAcido benzoicoSe il gruppo R ciclico alcancarbossilico
-
Possibilita di formare legami a H intermolecolari
-
Acido stearicoAcido OleicoAcidi grassi: si chiamano cos gli acidi con una LUNGA catena di atomi di carbonioAmmino AcidiIdrossi acidiAcido latticoCheto acidiAcido piruvico
-
Acidi bicarbossiliciNomenclatura: alcandioico
HOOC-COOH Acido etandioico (ossalico)HOOC-CH2COOH Acido propandioico (malonico)HOOC-CH2CH2COOH Acido butandioico (succinico)HOOC-CH2CH2CH2COOH Acido pentandioico (glutarico)HOOC-CH2CH2CH2CH2COOH Acido esandioico (Adipico)
-
Acido tricarbossilico
-
PROPRIETAACIDO-BASE
-
IONE CARBOSSILATOSTABILIZZATO PER RISONANZA
-
Ammine
-
AMMINEDerivati dellammoniaca (NH3), nei quali uno, due o tre idrogeni sono sostituiti da gruppi alchilici o arilici.
-
Ammine e composti azotati sono fra le molecole organiche piu abbondanti:
1) AMMINOACIDIPROTEINE
2) AMMINE IMPLICATE IN PROCESSI FISIOLOGICI ( COME NEUROTRASMETTITORI vedi istamina)
3) AMMINE COME PRODOTTI DI DEGRADAZIONE DA PROTEINE SI TROVANO NEGLI ALIMENTI.A VALORI NORMALI (ODORE DI PESCE) FINO A DIVENTARE TOSSICHE IN PRODOTTI DEGRADATI.Le piu comuni:Putrescina, Cadaverina, Spermina, trimetilammina
-
PUTRESCEINACADAVERINASPERMINAReazione acido-base: ammina come BASE
-
-Ammine composti polari, il legame C-N e covalente polarizzato.-Lazoto puo fare da accettore e da donatore di legami a idrogeno-Punti di ebollizione delle ammine sono intermedi tra quelli degli idrocarburi alifatici e degli alcoli-La solubilit in H2O dipende dal numero di gruppi R legati allazoto:
NH3 RNH2 R2NH R3N> SOLUBILITAIN H2O< SOLUBILITAIN H2O
-
AMMINE COME BASILa basicit delle ammine viene valuta mediante la pKb o la pKa dellacido coniugato.
Ammine primarie: R-NH2 pKb circa 4, quindi la pKa dellacido coniugato R-NH3+ sar circa 10.
Ka = [RNH2][H3O+][RNH3+]KaKb = [H3O+][OH-] = Kw = 10-14Kb circa 10-4, Ka circa 10-10
-
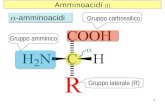
Ammino acidiGRUPPOCARBOSSILICOGRUPPOAMMINICOIn natura esistono centinaia di amminoacidi diversi, ma TUTTI gli organismi viventi usano gli stessi 20 ammino acidi per fare le proteine.In genere si trovano nelle proteine (una delle tre classi di macronutrienti, le altre sono carboidrati e lipidi)
-
Nei 20 amminoacidi proteici, il gruppo R varia con diverse funzionalit
-
Gli amminoacidi che l'organismo non un grado di autoprodurre si chiamano essenziali
-
Ammino acidi negli alimenti.come AROMI
-
Il sapore tipico dei granchi dato dalla coppia ARGININA-GLUTAMMATOQuello dei ricci di mare dalla presenza della METIONINA, in assenza di questo amminoacido non ce distinzione tra i due prodotti.Laroma del pomodoro dipende dalla presenza di Carboidrati, acidi organici e in particolare 2 amminoacidi: acido aspartico e glutammicoIn particolare la quantit dellACIDO GLUTAMMICOaumenta con la maturazione conferendo un miglioramentonel sapore.
-
Propriet acido-base
-
La capacit di un atomo di polarizzare un legame, cio di attirare a se o di respingereelettroni detto EFFETTO INDUTTIVO
Atomi elettronegativi esercitano un effetto induttivo ELETTRONATTRATTORE
Atomi poco elettronegativi esercitano un effetto induttivo ELETTRONDONATOREIl gruppo NH3+ esercita un effetto elettronattrattoreIl gruppo COO- esercita un effetto elettronattrattoreGli effetti induttivi si trasmettono attraverso i legami (cio se un carbonio legato ad un atomo elettronattrattore, anche lui comincer ad attrarre elettroniUn effetto elettronattrattore stabilizza cariche negative e destabilizza cariche positiveUn effetto elettrondonatore destabilizza cariche negative e stabilizza cariche positive
-
Acidit del gruppo carbossilico di un ammino acido genericoR-COOHR-COO- + H+La pKa di un comune acido carbossilico 4-5 (acido acetico 4.6)Ma in un amminoacido vi leffetto elettronattrattore del gruppo ammoniostabilizzatoLacido carbossilico divent pi acido (pKa inferiore): circa 2Acidit del gruppo ammonio di un ammino acido genericoR-NH3+R-NH2 + H+La pKa di un comune gruppo ammonio 10-11 (metilammonio 10.6)Ma in un amminoacido vi leffetto elettronattrattore del gruppo carbossilatodestabilizzatoIl gruppo ammonio divent pi acido (pKa inferiore): circa 9
-
Stati di protonazione di un amminoacido al variare del pHIn base allequazione di Henderson, se un acido HA si dissocia per dare H+ e A-:[H+]= Ka x ([HA]/[A-])pH= pKa - Log ([HA]/[A-])Da cui si evince chese pH < pKa prevale la specie HAse pH > pKa prevale la specie A-pKa - pH = Log ([HA]/[A-])
-
pH < 2.352.35 < pH < 9.87pH > 9.87Forma cationicaForma zwitterionicaForma anionicaprevalente a:Grafico di distribuzione delle varie specie ioniche dellalanina al variare del pH
-
Equilibri di aciditI+IIIIIII-pKa1 2pKa2 9
-
Punto isoelettrico pIValore di pH a cui si ha lammino acido prevalentemente nella forma neutra e eguale concentrazione di specie cariche positivamente e negativamenteValore di pH a cui lammino acido, posto in un campo elettrico, non migra (questa la definizione corretta)Valore del pH per il quale si ha un minimo di solubilit dellammino acidoPer un ammino acido semplice: pI = (pKa1+pKa2)/2
-
Amminoacidi con catene laterali ionizzabili: il caso della lisinapKa = 2.18pKa = 8.95pKa = 10.53Forma biscationicaForma cationicaForma zwitterionicaForma anionicapH < 2.182.18 < pH < 8.958.95 < pH < 10.53pH > 10.53La forma zwitterionica presente a pH pi basici
Il Punto Isoelettrico si calcola come media tra il pKa inferiore e tra il pKa superiore del range di esistenza della specie zwitterionica
Nel caso della lisina: PI = (8.95+10.53)/2 = 9.74
Il PI ancora un minimo di solubilit, ma essendo il range di esistenza della specie zwitterionica pi ristretto ed essendovi pi gruppi polari, la molecola comunque molto solubile anche al PI.