2. POLIMERI BIODEGRADABILI SINTETICI 3. POLIMERI ...
Transcript of 2. POLIMERI BIODEGRADABILI SINTETICI 3. POLIMERI ...

2. POLIMERI BIODEGRADABILI SINTETICI
3. POLIMERI BIODEGRADABILI NATURALI
4. SMART HYDROGELS
5. BIOMIMICRY
6. VALUTAZIONE BIOLOGICA IN VITRO &IN VIVO
7.A METODI PER L’OTTENIMENTO DI STRUTTURE TRIDIMENSIONALI
7.B COMPUTER-AIDED TECHNIQUES FOR SCAFFOLD FABRICATION
8. ELECTROSPINNING (ELETTROFILATURA)
9. EVALUATION OF SCAFFOLD ARCHITECTURE AND POROSITY
10. BIOFABRICATION Materiali sacrificali e bioink
12. 1. MATERIALI INIETTABILI
12. 2. MICROCAPSULE IN IDROGELO
13. CELL SHEET ENGINEERING
14. METODI DI CARATTERIZZAZIONE DI SCAFFOLD, STRUTTURE 3D, MATRICI PER LA MEDICINA RIGENERATIVA INCOMPLETO!
15. MODIFICHE SUPERFICIALI SUPERFICI MICROSTRUTTURATE
16. TESSUTO MUSCOLARE: possibili approcci per la rigenerazione del tessuto
17. Possibili approcci per l’incapsulamento di isole pancreatiche e per il rilascio di insulina
18. Strutture tessili in fibroina per la rigenerazione del legamento crociato (ACL)
19. Progettazione e caratterizzazione di uno scaffold biomimetico per il riparo di difetti osteocondrali
21. MODELLI DI TESSUTO PATOLOGICO IN VITRO
22. INGEGNERIA TESSUTO ADIPOSO VASCOLARIZZAZIONE DI SCAFFOLD ATTRAVERSO STRUTTURE SACRIFICALI
23. MATERIALI POLIMERICI NATURALI PER LA REALIZZAZIONE DI SCAFFOLD MICROSTRUTTURATI MEDIANTE DEPOSIZIONE ELETTROCHIMICA
24. MATRICI TUBOLARI PER LA RIGENERAZIONE DI VASI DI PICCOLO CALIBRO

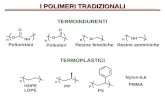
2. POLIMERI BIODEGRADABILI SINTETICI Requisiti: no risposta infiammatoria accettabile shelf life prodott di degradazione non tossici bilanciamento tra tdegradazione e processo di guarigione proprietà meccaniche adeguate facilmente processabile sterilizzabile (variazione accettabile del peso molecolare) Fattori della degradazione idrofobicità: ↑ idrofobicità ⇒ ↓ degradazione maggiore MW ⇒ ↓ degradazione morfologia: cristallinità⇒ ↓ degradazione porosità ⇒ ↑ degradazione se Tg > 37°C: minore mobilità ⇒ ↓ degradazione
POLI-a-IDROSSIACIDI • Bulk erosion • Non hanno gruppi funzionali à non riconosciuti come
self e utilizzati in copolimeri in cui sono presenti gruppi funzionali
es PLGA- copolimero PLA/PGA + GRUPPI IDROSSILICI FUNZIONALI con R=Me e R=H

4. SMART HYDROGELS Reti 3D che possono rigonfiarsi in un solvente senza disciogliersi (in questo caso il solvente è l’acqua) La capacità di assorbimento dipende dal grado di reticolazione e se la reticolazione non è presente si degradano velocemente. APPLICAZIONI: - Lenti a contatto - Protesi seno - Ingegneria tissutale IDROGELI: - PEGDA - ALGINATO - COPOLIMERI A BLOCCHI - SMART HYDROGELSSono particolari idrogeli che possono cambiare le caratteristiche se stimolati con stimoli esterni (radiazione luminosa, campo elettrico, differenza di pH, campo magnetico, luce…) Per quantificare il solvente assorbito: V.A.S (Ws-W0)/(ρ W0 · 100) LCSTà transizione sol - gel con l’aumento della temperatura (gel ad alta T, soluzione a bassa T) UCSTà transizione sol - gel con la riduzione della temperatura (soluzione ad alta T, gel a bassa T)

6. VALUTAZIONE BIOLOGICA IN VITRO &IN VIVO CITOTOSSICITÀ: Si verifica se il materiale rilascia sostanze a basso peso molecolare, derivanti dal processo di produzione/lavorazione, da una contaminazione del materiale o dalla degradazione/corrosione dello stesso, che possono essere tossiche per le cellule; la citotossicità del materiale può essere causata anche da un’errata sterilizzazione, quindi è necessario valutarla prima e dopo sterilizzazione.
CITOCOMPATIBILITÀ: Il materiale da testare viene messo in un pozzetto di coltura e dopo avviene la semina diretta delle cellule da analizzare. Si osserva la vitalità e funzionalità delle cellule, mediante saggi specifici.
CRITICITà Cito-tossicità indiretta: • materiale: poroso o compatto? • T_eluati per verifica eventuale rilascio? • T_di coltura: per quanto cellule in coltura con eluati? Cito-compatibilità diretta • materiale: poroso o compatto? • cellule: quale fenotipo idoneo per l’applicazione? • T_di coltura: per quanto cell a contatto con materiale?

7.A METODI PER L’OTTENIMENTO DI STRUTTURE TRIDIMENSIONALI Top-down Scaffold +cellule Proliferazione cell + degradazione scaffold Tessuto ingegnerizzato Bottom-up: assemblamento di strutture con cellule Processi di fabbricazione tradizionali si basano su parametri: solvente, temperatura, pressione strumentazioni note. Agenti porogeni: v NaCl- solubile in acqua v Paraffina solubile in idrocarburi v Gelatina solubile per T> 32°C v Bicarbonato di ammonio (gas foaming): in ambiente acquoso a pH acido rilascia CO2 Setacciati per selezionare diametro desiderato Agenti rigonfianti a base di acido carbossilico che reagisce con caloreà rilascia CO2 e acqua • selezione dell’agente più adeguato: • temperatura di reazione / temperatura di fusione del polimero • tossicità TECNICHE TRADIZIONALI: nessuna in grado di realizzare scaffold con pori con alta interconnessione, morfologia dei pori regolare e riproducibile, differente microstruttura in funzione dell’applicazione; nessuna permette l’ottenimento di scaffold multi-strato 3D
limitazioni • complessità nello sviluppo dei processi • stretto intervallo dei materiali utilizzabili • morfologia dei pori non sempre ottimizzabile • bassa interconnessione dei pori • utilizzo di solventi potenzialmente tossici • temperatura, pressione àà difficoltà a inglobare
cellule o biomolecole attive durante il processo àsviluppo di nuove tecniche per la preparazione di scaffold: o metodi avanzati o additive manufacturing

7.B COMPUTER-AIDED TECHNIQUES FOR SCAFFOLD FABRICATION 1. tac/risonanza/tomografia à modello CAD 3D 2. modello CAD à linguaggio macchina 3. STL*file (stereolitografia) àletti tramite le macchine utilizzate per l’additive manufacturing 4. strato per strato, vado a generare le strutture di supporto (es. necessità di parti vuote strutture di supporto che poi vado a eliminare) 5. slicing à oggetto strato per strato 6. rimuovo le strutture di supporto, pulizia e finitura superficiale, ottenendo così il mio modello finito.

8. ELECTROSPINNING (ELETTROFILATURA) tecnica à matrici aventi fibre micrometriche o nanometriche dovute all’uso di un campo elettrico; dimensioni simili a quelle dei componenti dell’ECM Componenti principali: - fonte di potenziale [kV] - capillare metallico (spinneret) - collettore (sistema di raccolta) Sulla superficie della goccia si formano cariche dello stesso segno che danno luogo a forze di repulsione elettrostatica Quando queste forze sono tali da superare la tensione superficiale della goccia, si forma un getto polimerico. Una volta formato, il getto è attratto verso il collettore a causa del campo elettrico. Il getto, durante la distanza tra spinneret e collettore, attraversa una zona di instabilità nella quale è allungato in modo da permettere la formazione delle nanofibre. Queste saranno poi depositate sul collettore PARAMETRI CONCENTRAZIONE SOLUZIONE POLIMERICA ↑ concentrazione ⇒ ↓ formazione di difetti (beads) ↑ concentrazione ⇒ ↑ diametro delle fibre oltre un certo valore ⇒ no electrospinning DIFFERENZA DI POTENZIALE sotto un certo valore ⇒ no getto polimerico ↑ potenziale ⇒ cono di Taylor + getto polimerico oltre un certo valore ⇒ recessione del cono di Taylor ↑ potenziale ⇒ ↑ rugosità delle fibre DISTANZA SPINNERET - COLLETTORE
- valore sufficiente ⇒ evaporazione del solvente (fibra senza solvente)
- sopra / sotto un certo intervallo ⇒ bead variando la distanza ⇒ diversa forma delle fibre (cilindriche o “a nastro”) PORTATA bilanciamento tra soluzione in arrivo dalla sirigna e soluzione elettrofilata sotto un certo valore ⇒ ri,ro del cono di Taylor + beads oltre un certo valore ⇒ grandi beads (gocciolamento: il solvente non è completamente evaporato) portata ⇒ ↓ diametro delle fibre VOLATILITÀ DEL SOLVENTE
• solvente volatile ⇒ corretta quantità di evaporazione tra spinneret e collettore
• ↑ volatilità ⇒ formazione di pori sulle fibre COLLETTORI Piano: orientazione random delle fibre Cilindrico: orientazione random delle fibre- oltre una certa velocità di rotazione del collettoreà allineamento fibre A disco: strutture piane fibre allineate e distanziate (1-2 μm) A piastre parallele: allineamento fibre A telaio (elettrodi 1-3, 2-4 alternativamente messi a terra): à allineamento fibre
APPLICAZIONI Nel campo dell’ingegneria dei tessutiààtecnica impiegata per la produzione di scaffold avanzati nanostrutturati
pelle vasi ematici nervi valvole cardiache muscolo
Vantaggi semplice e a basso costo processo continuo richiede una piccola quantità di materiale applicabile ad un ampio range di materiali polimerici diametro delle fibre variabile tra pochi nm e diversi μm proprietà delle fibre controllate variando i valori dei parametri di processo Svantaggi instabilità del getto possibilità di impiego di solventi tossici

10. BIOFABRICATION Tecnologie AM • normalmente: solventi, alte T, reticolazioni
incompatibili con biomolecole; • con idrogeli (IG): ambiente più “cellfriendly”
IG ad alto contenuto di acquaà incapsulamento di cellule e biomolecole (ambiente 3D che imiti la ECM naturale)
Idrogeli naturali: § segnali chimici presenti à alta vitalità cellulare e velocità di proliferazione § variazioni batch-to-batch e sensibilità delle cellule a queste variazioni bassa riproducibilità dei costrutti es. printing di acqua su un substrato di agarosio disciolto in DMSO L’idoneità di un idrogelo dipende principalmente dalle sue proprietaà chimico-fisiche nelle condizioni di lavorazione dello specifico sistema: § parametri chimico-fisici
o proprietà reologiche (viscosità, tempo di reticolazione o meccanismo di reticolazione
§ parametri di processo specifici o Æ ugello à shear stress o Tempo o
SISTEMA CON DOPPIA SIRINGA: interna deposita alginato esterna: sale di calcio IDROGELI SINTETICI: bassa vitalità cellulare ma sono più precisi
Quando il solo idrogelo non ha adeguate caratteristiche meccaniche: 1. cellule pre-coltivateà tempi troppo lunghi 2. +reticolazioneà compromessa formazione neo-tessuto 3. Rinforzo idrogelo a differenti livelli (DN e IPN)à Non compatibilità con AM 4. Co-deposizione con termoplastici: combinazione di idrogelo e polimero termoplastico con tecnica robotic dispensing e combinazione di elettrofilatura con tecniche di inkjet printing Es. collagene + PCL sistema a bioprinting a 2 teste Elettrofilatura (soluzione polimerica): fibre ad alta risoluzione ma non si ha controllo della deposizioneà possibilità di pori troppo piccoli per la migrazione cellulare Melt electrospinning writing (polimero rammollito): alto controllo dell’organizzazione spaziale: il polimero di rinforzo si degrada a velocità minore fornendo resistenza. Materiali sacrificali e bioink • procedura sacrificale deve essere citocompatibile • realizzazione di reti di canali all’interno di costrutti in
idrogelo • funzione temporanea CRITERI DI PROGETTAZIONE: rigidezza meccanica e prodotti biocompatibili Si procede con la stampa di una rete (ad esempio a base di zucchero) su cui si deposita il prepolimero di idrogelo con cellule in sospensione. La rete viene disciolt in modo tale che i canali siano pervi e da poter utilizzare un flusso che nutra e porti via i rifiuti. materiali che variano le loro proprietà di bulk e nel processo di reticolazione: chain entanglements = raffreddamento di agarosio interazioni ioniche = alginato reticolato con ioni calcio fotopolimerizzazione = idrogeli sintetici a base di PEG attività enzimatica = fibrina reticolata con trombina
precipitazione di proteine = riscaldamento di Matrigel

12. 1. MATERIALI INIETTABILI Maniera meno invasiva per introdurre il biomateriale UTILIZZI: riempimento sacca aneurismatica servire per il rilascio di farmaci, DNA nella terapia genica biomolecole per rigenerare tessuti (proteine, fattori di crescita, colle…) OBIETTIVO: iniettare materiali già caricati con cellule Biopsiaà isolamento celluleà coltivazione VANTAGGI Adattamento al difetto Approccio mini-invasivo
i.Iniezione diretta della soluzione cellulare ii.Incapsulamento in carrier e iniezione • Disponibilità delle cellule ritardata (attesa della degradazione
del materiale) iii. Semina superficie esterna di microcapsule carrier e iniezione • Disponibilità delle cellule immediata per adesione al tessuto
REQUISITI • Passaggio sol-gel adeguato, per la sopravvivenza cellullare,
da materiale estrudibile (siringa) a stabile (dentro il corpo) • Permessa diffusione di nutrienti e di materiali di scarto • Permessa diffusione delle cellule stesse • Viscosità adeguata • Degradazione adeguata (controllo della reticolazione) ESEMPI v Gelatina reticolata v Idrogeli reticolati a base di:
§ Alginato: reticola con ioni bivalenti di carica opposta v Modificato con RGD x promuovere adesione cellulare
§ Metilcellulosa (es. studio cellule tumorali) § Chitosano gelazione indotta con T o pH
v Smart materials v Idrogelo di collagene gelazione indotta con T o pH v Colla di fibrina reticolazione fisiologica (es. in tessuto
cardiaco infartuato) v P-NIPAAm ( ¯T - sol / T- gel) v Copolimero a blocchi PLA-PEG-PLA
(fotopolimerizzazione x reticolazione) La sopravvivenza cellulare si basa sulla diffusione di gas e molecole: 1. Particle leaching per creare pori nella matrice 2. ridurre le dimensioni dell’idrogelo: A. Inglobare in microsfere le cellule B Cellule poste sulla microsfera v Microsfere di chitosano v Microsfere in collagene o gelatina – si possono
agglomerare le cellule v Microsfere di PLA-PGA geometria più controllata Inoltre • possibile caricamento con fattori di crescita • microsfere porose per migliore adesione cellulare ATTENZIONE microsfere ≠ microcapsule
12. 2. MICROCAPSULE IN IDROGELO REQUISITI • membrana semipermeabile: scambio di nutrienti e
materiale di scarto tra interno ed esterno • non permeabilità anticorpi e cellule immunitarie (non sarebbe necessaria terapia immunosoppressiva) SCOPI 1. Protezione dal sistema immunitario delle cellule non-
autologhe trapiantate (approccio di terapia cellulare – materiali stabili)
2. Rilascio di cellule autologhe per il riparo di tessuti (approccio di medicina rigenerativa – materiali a rapida degradazione)
PRODUZIONE Fuoriuscita controllata da ugello. Il diametro è funzione di gravità e tensione superficiale. Ulteriore controllo: • Flusso d’aria che spinge le sfere fuori dall’ugello Corona circolare d’aria attorno all’ugello Dgoccia diminuisce con la pressione di aria • Differenza di potenziale tra ugello e contenitore v Alginato + bagno di Ca2+ per crosslinking v PEG per ulteriore rivestimento Tempo di rilascio delle cellule può̀ essere molto differente v microsfere di alginato e fibrina Variando la concentrazione di calcio cloruro vario la reticolazione e la cinetica di degradazione. Cinetica di degradazione adeguata: • Concentrazione di alginato nella soluzione
o Mantenendola costante e aumentando la [Ca2+] si hanno microcapsule più stabili
• Concentrazione degli ioni bivalenti nel bagno (agente reticolante) o Mantenendola costande e aumentando la
[alginato] si hanno microcapsule menostabili L’alginato reticolato con ioni calcio può essere rivestito con diversi materiali per variare ulteriormente la cinetica di degradazione: v Es. Alginato + rivestimento di Chitosano Le cellule contenute all’interno della microcapsula, iniziano ad uscire quando la microcapsula si rompe e vanno ad aderire sul pozzetto di coltura (sono vitali e possono promuovere la rigenerazione di un tessuto).

13. CELL SHEET ENGINEERING Si sfruttano le capacità delle cellule di sintetizzare la matrice del tessuto senza l’uso di scaffold.
SELF ASSEMBLY MODALITà A. TEVM TEVA assemblate arrotolando un singolo strato
di cellule SMC o fibroblasti per ottenere TEVMA B. arrotolamento di un foglietto di fibroblasti attorno ad
un foglietto di SMC (stdTEVMA) C. il TEVMA viene prodotto per la presenza di SMC e
fibroblasti nello stesso foglietto (ssTEVMA) Anelli cellulari: 1. stampi in policarbonato replicati in PDMS 2. realizzazione dei pozzetti di agarosio sullo stampo PDMS 3. TEVGs da cellule aggregate e ECM 4. gli anelli di tessuto posti su mandrini tubolari in silicone e coltivati per 7 giorni per preparare costrutti tubolari Vantaggi (confronto con i metodi tradizionali impiegati in TE) • substrati thermo-responsive aderiscono senza suture • evita materiali per scaffold (no reazione
infiammatoria) • thermo-responsive evitano l’impiego di enzimi • migliore controllo della semina cellulare v NIPAAm LCST transizione idrofobica/idrofilica in sol. acquose Tcritica (LCST) pari a 32 ̊C 37°C à idrofobico- catene aggregate àadesione cellulare 20°C à idrofilico à distacco foglietto Superficie termo-sensibile (le catene di poli-N-isopropilacrilammide sono innestate sul fondo di una piastra di coltura in PS) METODO 1: 1. 37°C sospensione nella piastra di cultura 2. 20°C rimuovo cellule e mezzo di coltura (non un layer) METODO 2: 1. 37°C sospensione nella piastra di cultura 2. 20°C con membrana adesiva prelevo layer di cellule APPLICAZIONI: trapianto di cornea riparazione legamento paradontale
v Metilcellulosa Soluzioni con ioni salting-in à aumento LCSTà NO! Soluzioni con ioni salting-out à riduzione LCSTà OK distacco a 35°C (la LCST della gelatina è intorno ai 50°C) ANALISI REOLOGICHE DELLA METILCELLULOSA 1. rampa di temperatura per definire la regione di viscoelasticità lineare (LVR) – curve G’ e G’’- sforzo% 2. Temperature sweep per studiare la cinetica di gelazione dell’idrogelo curva logG’-T- determino LCST
Confronto di metilcellulosa in bulk e printed Rampa di sforzo T=20°Cà comportamento simile T=37°C= comportamento lineare fino al 1% strain Rampa di temperatura: per il printedà LSCT più bassa e in alto ho un plateau intoro ai 40 (rimane gel). La stampa, l’estrusione ha influenzato le caratteristiche! Valutazione effetto dell’estrusione à valutazione variazione ponderale a 37°C
D𝑝𝑒𝑠𝑜(%) = (𝑤𝑒𝑖𝑔ℎ𝑡0 − 𝑤𝑒𝑖𝑔ℎ𝑡2)
𝑤𝑒𝑖𝑔ℎ𝑡2
In cui t rappresenta diverse durate della prova • 24 h notevole incremento dei valori medi di swelling • tutti i campioni rigonfiano e raggiungono un plateau,
mantenuto fino a 4 giorni (eccezione per MC-PBS20 print)
• 7 giorni diminuzione del peso dell’idrogelo, segnale dell’inizio del processo di degradazioneà differenza significativa nel grado di swelling fra idrogeli bulk e print:
CARATTERIZZAZIONE BIOLOGICA linee cellulari: cellule endoteliali murine fibroblasti murini, modificati per l’espressione della GFP, e delle cellule endoteliali murine citotossicità indiretta → no effetti citocompatibilità diretta: incremento vitalità fra 24 e 48h. I valori dell’intensità di fluorescenza RFLU dei campioni bulk sono superiore a quelli dei campioni print dovuta ad una diversa area superficiale nelle diversi campioni. L’orientamento e la morfologia cellulare sono influenzate dalla topografia superficiale del substrato di coltura è contact guidance. prove di distacco verifica della vitalità e della proliferazione delle cellule del foglietto a seguito del distacco, tutti i foglietti restano adesi al fondo del pozzetto, l’adesività è garantita dalle proteine dell’ECM ed è mantenuta integra. Le cellule migrano fuori dal foglietto e colonizzano il pozzetto. Ho alta vitalità cellulare anche a seguito del distacco.

14. METODI DI CARATTERIZZAZIONE DI SCAFFOLD, STRUTTURE 3D, MATRICI PER LA MEDICINA RIGENERATIVA INCOMPLETO!

15. MODIFICHE SUPERFICIALI SUPERFICI MICROSTRUTTURATE pattern superficiale topografico e chimico: potente strumento per la regolazione di • funzione delle cellule • controllo di scala e pattern CONTACT GUIDANCE: le modifiche superficiali, come picchi e valli, hanno ruolo nel comportamento cellulare (allineamento e migrazione). ricettori di stiramento delle cellule soggetti a tali sollecitazioniàvengono attivati e riorganizzano il citoscheletro secondo la topografia della superficie La risposta cellulare alla topografia è determinata da: dimensioni topografia, tipologia cellule e composizione del substrato. Caratteristiche alla nano scala possono influenzare: adesione, migrazione, proliferazione, differenziazione. TECNICHE DI MICROFABBRICAZIONE TOP DOWN – rimozione materiale BOTTOM-UP – assemblaggio materiale TECNICHE LITOGRAFICHE (top-down) Fotolitografia: 1. Substrato con ossido superficiale 2. Posizionamento resist 3. Posizionamento maschera + radiazione luminosa 3.A resist positivo: si degrada dove esposto 3.B resist negativo: si polimerizza dove esposto 4. Rimozione dell’ossido dove esposto e lavoro sul substrato 5. Rimozione del resist rimasto e ottenimento del wafer Resist positivo: alta risoluzione, eliminato con soluzione acquosa (resist negativo con solventi chimici dannosi ma costa meno!) Litografia a fascio elettronico: fascio elettronico collimato e direzionato sopra il resist positivo che si degraderà determinando un disegno. Litografia ad RX RX disegnano con maschera il pattern desiderato; risoluzione elevata, non si utilizzano lenti ma le maschere sono difficili da produrre e richiede utilizzo sincrotrone SOFT LITHOGRAPHY- tecnica non litografica à uso di uno stampo elastomerico per esempio in PDMS » REPLICA MOLDING Si ha un master in PDMS su cui si fa lo stampo del materiale » MICROCONTACT PRINTING Stampo in PDMS su cui di fa aderire nel pattern un inchiostro molecolare. Lo stampo poi disegna il pattern su un substrato » HOT EMBOSSING Substrato riscaldato su cui viene impresso lo stampo e poi riscaldato » SCANNING PROBE LITHOGRAPHY A. PATTERN MECCANICO E TERMODINAMICO: punta usata per arare + riscaldamendo punta per fondere
B. SCRATCHING: valli rimosse a forma della punta utilizzata. C. DIP PEN: tramite AFM trasferimento di specie molecolari e apposizione in siti specifici APPLICAZIONI E CARATTERIZZAZIONE • Confronto altezza valli e picchi del master appena fatto e master dopo #repliche per vedere se viene modificato; (non ha senso per microcontact printing!)

16. TESSUTO MUSCOLARE: possibili approcci per la rigenerazione del tessuto Muscolo scheletrico: struttura gerarchica con filamenti, miofibrille, sarcolemma ecc.--> strutture con orientazione preferenziale. Patologie del muscolo scheletrico:
• trauma, ischemiaà posso usare cellule autologhe • distrofia muscolare à NO cellule autologhe
REQUISITI Biocompatibilità, stimoli topografici e/o chimici t.c. si abbia l’allineamento del miotubi, degradabilità, adeguate proprietà meccaniche. APPROCCI: Terapia con cellule staminali: iniezione diretta Approcci con scaffold: impianto costrutto per le prove in vitro: cellule immortalizzate (si deve valutare lo scaffold quindi non sono importati cellule primarie) SCAFFOLD MICROSCANALATI (CON REPLICA MOLDING) Stampo in PDMSà replica moldingà solvent casting à film PLA-TMC (necessità di un materiale con buona deformabilità). Per ottenere lo stampo di PDMS si parte dal wafer di Si, su cui si esegue un processo di litografia.
• Profilometria del wafer di silicio con diversi master v PLA-TMC
prove di creep-recovery e di relaxation-recovery c
colture cellulari in vitro • Microscopio ottico a 24h • Analisi ad immunofluorescenza a 7 giorni
Risultati: scanalature piccole à maggiore orientazione

17. Possibili approcci per l’incapsulamento di isole pancreatiche e per il rilascio di insulina diabete tipo 1 ⇒ distruzione delle β-cellule
mancanza di rilascio di insulina diabete tipo 2 ⇒ progressivo difetto nel rilascio di insulina Diabete di tipo 1 terapie: • somministrazione insulina • trapianto isole pancreatiche: immunosoppressione, farmaci perdita del 60% delle cellule trapiantate à utilizzo di biomateriali per migliorare l’efficienza del trapianto di isole; REQUISITO PRINCIPALE: cellule contenute nelle capsule devono avere una buona vitalità, la membrana deve far passare ossigeno e nutrienti per le cellule, ma allo steso tempo la parete deve fare uscire l’insulina e non far passare i macrofagi e tutti i responsabili della risposta immunitaria e infiammatoria (le cellule sono di altri pazienti).

18. Strutture tessili in fibroina per la rigenerazione del legamento crociato (ACL) Funzioni: supportare e rinforzare l’articolazione
prevenire eccessive traslazioni del femore sull’asse antero-posteriore
Cause di rottura: rotazione forzata del ginocchio iperestensione del ginocchio
AUTOGRAFT da tendine rotuleo MA scarsa capacità rigenerativa e solo parziale ripristino della funzionalità! REQUISITI caratteristiche meccaniche ≈ LCA nativo (2000 N) porosità̀ tale da garantire colonizzazione cellulare degradazione controbilanciata da crescita di neotessuto v fibroina della seta (sgommatura, 40’ a 120°C) v PGA e PLA STRUTTURA gerarchica del ACL: • tropocollageneà microfibrilleà fibrilleàfibre • con la seta: bavelle fibroinaàfilamentià filato Caratterizzazione morfologica Struttura complessa: Anima + guaina Vari tipi di intreccio woven, treccia tridimensionale… MicroCT: informazioni sulla distribuzione delle dimensioni della porosità, sulla porosità accessibile di anima e guaina. Caratterizzazione meccanica
- non differenza condizioni anidre o idratate, si sono fatte in condizioni idratate ≈ condizioni fisiologiche (la fibroina non è idrofilica quindi struttura poco idratata)
- sgommatura dopo tessitura - induce un rilassamento della fibroina (e del cordino)
PROVE A TRAZIONE 1. Toe region (0-5 mm spostamento): “districamento” del disordine nelle fibre nella struttura in SF (silk fibroin) Siccome è facile deformare le fibre disordinate della struttura di SF, questa parte della curva ha una pendenza relativamente bassa. 2. Linear region (5-12 mm spostamento): quando le fibre di SF iniziano ad districarsi, la struttura si allunga, aumentando la rigidezza della struttura di SF 3. failure region: quando le singole fibrille nella struttura di SF comincia a rompersi, il danno aumenta, la rigidezza diminuisce e la struttura inizia a rompersi. PROVE A FATICA Anima interna rottura a 106 cicli Struttura complessa rottura per #cicli >106 ma dopo ci sarà anche il contributo del neotessuto! Studio di biodegradazione in vitro Caso in cui ci sia azione idrolitica di una proteasi batterica à dopo 80 dd perde 20% peso a secco e frammentazione delle fibre di fibroina Prove di trazione: dopo 100 gg perde il 30/40% della forza ma dovrebbe intervenire il neotessuto!
Prove di citotossicità in vitro Metodo indiretto: campione immerso in coltura e riferimento alla scala dei gradi di reazione. Prove di citocompatibilità in vitro SEM: Rivestimento con gelatina per promuovere adesione cellulare H&Eà non penetrano bene anche nell’anima Bioreattore per studi in vitro simulazione in vivo requisi, meccanici:
• trazione: deformazione imposta 1-10 % • torsione: fino a 90° • frequenza di applicazione: modulabile (aiuta alla colonizzazione della struttura)
Il SBF nella camera con adeguato apporti di O2 CO2 e co.. MSCs adese alle fibre di SF e formazione di un layer cellulare sulla superficie della guaina e dell’anima della stru%ura Analisi in vivo Impianti su pecore @3mesi: micro CT: foro di inserimento aumentato istologia: formazione tessuto legamentoso,
no infiammazione @6mesi: prove meccaniche su campioni espiantati. Rottura fragile e non duttileà Dimensioni troppo grandi per l’animale?

19. Progettazione e caratterizzazione di uno scaffold biomimetico per il riparo di difetti osteocondrali Cartilagine articolare strato superficiale: collagene random strato intermedio lamellare: collagene radiale strato profondo: collagene circonferenziale Approcci chirurgici: stimolazione, impianti di condrociti autologhi e protesi. Tissue engineering: scaffold + cellule v Polimeri biodegradabili:
Naturali: biocompatibili ma basse proprietà meccaniche Sintetici proprietà programmabili e riproducibili ma rilascino prodotti acidi di degradazione (PLA e PGA) STRATEGIE POSSIBILI: monofase: più materiali in un unico blocco difficile avere un gradiente di proprietà realizzazione più semplice bifasico: combinazione opportuna di materiali gradiente più facile da ottenere POSSIBILE APPROCCIO A. SCHIUMA PU: componente che sopporta il carico Sintesi uno stadio Propietà variabili in funzione della sintesi Degradazione lentaà bio-integrazione Miscela di reazione(poliolo+diisocianato+ catalizzatore ) posta in uno stampo di PMMA, si ottiene la schiuma da cui si ottiene poi il provino. Micro CT: porosità e porosità aperta (≈ 86%)
proprietà̀ adeguate per la TE del difetto osteocondrale B. TRATTAMENTO CON CALCIO FOSFATI:
aumenta l’ osteoconduttvità fornisce ioni calcio necessari per indurre la reticolazione della pectina; studio di due strategie:
o coating o nucleazione: trattamenti in soluzioni diversi faccio avvenire
sulla superficie la formazione di calcio fosfati (HA) tre approcci VAC: immersione x 2h del campione nella camera in vuoto SEM: particelle sferiche
dimensione: ordine dei μm spesso organizzazione in piccoli agglomerati
NUCL-SBF: immersione in SBF 1.5 ( anche 4 settimane) SEM: rete di cristalli plate-like
spessore: ~100 nm morfologia: simile per i sample i ai vari time points
NUCL: considero dei cicli successivi di nucleazione. SEM: I ciclo: cristalli rod-shaped (φ: 40 nm) e plate-shaped (larghezza: 400 nm) allineati à assemblaggio star-shaped II ciclo: cristalli prisma,c-shaped; dimensione laterale: 240–800 nm III ciclo: cristalli cauliflower-like shaped; building blocks: nano-plates (spessore: ~31 nm, larghezza: 190-255 nm Con camera a vuoto e nucleazione à aumento del peso, Analisi XRD: NUCL-SBF e NUCL picchi di HA monofasica allargamento dei picchiààpiccola dimensione e bassa cristallinità di HAà simile alla HA na,va presente nell’osso naturale
Prove meccaniche – compressione statica - wet PU/NUCL e PU/NUCL-SBF: maggiore pendenza, sforzo max e area di isteresi C: RIVESTIMENTO GEL DI PECTINA: polisaccaride naturale Forma gel con ioni come Ca2+ due siringhe tenute insieme da un connettore, posiziono il campione in una delle due siringhe, e dall’altra parte c’è la soluzione di pectina che viene fatta passare avanti e indietro per 10 volte attraverso le due siringhe PU/VAC/PECT: modulo elastico
- basso in confronto a quello del tessuto osteocondrale - confrontabile con quello di scaffold che hanno mostrato
risultati promettenti in vitro/vivo scaffold impiantati in vivoàdeposito di nuova ECMàresistenza meccanica bilanciata dalla formazione di neo- tessuto Carrier di cellule Prove di stabilità a 37°C- @4d, la schiuma SBF è più stabile altri metodi ho una diminuzione iniziale in quanto l’adesione dei calcio fosfati è meno stabile. caratterizzazione meccanica gel di pectina mi permette di migliorare le proprietà meccaniche nessuna differenza significativa nel modulo elastico tra i metodi di del rivestimento. PU-VAC-PPECT ha maggiore sforzo massimo e maggiore area di isteresi. Il PU-VAC-PECT ha un modulo elastico basso in confronto a quello del tessuto osteocondrale (17 +- 3 KPa), ma questo modulo elastico è confrontabile con quello di scaffold che hanno mostrato risultati promettenti in vivo e in vitro. scaffold impiantati in vivoàdeposito di nuova ECMàresistenza meccanica bilanciata dalla formazione di neo- tessuto prove di creep recovery à presenza della pectina aumenta la componete viscosa dello scaffold, ho maggiore deformazione residua (con un solo ciclo). Test in vitro: si sono scelte cellule da placenta umana Metodo della doppia siringa in cui la soluzione in cui è immerso il campione è composta da 300 μl di 2.25 % v/v pectina e 40 μl di mezzo di coltura con 250,000 cellule aumento dell’attvità metabolica @21gg SEM: cellule completamente adese alle pareti dei pori presenza di particelle di materiale inorganico e deposizione di matrice organica Test in vivo - modello animale Micro CT: aumento % volume tessuto osseo da 3 a 24 settmane, più consistente per scaffold PU/VAC/PECT SEM: come sopra analisi istologica: @3w- NO deposizione osteoidi e iniziale guarigione tessuto osseo per apposizione trabecole adiacenti @6w - inizio deposizione osteoidi e iniziale rigenerazione cartilagine, in particolare con hPDCs @24w - NO guarigione in controllo (i.e. dife%o cri,cal size) rigenerazione tessuto in corso, in particolare per osso NO cartilagine matura

20. Rigenerazione Guidata del Sistema Nervoso Periferico CNS: Assenza di rigenerazione spontanea Tessuto cicatriziale Espressione geni insufficiente Infiammazione debole PNS: Rigenerazione spontanea possibile Il tessuto non nervoso NON ripristina le connessioni elettriche Il corpo cellulare dei neuroni si trova all’interno del CNS o in strutture chiamate gangli. I processi cellulari si estendono per innervare tutte le regioni del corpo Lesioni La recisione di un nervo causa perdita delle funzioni, motoria, sensitiva, vegetativa in base al tipo di fibre che il nervo reciso contiene La lesione è tanto più grave quanto più è prossimale, in quanto implica minore possibilità di sopravvivenza per i neuroni (la rigenerazione è affidata alle sole cellule esistenti) RIGENERAZIONE
1. Degenerazione tratto distale dell’assone 2. Rimozione dei detriti (macrofagi) 3. Proliferazione/riorganizzazione delle cellule di Schwann 4. Ramificazione degli assoni à Insuccesso della rigenerazione nel SNP: Le estremità di un nervo reciso tendono a ritrarsi l tessuto cicatriziale cresce rapidamente rispetto al nervoso e tende ad invadere la zona e bloccare il processo In assenza di un intervento chirurgico la rigenerazione è improbabile; Si può inoltre avere crescita incontrollata delle fibre nervose (neuroma) che può portare a dolore spontaneo. Strategie chirurgiche: - perdita di tessuto ridotta: Sutura diretta/colla di fibrina - perdita di tessuto estesa: autograft
limiti: Sacrificio di un nervo sano Infiltrazione di tessuto cicatriziale
NCG APPROCCIO INGEGNERISTICO à tubo e gli suturo le estremità del nervo all’interno: riallinea ed impedisce formazione di tessuto cicatriziale. All’interno del tubo di possono inserire farmaci e fattori di crescita. Inoltre sono preseenti anche dei vasi che permettono la formazione di una matrice di fibrina su sui si possono depositare le nuove cellule si Schwann. @3w- fase assonale. Nervi prossimali ricrescono verso la parte distale “morta” Materiale biocompatibile Proprietà meccaniche adeguate Suturabile Sterilizzabile Di corrette dimensioni Biodegradabile Superficie interna liscia Porosa (se il tratto di nervo da riparare è esteso)
Elettrospinning delle guide del NGC: perchè la matrice elttrofilata ha bassa porosità e le cellule
non riescono a entrare, ma restano in superficie; inoltre scambio di nutrienti e prodotti di rifiuto Elettrospinnign del riempimento del NGC: All’interno guida impiantata vuota si forma una matrice di fibrina; , si sono utilizzate delle fibre elettrofilate di fibrinogeno come riempimento del tubo elettrofilata, le fibre hanno un buon effetto di guida sulle cellule di Schwann. Indirizzare gli assoni verso il punto giusto I progressi futuri consistono nella realizzazione di un modello in vitro affidabile e in prove in vivo comparative e sistematiche.

21. Modelli di tessuto patologico in vitro Scaffold in vitro per riproduzione tessuti 3D - sano per studio sullo sviluppo di patologie - patologici x studio di farmaci
Esiste anche la tecnologia 2.5D: pozzetto ricoperto con materiale che mima situazione in vivo, ma non è ancora considerabile 3D. - Ancoraggio indipendenti (non ho materiale 3D) - Ancoraggio dipendenti – si ha un materiale substrato TECNICHE Ancoraggio indipendenti » METODO HANGING-DROP Sospensione cellulare in pipetta Iniettata in canali per cui si ha la formazione di una goccia appesa al materiale Goccia sospesa in coltura: non avendo un substrato su cui aderire le cellule si aggregano tra loro (struttura 3D di cellule) » SPINNER FLASK Presente un’elica che mixa la soluzione e non permette la deposizione sul fondo delle cellule à aggregazione » SUPERFICI NON ADESIVE Non aderendo alla superficie le cellule si aggregano tra loro TECNICA A METà TRA ANCORATE E NON ANCORATE • MICROSFERE INGEGNERIZZATE in modo che le cellule si aggreghino in sferoidi e si hanno due scelte: 1. sciolgo la microsfera esterna mantenendo lo sferoide cellulare 2. tengo microsfera con cellule dentro Esempi: 1. metodo hanging drop - arrey
irraggiamento, farmaco e combinazione à si osserva riduzione della proliferazione cellulare rispetto al controlloà Utile per controllo cellule tumorali Cellule in aggregati sferici sono più resistenti e simulano meglio la situazione in vivo.
2. sferoidi in microcapsule- per l’ottenimento di sferoidi
tumorali studio morfologia + saggio live/ dead
TECNICHE ANCORAGGIO DIPENDENTE NB. • Morfologia/topografia dello scaffold • Proprietà̀ meccaniche • Molecole bioattive/segnali cellulari Controllo sull’adesione cellulare » 3D PRINTING - Cellule formano sferoidi Confronto: struttura 2D e 3D con paclitaxel • coltura 2D dopo 8 giorni tutte morte • coltura 3D dopo 8 giorni vitalità maggiore » ELETTROSPINNING Esempi A. Tessuto adiposo seno umano de-cellularizzato come
modello in vitro per lo sviluppo di tumore al seno B. Modello 3D di metastasi all’osso derivante da tumore
al seno à Schiuma in PU usata come struttura 3D per fabbricazione in vitro di tessuto osseo su cui indurre formazione metastasi in vitro Caratterizzazione della schiusa: test carico-scarico a compressione test citossocità indiretta (vit >70 %) OK! Test fluorescenza per proliferazione OK SEM ADS Cellule sane- produce matrice inorganica Cellule tumorale – poca matrice inorganica Posso testa farmaci per osservare eventuali miglioramenti.

22. INGEGNERIA TESSUTO ADIPOSO VASCOLARIZZAZIONE DI SCAFFOLD ATTRAVERSO STRUTTURE SACRIFICALI Tessuto adiposo: tessuto connettivo 3D con specifiche funzioni: • Isolamento • Protezione e supporto • Immagazzinamento energia • Organo endocrino (coinvolto nella secrezione di ormoni) Ingegneria tessuto adiposo: necessaria in caso di trauma, tumori, cosmesi STRATEGIE UTILIZZATE x ricostruzione seno Autologous tissue flap: ricostruzione mammella con tessuto muscolare del dorso Alloplastic implant: pretesi sintetiche Autologous fat transfer: t. adiposo sano e la traferisco ma il volume può cambiare. à scaffold tessuto adiposo - Porosità adeguata per proliferazione - Segnali biochimici: controllo adesione e funzionalità
cellule - Proprietà meccaniche simili a quelle del tessuto sano - Degradabilità con tempi coerenti con la rigenerazione - Vascolarizzazione per apporto di nutrienti e rimozione
prodotti metabolici MATERIALI Sintetici (e.g., PLA, PEG, PCL) naturali (e.g., HA, collagene, dAT, gelatina) ibridi STRATEGIE x vascolarizzazione Fattori di crescita: promuovono vascolarizzazione Bioreattori Sferoidi di cellule sane Strutture sacrificali STRUTTURE SACRIFICALI Produco rete da inserire nello scaffold Viene sacrificata lasciando delle reti per guidare la rivascolarizzazione Materiali per strutture sacrificale Pluronic PVA, zuccheri, gelatina Esempio - strategia per ingegneria del tessuto adiposo Idrogelo gelatina reticolata (ho legami covalenti) + Idrogelo di alginato (reticolato con ioni Ca2+) in: 1. Microsfere per ottenere macropori nell’idrogelo di
gelatina 2. stampato 3D per ottenere canali con geometria
controllata 3. rimosso selettivamente attraverso chelanti di ioni Ca2+,
ottenendo macropori e con canali vuoti per la vascolarizzazione.
A seguito dell’immersione in soluzione di chelante di Ca2+: • la gelatina reticolata rimane • l’alginato viene dissolto selettivamente Microsfere di alginato: - prodotte con flusso coassiale di soluzione di
alginato/aria e reticolate in soluzione di CaCl2 - per ottenere scaffold in idrogelo di gelatina poro. CARATTERIZZAZIONE: Microscopia elettronica (sem) e istologia per valutare morfologia struttura ottenuta Prove meccaniche in compressione (DMA) per valutare proprietà rispetto al tessuto adiposo - abbassamento P.meccaniche simile al tessuto adiposo
subcutaneo Degradazione enzimatica in vitro per valutare possibile rimodellazione in vivo; campioni: - stabili se immersi in acqua s - degradati se immersi in soluzione enzimatica i canali sono stati riempiti con cellule verificando che il canale permette la crescita cellulare. Citocompatibilità – test quantitativi Alamar blue Citocompatibilità – test qualitativi Test live/dead Oil red O Staining Test ex vivo: Connessione dei canali ottenuti con arteria da ratto e flusso di sangue all’interno dei canali

23. MATERIALI POLIMERICI NATURALI PER LA REALIZZAZIONE DI SCAFFOLD MICROSTRUTTURATI MEDIANTE DEPOSIZIONE ELETTROCHIMICA à Chitosano migra verso l’’anodo Fenomeni di riduzione dell’acqua determinano lo sviluppo di bolle di idrogeno Aumento locale del pH che determina la coagulazione del chitosano sull’elettrodo carico negativamente. PARAMETRI DI PROCESSO (Condizioni di cella) corrente e voltaggio - tempo - modalità: correnti continue e alternate) - Elettrodo di lavoro: liscio o patternato Voltaggio Tensione continua Tensione alternata: riduzione porosità e facilità di distacco del substrato soluzione Si hanno diversi acidi in cui è disciolto il chitosano (pH<6) Aumento deposito aumento spessore A parità di acido si hanno diversi pH che influenza l’apertura della porosità A parità di pH si hanno diversi risultati di porosità e interconnessione con diversi acidi BLEND v Chitosan/PEO : aumento proprietà meccaniche Meccanismo di deposizione del PEO Chitosano verso anodo si trascina il PEO, influenzando morfologia superciale del materiale depositato Il contenuto di peo fa aumentare la rugosità Rapporto chit/peoà Depositi inferiori all’aumentare della quantità di peo in soluzione Rigidezza diminuisce all’aumentare del contenuto di PEO Possibili strutture con pattern: buchi rettangolari IMM. Fluorescenza- si osserva la presenza di buchi: riduzione acqua in soluzione che forma bolle di idrogeno à strutture ordinate con microporosità. Differenza strutture lisce e patternate: no differenze significative v Chitosan/collagen (1:0, 5:1, 3:1) Aumento proprietà meccaniche Aggiungendo collagene si ha riduzione porosità Blend con PEO
v Chitosan/BioGlass Importante per struttura gerarchica complessa dell’osso, composta da unità sferiche. Biovetro è un fattore bioattivo Chitosano + biovetro: scaffold ibrido (matrice organica con rinforzo inorganico) + biovetro + deposito inorganico Test: immersione in in SBF Picchi dei fosfati di calcio + t_immersione + deposito Per migliorare adesione cellulare è stata aggiunta la gelatina + biovetro modificato che contiene il niobio. Elettrodo di acciaio: strutture danneggiate Modifica elettrodo: elettrodo Ti: deposizione favorevole tensione e corrente: si è passati da potenzio-statica a galvano-statica Controllo di tensioneà strutture migliori e omogene dal controllo tempi e ampiezze delle onde: strutture omogenee RISULTATI biovetro depositato 8-9% rispetto alla massa del campione depositato riduzione della dimensione dei pori con (?) + biovetri – capacità di rigonfiamento + biovetro – velocità di degradazione Gelatina e chitosano da soli si degradano più facilmente Rilascio ioni del biovetro – non tossici Rilascio di niobio talmente basso da non dare problemi Possibilità di replicare strutture con porosità orientata è un vantaggio in diversi casi oltre all’osso. Strutture con macroporosità + microporosità diffusa superficiale. Elettrodo di Ti lavorato al laser presenta rugosità superficiale che viene anche replicata sullo scaffold che si era creato. I Pori orientati promuovono allineamento Deposizione su strutture con scanalature guida (idea di applicazione cardio vascolare) I pori orientati promuovono la vascolarizzazione. Test in vivo nel topo sottocute- 3/6 settimane Confronto porosità random e porosità guidata DAPI e Marcatore actina CD31 permette la conta dei vasi neo generati Test istologici- ulteriore conferma della vascolarizzazione si possono realizzare strutture gerarchiche: si può modulare rugosità, spessore, capacità di rigonfiamento (utile per rilascio di farmaci), avere multilayer (tessuti interfaccia).

24. MATRICI TUBOLARI PER LA RIGENERAZIONE DI VASI DI PICCOLO CALIBRO Principali patologie dei vasi ematici: stenosi aneurisma medio-largo diametro- protesi goretex piccolo calibro à problematici! Approcci: clinico: autograft (safena del paziente stesso) alternativo: ingegnerizzazione tessuti REQUISITI:
- biocompatibile: non trombogenico - meccanica: compliance adeguata - processabilità: velocemente disponibile
idea: umano stesso come produttore principale per la rigenerazione MATRICI DECELLULARIZZATE: vaso di origine bovina decellularizzati e la struttura rimasta in collagene è usata per ristrutturare il vaso. Problema: la decellularizzazione può comportare la degradazione della componente di collagene. APPROCCI BIOLOGICI Scaffold di sole cellule: - corpo come bioreattore - tubo di PDMS impiantato nel corpo che viene rivestito da
capsula fibrotica (fibroblasti + collagene) - dopo 2-3 settimane: si ottiene un tubo di cellule - il tubo viene girato in modo tale che le cellule muscolari siano
all’esterno. Problema: disponibilità non immediata Cell sheet Cellule in terreni di coltura: diversi foglietti cellulari: à cellule muscolari scheletriche + fibroblasti 1. 2 foglietti diversi da assemblare 2. Approccio standard 3. Approccio one step Problema: disponibilità non immediata Bioring Pozzetti su cui si seminano le cellule, si fanno aggregare le cellule. I ring formati si assemblano per formare un vaso. Tempo: 24h Approccio utile anche per rigenerazione trachea. POLIMERI NATURALI Blend di sintetici e naturali biodegradabili. Fibroina della seta: caratteristiche meccaniche superiori. Bozzoli subiscono processo di sgommatura Dissoluzione in LiBr che promuove distacco firboina e sercina Dialisi: membrana con porosità t.c. venga filtrata la sericina Si ottiene soluzione di fibroina e si ottengono tramite solvent casting dei film in conformazione silk I (solubile in acqua- non stabilizzata*) Electrospinning: si ottengono fili di D=100nm collettori cilindrici in modo tale da ottenere dei vasi (1.5 ≤ ∅ ≤ 6 mm) collettore piatto: non si ha rotazione del collettore Difetti: beads e zone non fibrose *si passa da silk I a silk II attraverso dipping in metanolo proprietà morfologiche: SEM no variazioni significa/ve della morfologia e delle dimensioni delle fibre
proprietà chimiche: ATR-FTIR . si osserva shift dei picchi ovvero si è avuto passaggio da silk I a silk II per quantificare si calcola indice di cristallinità: rapporto di banda dei picchi OTTIMIZZAZIONE: - tempo adeguato in metanolo - distanza collettore-spinnerer - collettore adeguato - diametri molto piccoli servono per es. chirurgia
piediatrica e chirurgia dei capillari. CARATTERIZZAZIONE MATRICI TUBOLARI ELETTROFILATE Morfologia macro SEM: misuro ∅ delle fibre Proprietà meccaniche (strutture immerse in PBS+T=37°C) - prove a trazione assiali grafico Carico-deformazione (difficile definire la sezione resistente per definire lo sforzo) - prove a trazione circonferenziali compliance (∅ = 6 mm) struttura porosa permeabileà ? palloncino Cfribroina ≈ Csafena à OK! Caratteristiche biologiche TEST IN VITRO_ grafico: variazione di peso- tempo si osserva un collasso delle fibre INTERAZIONE CELLULARE IN VITRO(fibroblas/ murini - 3T3) 1- citotossicità 2- citocompatibilità per valutare la vitalità: confronto assorbanza tra sola fibroina e coltura PROBLEMA porosità troppo bassa per cui le cellule non riescono a colonizzare la struttura SOLUZIONE coltura cilindrica rotante: l’accelerazione centrifuga forza il passaggio delle cellule. TEST IN VIVO SOTTO-CUTE (modello animale: ratto) Formazione piccola capsula fibrotica TEST IN VIVO BIOFUNZIONALI (modello animale: ratto) - assenza di trombosi o dilatazione aneurisma/ca senza
apparente iperplasia. - H&E: neoformazione di tessuto vascolare nel lume STRUTTURA BILAYER Interno: fibroina elettrofilata Esterno: gel di fibroina elettrofilata (maggiore porosità) Possibile funzionalizzazione RGD trattamenti post-processing- variazione della cristallinità: -liofilizzazione + water vapor annealing (37°C per 2 h), WVA -liofilizzazione + metanolo, MeOH Caartterizzazione strutture a due strati: meccanica a trazoine e circonferenziale caratterizzazione biologica in vitro RIVESTIMENTO DI STRUTTURE ELETTROFILATE IN FIBROINA DELLA SETA Deposizione di gelatina sopra struttura in fibroina Caratterizzazione: SEM Caratterizzione meccanica radiale fase di creep/recovery = 2 min stress applicato = 0.1 or 0.3 MPa corrispondente a - SFt: 50 or 150 mmHg - SFt/gel: 75 or 225 mmHg

ANALISIDINAMICO-MECCANICA:caratterizzazioneproprietàviscoelasticheproprietàviscoelastiche:proprietàsolidielastici+proprietàfluidinewtonianisfasamentotrasforzoedeformazionediun0°<d<90°Definendounadeformazionee(t)=e0sin(vt)eilrelativosforzosfasatos(t)=s0sin(vt+d)à
s(t)=s0sin(vt)cosd+s0cos(vt)sindassociabileadunnumerocomplessoE*=E’+E’’
siricavanoduecomponenti:1. componentepuramenteelastica(E’,storagemodulus,modulo
conservativo)energiaimmagazzinata2. unacomponentedissipativa(E’’,lossmodulus,modulodissipativo)energia
dissipata(generalmentepercalore)• tanδ=E”/E’
TIPOLOGIEDIAFFERRAGGI- tensionmode- compressionmode- shearsandwichmode- dualcantilevermode- singlecantilevermode- 3pointbendmode
DMA:determinazionedellavariazionedelleproprietàdiunmaterialeinfunzioneditempo,Temperatura,frequenza• rampaditemperatura(feampiezzacostanti)
outputf(T)=E’(T)edE’’(T)curveE’,E’’-T:E”piccomax+E’caloàTg
E”piccomin+E’caloàTm
curvatand-T:1°piccomax=Tg2°piccomax=Tm
picchibassi:transizionisecondariegeb(rilassamenti)• rampadifrequenza(teampiezzacostante)• outputf(f)=E’(f)edE’’(f)
creep/recovery:deformazionemonitorataneltemposollecitazioneistantaneaint1emantenutacostantesforzoportatoa0at2
• stressrelaxation/recovery:sforzomonitoratoneltempoσ(t)deformazioneistantaneaemantenutacostante
ANALISIREOLOGICHE:rispostadelmaterialeadunostresstinterminidi
• shearrateg(velocitàdirotazione)• straing(ampiezzadioscillazione)
- studiodellarelazionetrasforzoedeformazione:lineareononlineare?- misurareiparametriviscoelastici
MODULOG= !"#$%#&'"#$()%*#+'
VISCOSITàh= !"#$%#!-')$$).'
deformazione=g = 0(.)34
shearrate=g = Dg
D.
v coppiaestress=misurarelacoppiaapplicataalrotore;forzoèproporzionaleallacoppiaamenodiunacostantechedipendedallageometriadelsistema
s=Ks·Mv scostamentoangolareestrain:misurare/controllarelevariazioniangolare;
deformazione(normalmenteespressacomedeformazionepercentuale):proporzionaleall’angoloamenodiunacostantechedipendedallageometria
g=Kg·qDEFINIZIONEDIMODULO
5∙7sq∙7g
= sg = 𝐺
v velocitàangolareeshearrate:proporzionaleallavelocitàangolareamenodiunacostantechedipendedallageometria
g = 𝐾g ∙ Ω
DEFINIZIONEDIVISCOSITà:;∙<sΩ∙<g
= s
g= h
àresistenzainternadiunfluidoalloscorrimentoGEOMETRIEPOSSIBILI
- cilindriconcentrici- conoepiatto:geometriaconlecostantidiconversionepiùsemplici;liquidi
senzaparticelledisperseodispersioni/emulsioniconparticolatomoltopiccoloshearrateomogeneosututtoilraggionecessitapococampione(circa1ml)permettedimisuraresistemiabassa/bassissimaviscosità
- piattiparalleli:campionimoltoviscosieanalisidisospensionicongrandeparticolato
- torsionerettangolare
REOMETRO
Caratterizzazionedellarispostadiunmaterialeincondizionidi:• flusso(rotazionecontinua)
determinoviscositàf(shearrate,T)• sollecitazioneoscillatoria
determinoE’,E”f(T,f,A)• transitorio
determinorispostadiuncampionesottopostoasforzocostante(creep)eadeformazionecostante(stressrelaxation)
§ FLUSSO1. Shearratecostante:
misuradellaviscositàadunvaloredishearratecontrollodelladipendenzadellaviscositàdaltempo
2. Rampadishearrateostress(asaliree/oscendere)misuradellapseudoplasticitàodelloshearthickeningdelcampionemisuradellimitediscorrimento
3. Rampadishearrateinregimestazionario4. Rampaditemperatura
dipendenzadellaviscositàdallatemperatura+
§ OSCILLAZIONE1. timesweep:sollecitazioneconF,Tedfcostanti
scopi:misuradellastabilitàdiunmaterialestudidireticolazioneevaporazionedisolventi
2. strain/stresssweep:sollecitazioneconFcrescente,Tedfcostanti3. Frequencysweep:sollecitazioneF,ampiezzaeTcostanti,rampadif
SCOPI:misuradelladipendenzaproprietàviscoelastichedallafanalisistrutturadigel
4. RampaditemperaturaconfeampiezzacostantideterminazionedellaTgedelletransizionidiordinesuperiore)studidireticolazioneindottidalcalorestudiodelladipendenzadelleproprietàvisco-elastichedallatemperatura
Ilcampioneèsottopostoadunosforzo(odeformazione)chevarianeltempo(sinusoide);larispostadelcampioneanalizzatainterminidiampiezzaedisfasamentorispettoallaforzantePARAMETRI- ModuloComplessoG*:comportamentogeneraledelmateriale- ModuloconservativoG’:legatoalcomportamentoelastico- capacitàdelmaterialediaccumularel’energiadellaforzantesottoformadideformazionielastiche(reversibili)
- ModulodissipativoG’’:capacitàdelmaterialedidissiparel’energiadellaforzanteattraversoilcaloreedeformazionipermanenti(scorrimento)
- Tanδ:tangentedell’angolodisfasamentoMisurataviscositàcomplessaη*(componenteconservativa+dissipativa)• ZonaViscoelasticaLineare(LVR):rangedistrainnelqualelarispostadel
campioneèlineare,ossiaincuiivalorideimoduliG’eG’’sonocostantialvariaredellaampiezzadioscillazione§ TRANSITORIO1. stressrelaxation:deformazioneistantaneaemantenuta
monitoratolostressesercitatodalcampioneecalcolatoilmodulodirilassamentoàrapportotralostresseladeformazione
2. creep–recovery:stressistantaneoecostanteperunintervalloepoirimossomonitorataladeformazionedelcampionedurantel’applicazioneerimozionedellostress

ANALISIDMA ANALISIREOLOGICA
RampaditemperaturaTg Output:
curveE’(T)Icalo+E”(T)Ipiccotandàpiccomax
Output:curveG’(T)Icalo+G”(T)Ipiccotandàpiccomax
Viscositàh(Sr,T)
ProvadiFLUSSO• Shearratecostanteh(Sr,t)• RampadiTàh(T)
E’edE” RampaditemperaturaàE*(T)
RampadifrequenzaàE*(f)Influenzacomportamentielasticoeviscoso Creep-recoveryestress-relaxation
Deformazioneresidua Creep-recoverystress-relaxation
variazionedimensionaleneiciclidiprova,areadiisteresi(sepresente),deformazione
residua
proveatrazioneciclichesuproviniadanello